Слайд 1ЛИНЕЙНЫЕ ПРЕОБРАЗОВАНИЯ УРАВНЕНИЯ МИХАЭЛИСА – МЕНТЕН
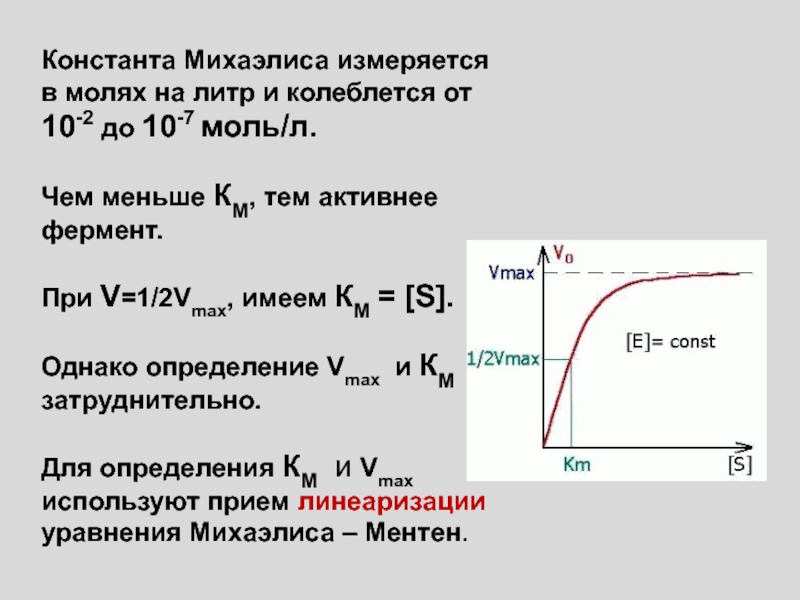
Слайд 2Константа Михаэлиса измеряется в молях на литр и колеблется от
10-2 до 10-7 моль/л.
Чем меньше КМ, тем активнее фермент.
При
V=1/2Vmax, имеем КМ = [S].
Однако определение Vmax и КМ затруднительно.
Для определения КМ и Vmax используют прием линеаризации уравнения Михаэлиса – Ментен.
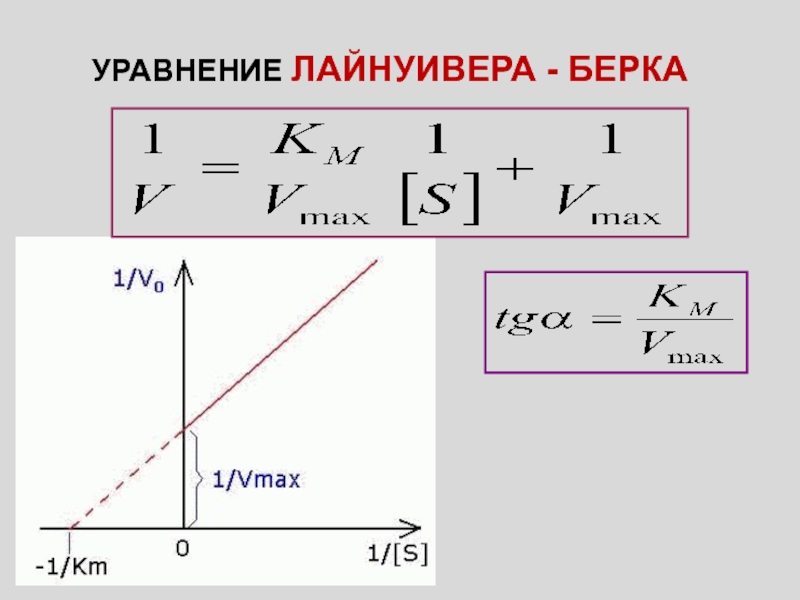
Слайд 3УРАВНЕНИЕ ЛАЙНУИВЕРА - БЕРКА
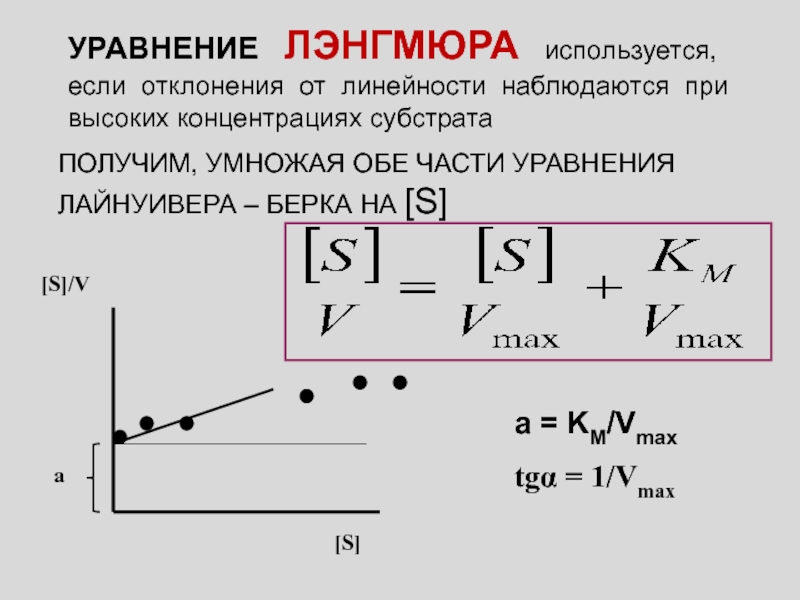
Слайд 4УРАВНЕНИЕ ЛЭНГМЮРА используется, если отклонения от линейности наблюдаются при высоких
концентрациях субстрата
ПОЛУЧИМ, УМНОЖАЯ ОБЕ ЧАСТИ УРАВНЕНИЯ ЛАЙНУИВЕРА – БЕРКА НА
[S]
а = KM/Vmax
tgα = 1/Vmax
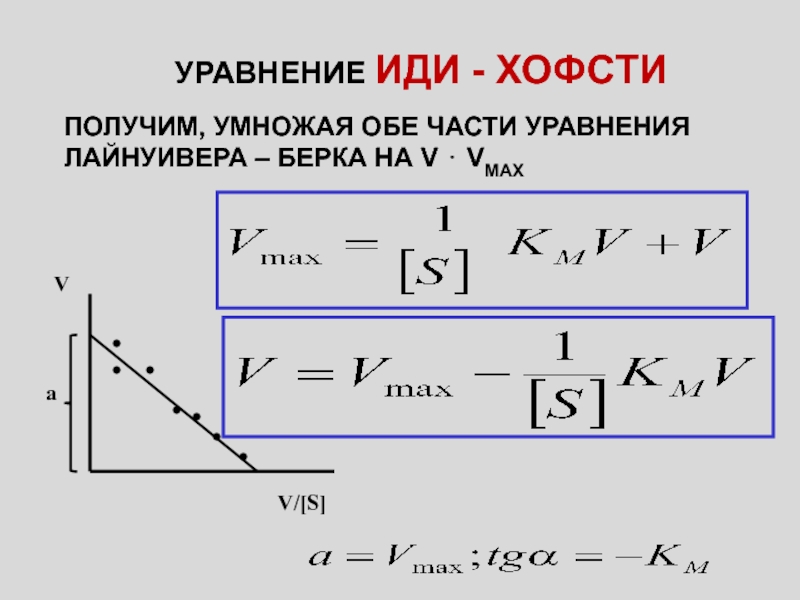
Слайд 5УРАВНЕНИЕ ИДИ - ХОФСТИ
ПОЛУЧИМ, УМНОЖАЯ ОБЕ ЧАСТИ УРАВНЕНИЯ ЛАЙНУИВЕРА –
БЕРКА НА V ⋅ VMAX
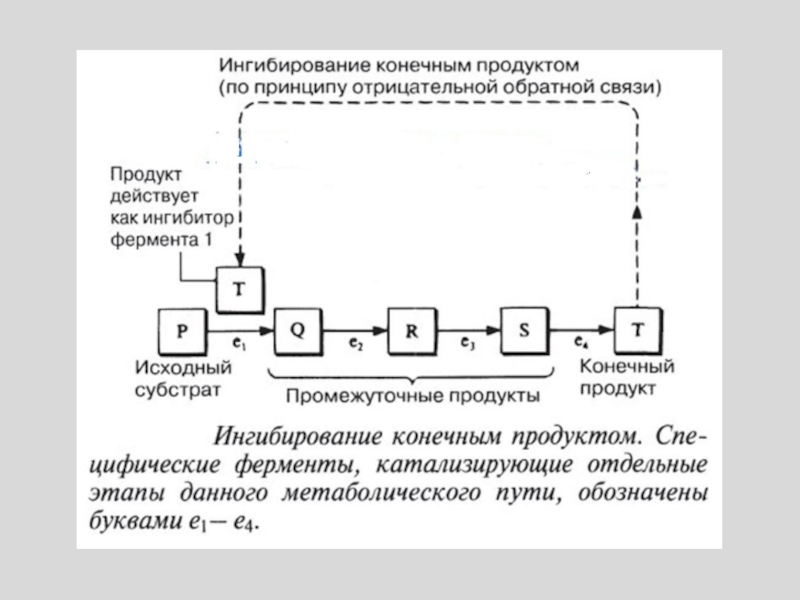
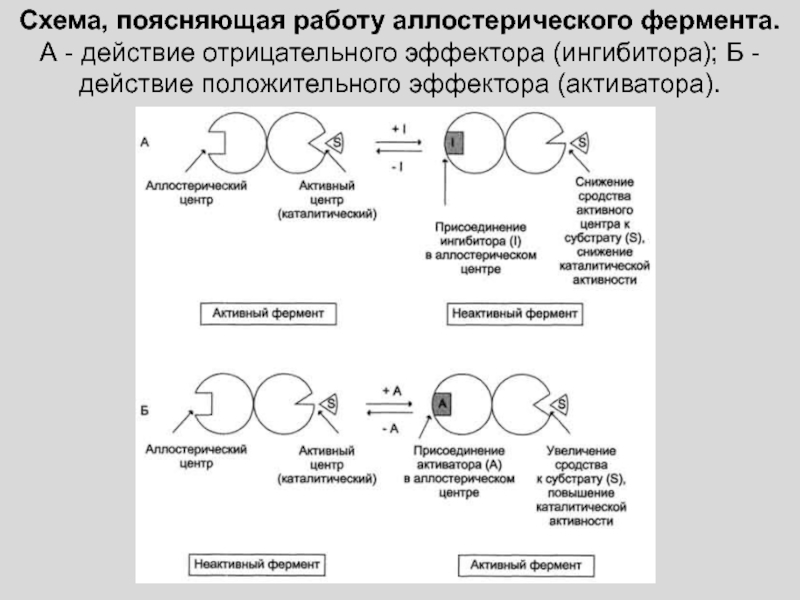
Слайд 7ДЛЯ МНОГИХ ФЕРМЕНТОВ, КАТАЛИЗИРУЮЩИХ КЛЮЧЕВЫЕ СТАДИИ МЕТАБОЛИЗМА, ХАРАКТЕРНА ЧУВСТВИТЕЛЬНОСТЬ К
МЕТАБОЛИТАМ, КОТОРЫЕ ОТЛИЧАЮТСЯ ПО ХИМИЧЕСКОЙ СТРУКТУРЕ ОТ СУБСТРАТОВ ЭТИХ ФЕРМЕНТОВ.
ПРИМЕР: ИНГИБИРОВАНИЕ ПЕРВОГО ФЕРМЕНТА БИОСИНТЕТИЧЕСКОГО ПУТИ КОНЕЧНЫМ ПРОДУКТОМ РЕАКЦИИ
Слайд 9ОПИСАННЫЙ МЕХАНИЗМ РЕГУЛЯЦИИ ОСУЩЕСТВЛЯЕТСЯ ПО ТИПУ ОБРАТНОЙ СВЯЗИ.
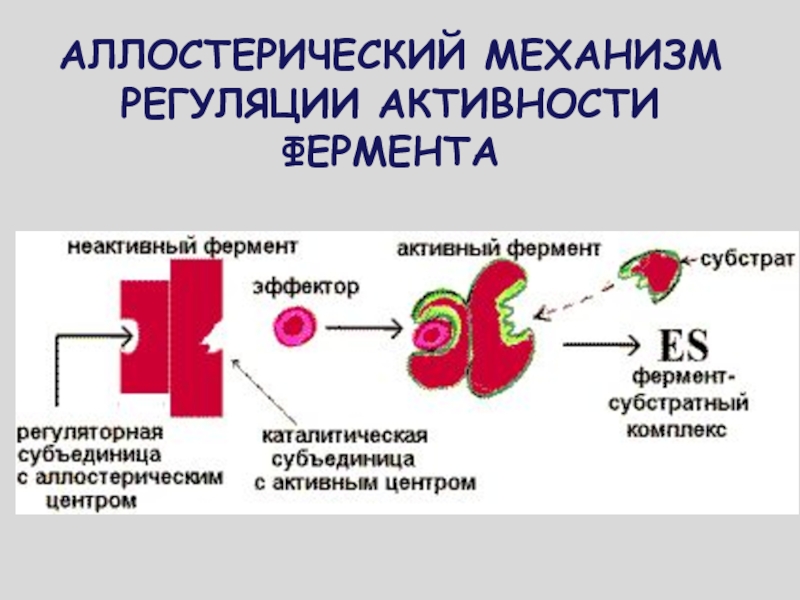
ЧТОБЫ ОТРАЗИТЬ
РАЗЛИЧИЯ В ХИМИЧЕСКОЙ СТРУКТУРЕ СУБСТРАТА И МЕТАБОЛИТА, РЕГУЛИРУЮЩЕГО ФЕРМЕНТАТИВНЫЙ ПРОЦЕСС,
ПОДОБНЫЕ МЕТАБОЛИТЫ-РЕГУЛЯТОРЫ НАЗВАЛИ АЛЛОСТЕРИЧЕСКИМИ
(ОТ ГРЕЧЕСКОГО «АЛЛОС» - ДРУГОЙ И «СТЕРЕО» - ПРОСТРАНСТВЕННЫЙ)
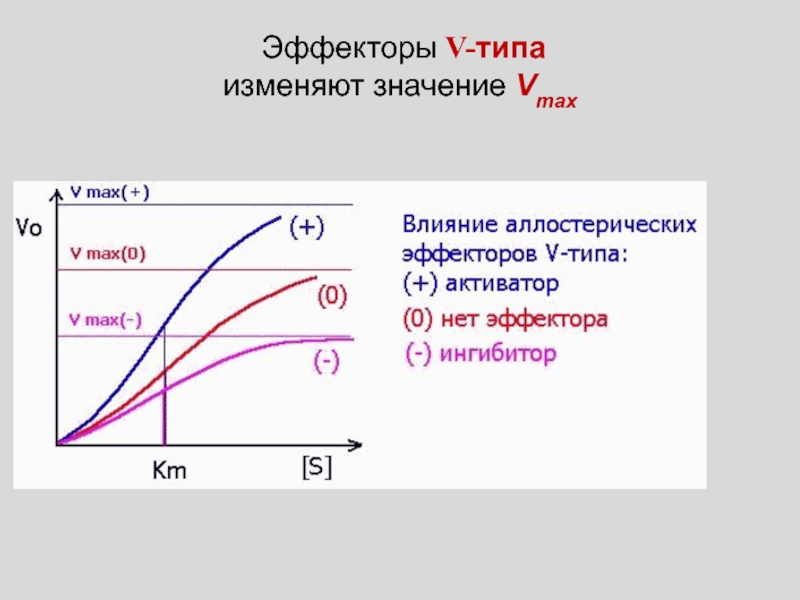
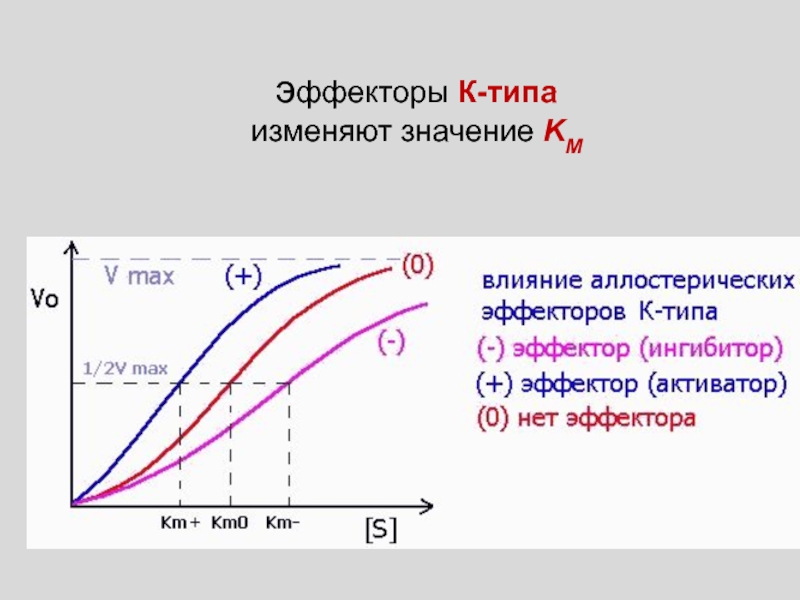
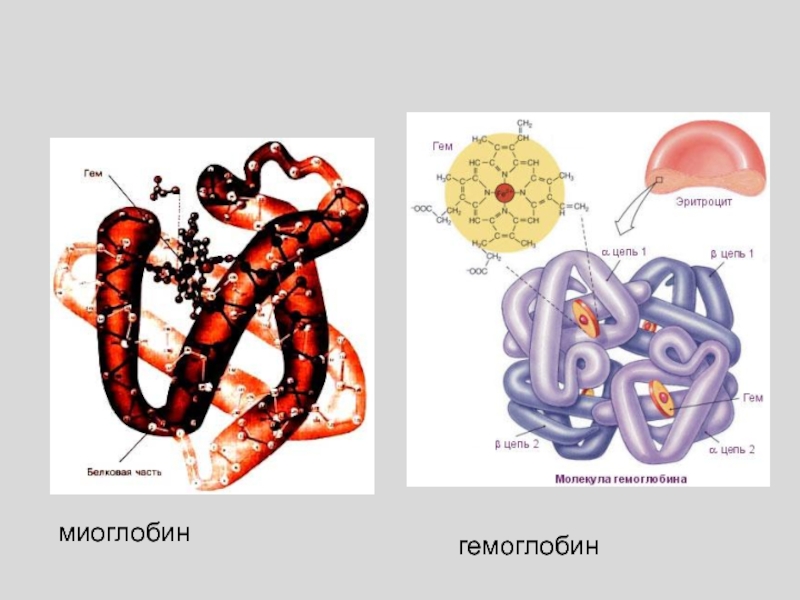
Слайд 21
КОНСТАНТЫ СВЯЗЫВАНИЯ ИДЕНТИЧНЫХ ЦЕНТРОВ ИЗМЕНЯЮТСЯ ПО МЕРЕ ИХ ЗАПОЛНЕНИЯ,
КООПЕРАТИВНОЕ
СВЯЗЫВАНИЕ
Слайд 22А. ХИЛЛ РАССМОТРЕЛ МОДЕЛЬ МАКСИМАЛЬНОЙ КООПЕРАТИВНОСТИ
В РАВНОВЕСНОМ РАСТВОРЕ ЛИГАНДА Х
И МАКРОМОЛЕКУЛ ПРИСУТСТВУЮТ
ЛИБО МАКРОМОЛЕКУЛЫ С НЕЗАНЯТЫМИ ЦЕНТРАМИ,
ЛИБО КОМПЛЕКСЫ
ЛИГАНДА С МАКРОМОЛЕКУЛАМИ, У КОТОРЫХ ВСЕ ЦЕНТРЫ ЗАНЯТЫ.
Слайд 23ОБРАЗОВАНИЕ КОМПЛЕКСА ЕХ МОЖНО РАССМАТРИВАТЬ КАК КИНЕТИЧЕСКУЮ РЕАКЦИЮ, КОНСТАНТА КОТОРОЙ
РАВНА К
E + X ⮀EX
K
Слайд 24
УРАВНЕНИЕ ХИЛЛА
K – КОНСТАНТА СВЯЗЫВАНИЯ
E + X ⮀EX
K
ОТСЮДА
Слайд 25
Y – СТЕПЕНЬ НАСЫЩЕНИЯ БЕЛКА ЛИГАНДОМ
УРАВНЕНИЕ ХИЛЛА
Слайд 26
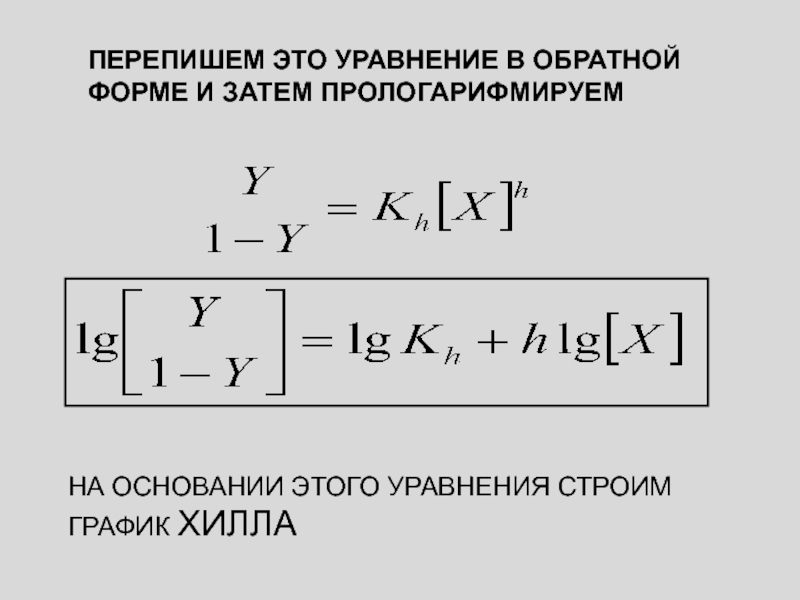
ПРЕОБРАЗУЕМ ЭТО УРАВНЕНИЕ (ЗАПИШЕМ В ОБРАТНОЙ ФОРМЕ)
Слайд 27
ПЕРЕПИШЕМ ЭТО УРАВНЕНИЕ В ОБРАТНОЙ ФОРМЕ И ЗАТЕМ ПРОЛОГАРИФМИРУЕМ
НА ОСНОВАНИИ
ЭТОГО УРАВНЕНИЯ СТРОИМ ГРАФИК ХИЛЛА
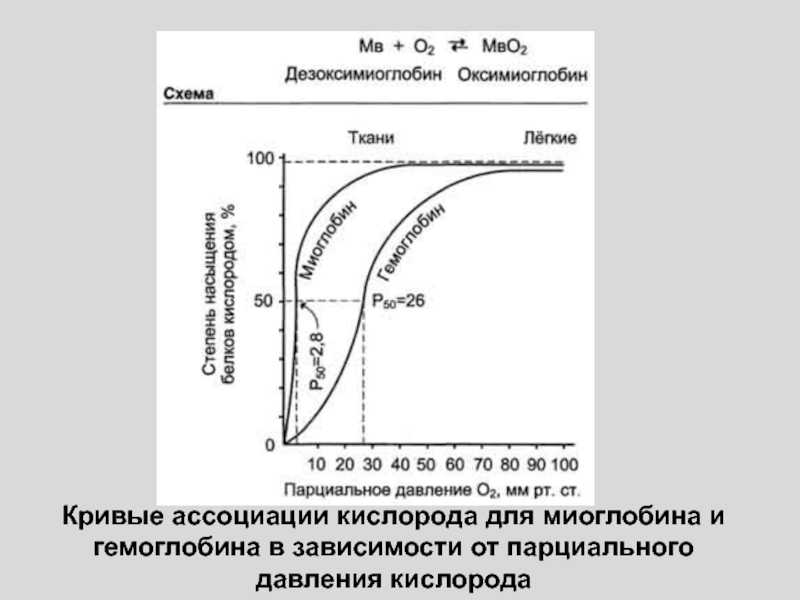
Слайд 28lg[Y/1-Y]
lg[X]
График Хилла для насыщенного кислородом гемоглобина
Слайд 29Уравнение Хилла удовлетворительно описывает связывание лигандов аллостерическими белками в интервале
от 10 до 90% насыщения.
За пределами этого интервала экспериментальная
кривая отклоняется от прямой.
Слайд 30НА ЭТОМ ГРАФИКЕ МОЖНО НАЙТИ КОНСТАНТУ СВЯЗЫВАНИЯ Кh и КОЭФФИЦИЕНТ
ХИЛЛА h (tgα), КОТОРЫЙ ХАРАКТЕРИЗУЕТ СТЕПЕНЬ КООПЕРАТИВНОСТИ
ЕСЛИ h=1, ТО КООПЕРАТИВНОСТЬ
ОТСУТСТВУЕТ
МАКСИМАЛЬНОЕ ЗНАЧЕНИЕ h РАВНО ЧИСЛУ ЦЕНТРОВ СВЯЗЫВАНИЯ.
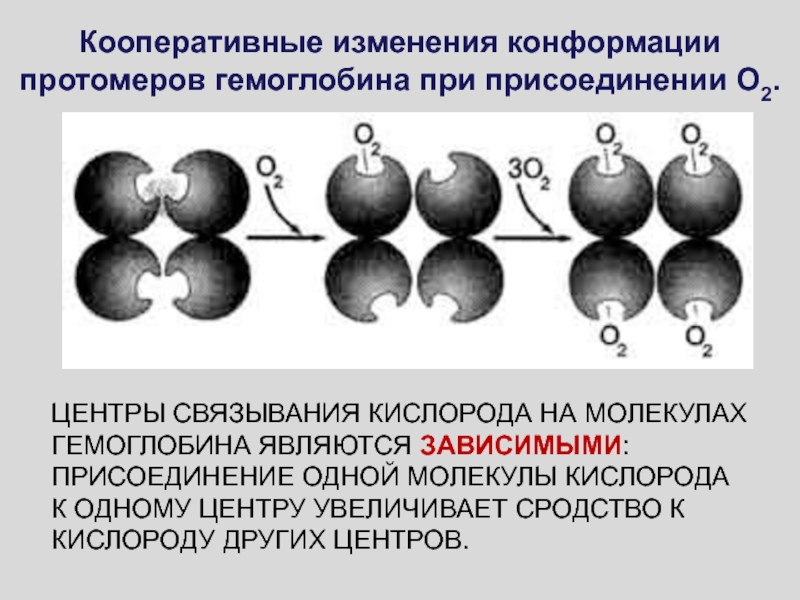
Слайд 31ЕСЛИ h>1, ТО ИМЕЕТ МЕСТО ПОЛОЖИТЕЛЬНАЯ КООПЕРАТИВНОСТЬ.
Присоединение одной молекулы
лиганда к активному центру фермента увеличивает сродство к лиганду остальных
активных центров
ЕСЛИ h<1, ТО ИМЕЕТ МЕСТО ОТРИЦАТЕЛЬНАЯ КООПЕРАТИВНОСТЬ.
Присоединение одной молекулы лиганда к активному центру фермента уменьшает сродство к лиганду остальных активных центров.
Слайд 32
Физиологическое значение кооперативного связывания:
положительная кооперативность обеспечивает резкое изменение степени
сродства в очень узком диапазоне концентраций лиганда.
Слайд 33МОДЕЛИ АЛЛОСТЕРИЧЕСКИХ ФЕРМЕНТОВ
Слайд 34СУБЪЕДИНИЦЫ ФЕРМЕНТА МОГУТ НАХОДИТЬСЯ В ДВУХ КОНФОРМАЦИЯХ:
R (relaxed –
расслабленное состояние)
T (tense – напряженное состояние).
КОНФОРМАЦИЯ R ИМЕЕТ ВЫСОКОЕ
СРОДСТВО К СУБСТРАТУ
КОНФОРМАЦИЯ T ИМЕЕТ НИЗКОЕ СРОДСТВО К СУБСТРАТУ
Слайд 351965 г., Жак Моно, Джефри Уайман и Жан-Пьер Шанже
Модель
согласованного механизма (симметричная модель)
Жак Моно
Слайд 36
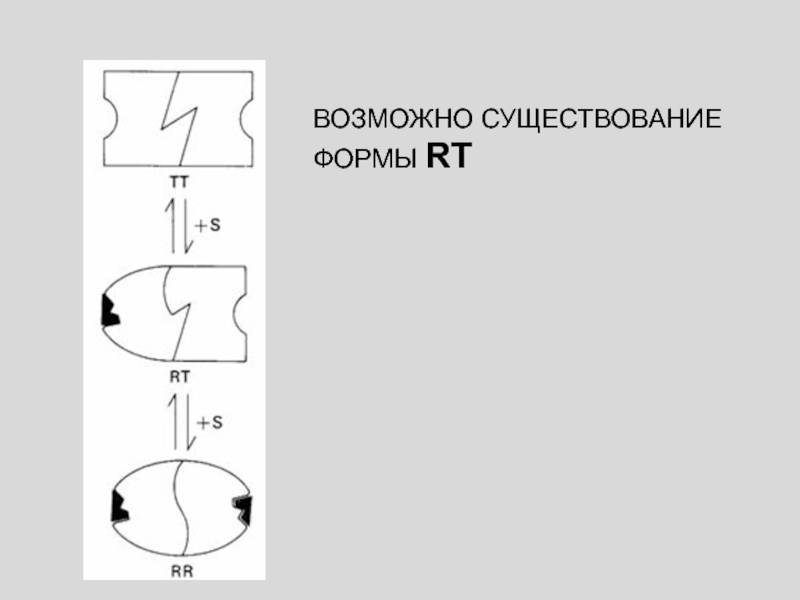
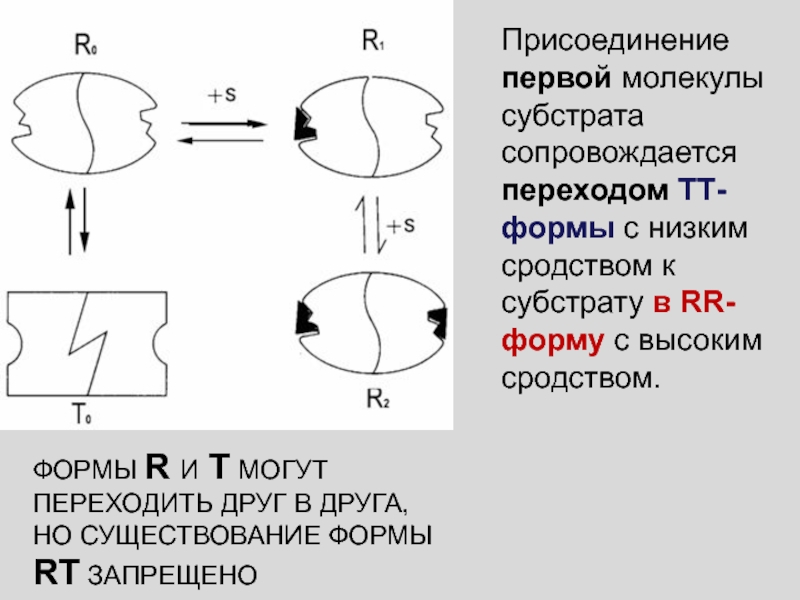
Присоединение первой молекулы субстрата сопровождается переходом ТТ-формы с низким сродством
к субстрату в RR-форму с высоким сродством.
ФОРМЫ R И
T МОГУТ ПЕРЕХОДИТЬ ДРУГ В ДРУГА, НО СУЩЕСТВОВАНИЕ ФОРМЫ RT ЗАПРЕЩЕНО
Слайд 37Фермент представлен только двумя конформационными состояниями, находящимися в динамическом равновесии.
При этом все субъединицы данной молекулы фермента находятся в одной
и той же конформации; промежуточных состояний нет, существуют только симметричные олигомеры
Слайд 38
Зависимость степени насыщения Y активных центров фермента от концентрации субстрата
[S] в соответствии с моделью согласованного механизма КR = 10-5
M.
L – константа аллостерического равновесия
L=T/R
Слайд 39Модель последовательного механизма
Автор: Даниэль Кошланд
Дэниел Кошланд
(1920–2007)
Слайд 41 Каждая субъединица может существовать в одном из двух возможных
конформационных состояний (R или Т).
2. Связывание субстрата изменяет форму
той субъединицы, к которой он присоединяется. Конформация другой субъединицы при этом существенно не меняется.
3 Конформационные изменения, вызванные связыванием субстрата на одной субъединице, могут увеличивать или уменьшать сродство к субстрату другой субъединицы той же молекулы фермента.
Слайд 42Фермент приобретает каталитически активную конформацию только в результате взаимодействия с
субстратом. Если фермент состоит из нескольких субъединиц, то конформационное изменение
одной из них, вызванное субстратом, последовательно передается другим субъединицам и облегчает им связывание добавочных молекул субстрата.
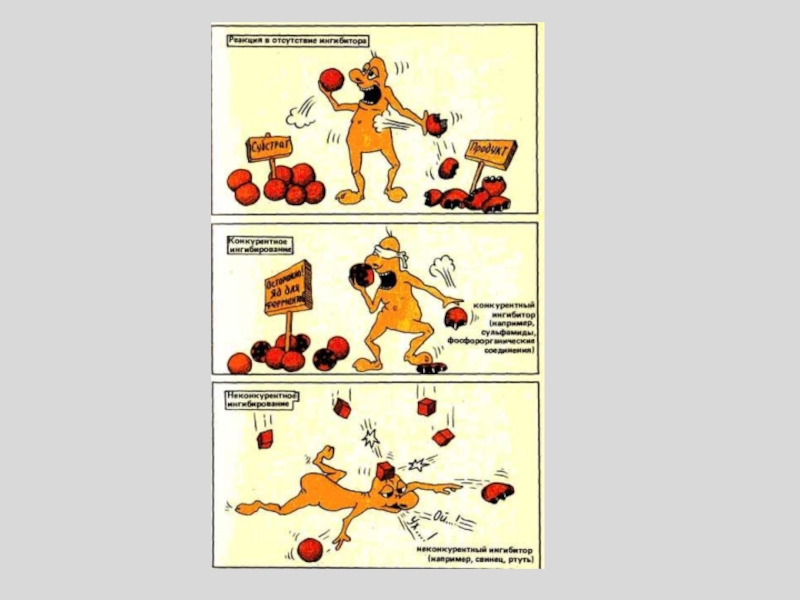
Слайд 45КОНКУРЕНТНОЕ ИНГИБИРОВАНИЕ
За активный центр фермента вместе с субстратом конкурирует ИНГИБИТОР
Так, малоновая (1), щавелевоуксусная (2) и глутаровая (3) кислоты ингибируют
фермент СУКЦИНАТДЕГИДРОГЕНАЗУ, субстратом которой является янтарная кислота (4) (СУКЦИНАТ), так как они сходны по строению с субстратом
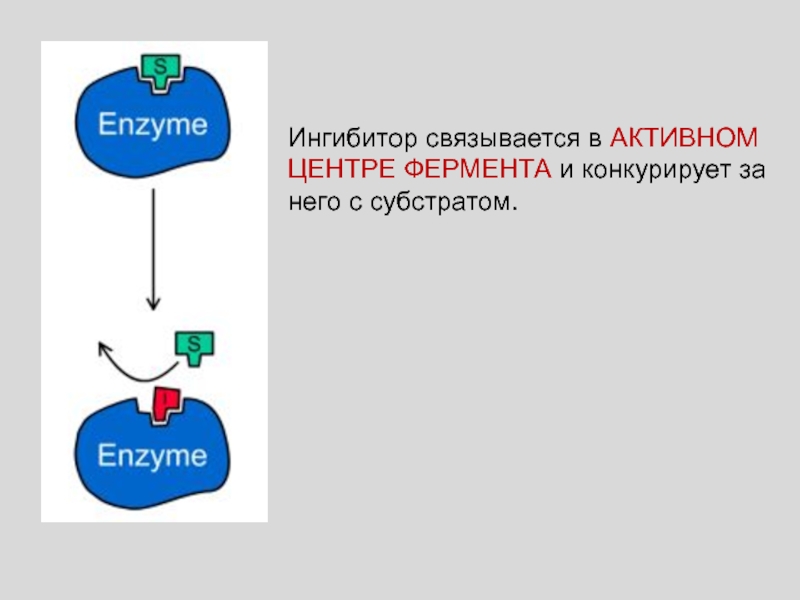
Слайд 46Ингибитор связывается в АКТИВНОМ ЦЕНТРЕ ФЕРМЕНТА и конкурирует за него
с субстратом.
Слайд 47
k1
k-i
ki
k-1
k2
УРАВНЕНИЕ ЛАЙНУИВЕРА – БЕРКА ДЛЯ КОНКУРЕНТНОГО ИНГИБИРОВАНИЯ
- НЕАКТИВНЫЙ КОМПЛЕКС
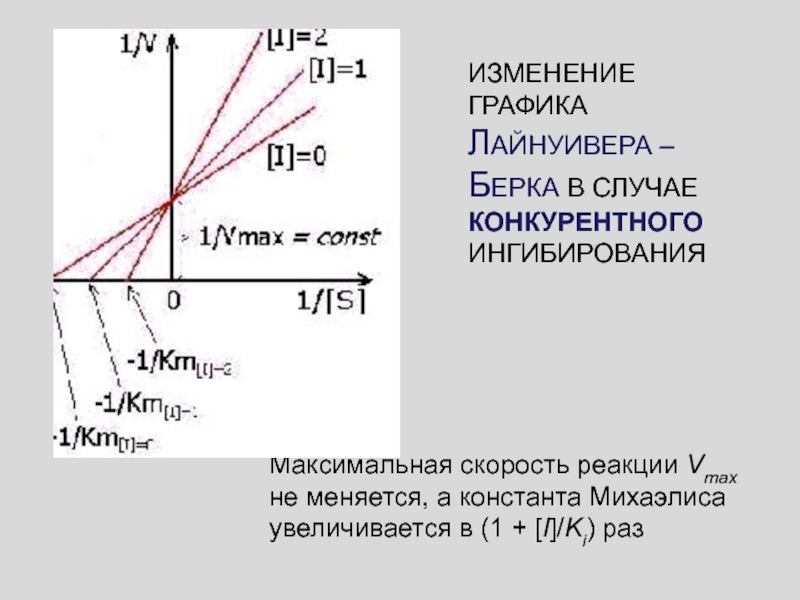
Слайд 48ИЗМЕНЕНИЕ ГРАФИКА ЛАЙНУИВЕРА – БЕРКА В СЛУЧАЕ КОНКУРЕНТНОГО ИНГИБИРОВАНИЯ
Максимальная скорость
реакции Vmax не меняется, а константа Михаэлиса увеличивается в (1
+ [I]/Ki) раз
Слайд 49НЕКОНКУРЕНТНОЕ ИНГИБИРОВАНИЕ
ИНГИБИТОР связывается с ФЕРМЕНТОМ ВНЕ АКТИВНОГО ЦЕНТРА, но при
этом меняется структура активного центра и связь с субстратом становится
невозможной
ОБРАЗУЕТСЯ НЕАКТИВНЫЙ КОМПЛЕКС ESI
УРАВНЕНИЕ ЛАЙНУИВЕРА – БЕРКА ДЛЯ НЕКОНКУРЕНТНОГО ИНГИБИРОВАНИЯ
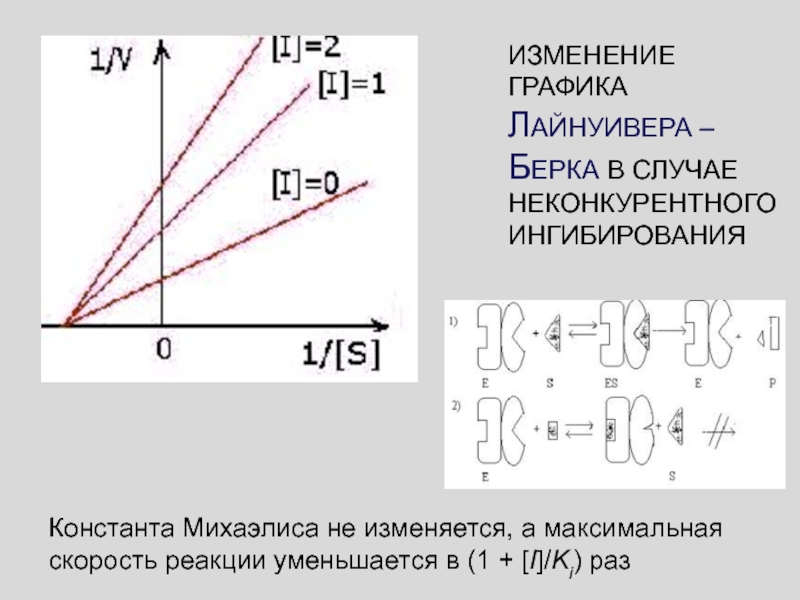
Слайд 50ИЗМЕНЕНИЕ ГРАФИКА ЛАЙНУИВЕРА – БЕРКА В СЛУЧАЕ НЕКОНКУРЕНТНОГО ИНГИБИРОВАНИЯ
Константа Михаэлиса
не изменяется, а максимальная скорость реакции уменьшается в (1 +
[I]/Ki) раз
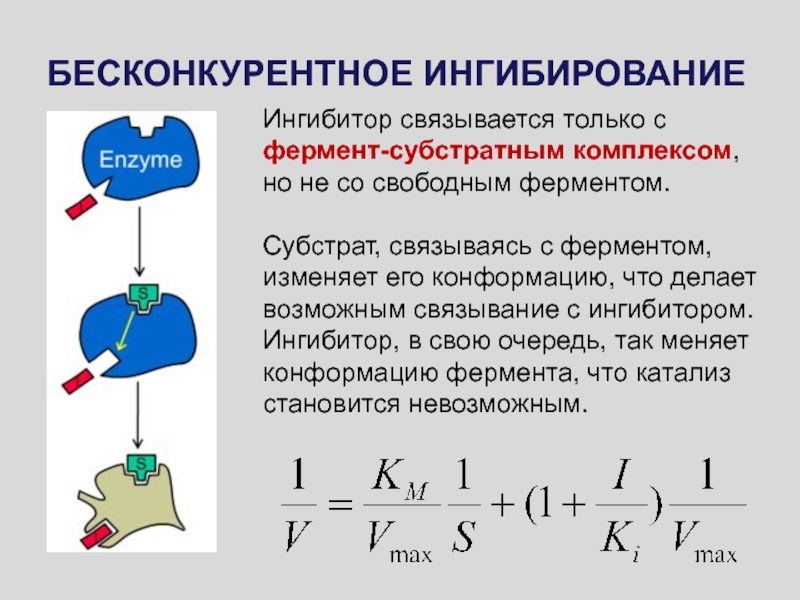
Слайд 51БЕСКОНКУРЕНТНОЕ ИНГИБИРОВАНИЕ
Ингибитор связывается только с фермент-субстратным комплексом, но не со
свободным ферментом.
Субстрат, связываясь с ферментом, изменяет его конформацию, что
делает возможным связывание с ингибитором. Ингибитор, в свою очередь, так меняет конформацию фермента, что катализ становится невозможным.
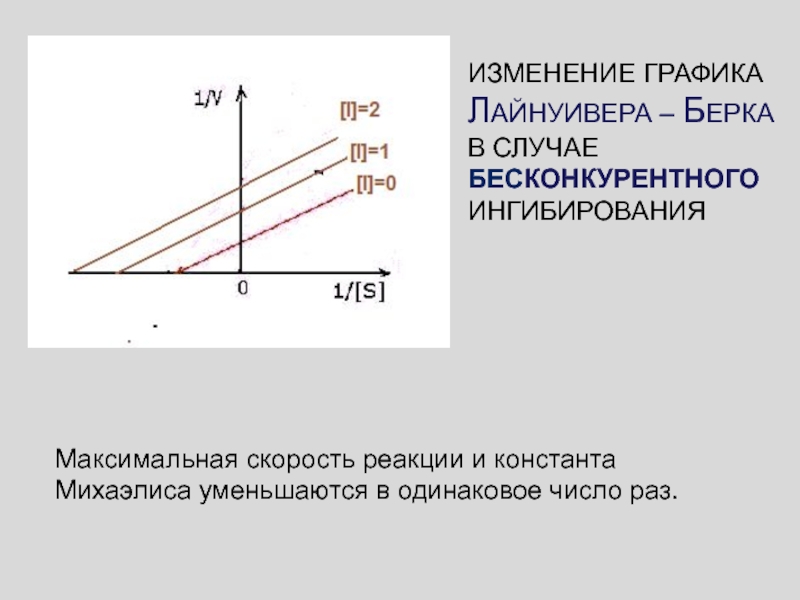
Слайд 52
Максимальная скорость реакции и константа Михаэлиса уменьшаются в одинаковое число
раз.
ИЗМЕНЕНИЕ ГРАФИКА ЛАЙНУИВЕРА – БЕРКА В СЛУЧАЕ БЕСКОНКУРЕНТНОГО ИНГИБИРОВАНИЯ
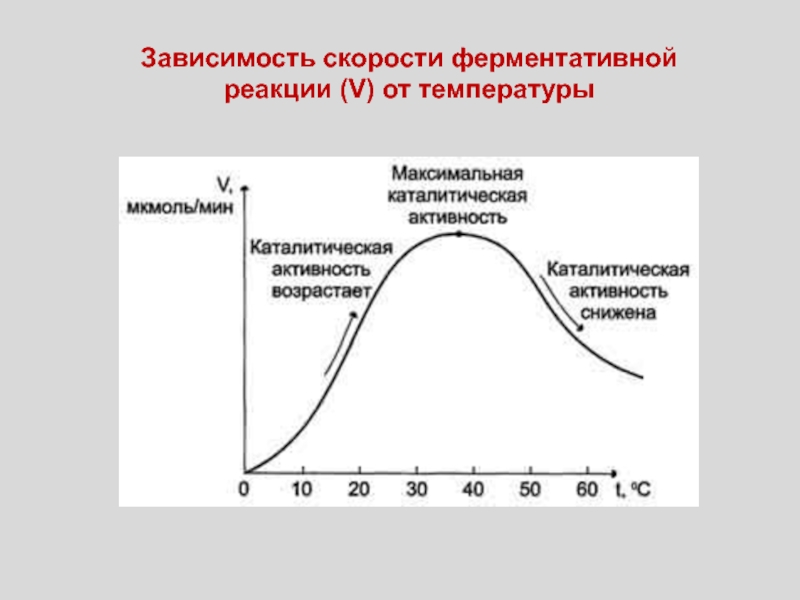
Слайд 53Зависимость скорости ферментативной реакции (V) от температуры
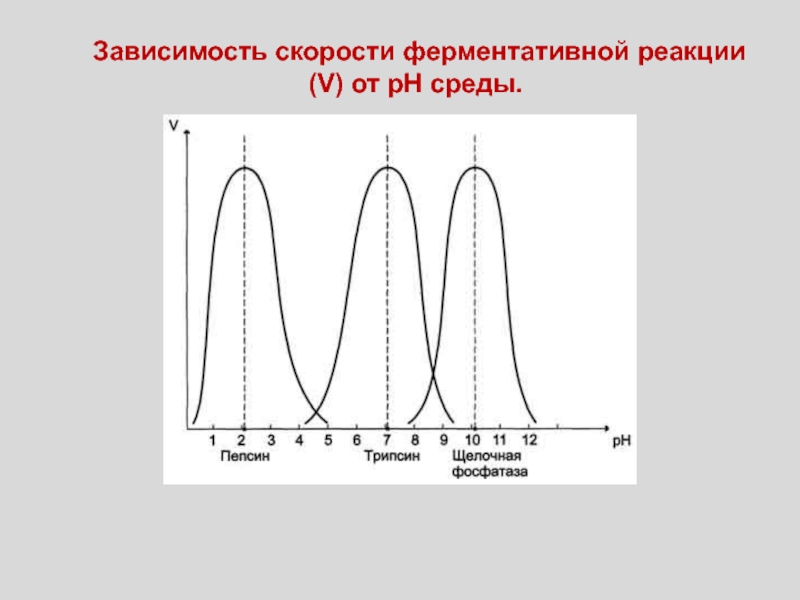
Слайд 54Зависимость скорости ферментативной реакции (V) от рН среды.
Слайд 55Оптимальные значения рН для некоторых ферментов














![ИНЕЙНЫЕ ПРЕОБРАЗОВАНИЯ УРАВНЕНИЯ МИХАЭЛИСА – МЕНТЕН lg[Y/1-Y]lg[X]График Хилла для насыщенного кислородом гемоглобина lg[Y/1-Y]lg[X]График Хилла для насыщенного кислородом гемоглобина](/img/thumbs/ffc05ab7302d7799c5daad09943bd079-800x.jpg)








![ИНЕЙНЫЕ ПРЕОБРАЗОВАНИЯ УРАВНЕНИЯ МИХАЭЛИСА – МЕНТЕН Зависимость степени насыщения Y активных центров фермента от концентрации субстрата [S] Зависимость степени насыщения Y активных центров фермента от концентрации субстрата [S] в соответствии с моделью согласованного механизма](/img/thumbs/d0f0707ce1f517b7ee45042ebbc52e0a-800x.jpg)