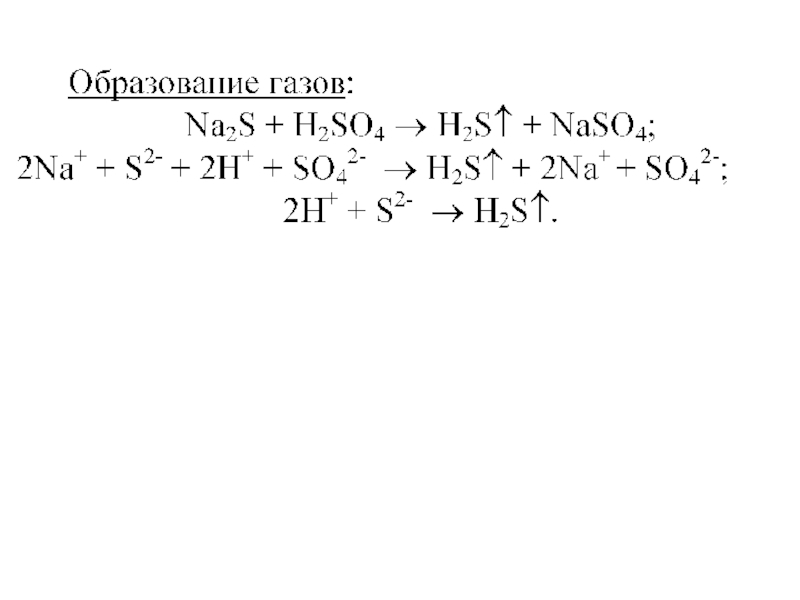Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Ионные равновесия в растворах Лекция 15 по курсу Общая и неорганическая химия
Содержание
- 1. Ионные равновесия в растворах Лекция 15 по курсу Общая и неорганическая химия
- 2. Диссоциация водыH2O ⇄ H+ + OH–НО!Ионное произведение водыПостоянно для всех разбавленных растворов!
- 3. Слайд 3
- 4. Водородный показатель (pH)pH = –lg[H+]ЛакмусЛакмусМетил-оранжМетил-оранжФенол-фталеинФенол-фталеинH2O ⇄ H+
- 5. Значения рН некоторых растворов
- 6. Степень гидратации различных ионов и молекул неодинакова
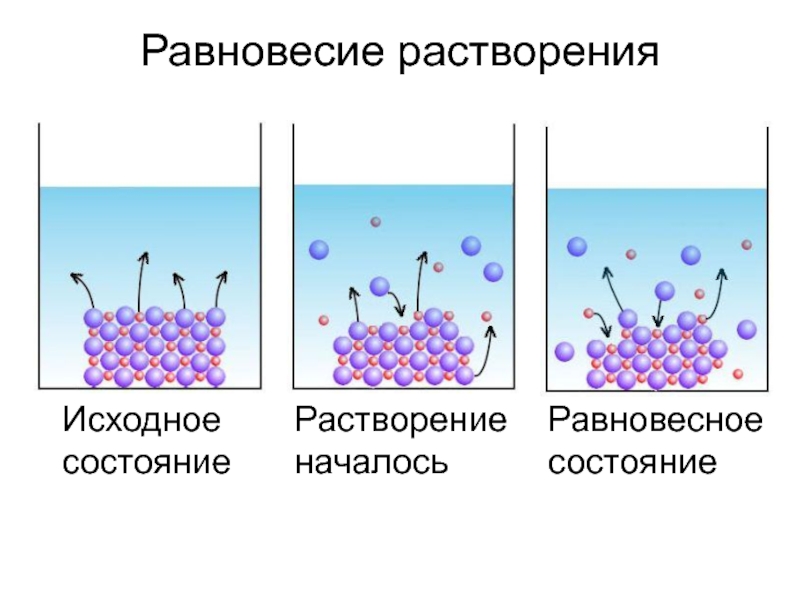
- 7. Равновесие растворенияИсходное состояниеРастворение началосьРавновесное состояние
- 8. Константа (произведение) растворимостиKtxAny(к) ⇄ xKty+(р) + yAnx–(р)Применима
- 9. Расчет растворимости по Ksa) В чистой водеAgCl(к)
- 10. Расчет растворимости по Ks (продолжение)Растворимость (S) –
- 11. Расчет растворимости солей с многозарядными ионамиCa3(PO4)2 ⇄
- 12. Способы смещения равновесия растворимостиПовышение температуры – S↑
- 13. Влияние одноименных ионовKtxAny(к) ⇄ xKty+(р) + yAnx–(р)Повышение концентрации Kty+ Автоматически снижается концентрация Anx–!(произведение должно остаться постоянным)
- 14. Расчет растворимости по Ksб) В растворе с одноименным ионом:Рассчитаем SAgCl в 0,01М растворе NaClмоль/дм3Поскольку x
- 15. Что такое «конкурирующее равновесие»?CuS(к) ⇄ S2–(р) +
- 16. Слайд 16
- 17. Слайд 17
- 18. Слайд 18
- 19. Слайд 19
- 20. Скачать презентанцию
Слайды и текст этой презентации
Слайд 2Диссоциация воды
H2O ⇄ H+ + OH–
НО!
Ионное произведение воды
Постоянно для всех
разбавленных растворов!
Слайд 4Водородный показатель (pH)
pH = –lg[H+]
Лакмус
Лакмус
Метил-оранж
Метил-оранж
Фенол-фталеин
Фенол-фталеин
H2O ⇄ H+ + OH–
Нейтральная среда
Кислая
среда
Щелочная среда
[H+] > [OH–]
[H+] < [OH–]
[H+] = [OH–]
Kw = [H+][OH–]
= 10–14Слайд 6Степень гидратации различных ионов и молекул неодинакова и зависит от
размеров частиц и величины их заряда. Чем больше заряд и
меньше размеры иона, то есть выше удельная плотность заряда, тем больше степень гидратации.Недиссоциированные молекулы также в той или иной степени гидратированы, их гидратная оболочка возникает только вокруг полярных групп и потому может быть не сплошной.
Гидратация ионов в растворе влияет на их подвижность, причем зависимость обратно пропорциональная.
Слайд 8Константа (произведение) растворимости
KtxAny(к) ⇄ xKty+(р) + yAnx–(р)
Применима только к малорастворимым
и нерастворимым электролитам!
В старых книгах обозначают как ПР
Слайд 9Расчет растворимости по Ks
a) В чистой воде
AgCl(к) ⇄ Ag+(р) +
Cl–(р)
(размерность моль2/дм2 подразумевается, но не пишется)
По уравнению реакции:
(т.к. никаких других
источников ионов в растворе нет)моль/дм3
Нашли концентрацию. А растворимость?
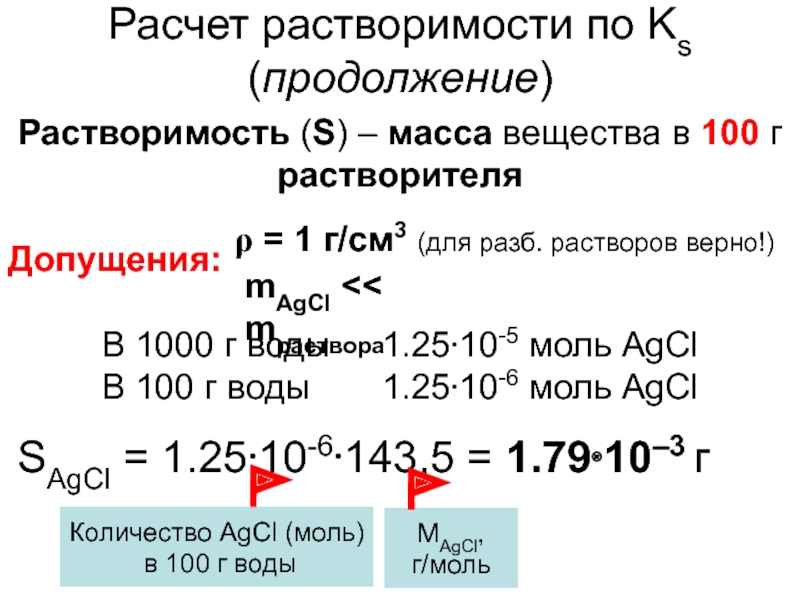
Слайд 10Расчет растворимости по Ks (продолжение)
Растворимость (S) – масса вещества в
100 г растворителя
Допущения:
= 1 г/см3 (для разб. растворов верно!)
В
1000 г воды 1.2510-5 моль AgClВ 100 г воды 1.2510-6 моль AgCl
SAgCl = 1.2510-6143,5 = 1.7910–3 г
Количество AgCl (моль)
в 100 г воды
МAgCl,
г/моль
mAgCl << mраствора
Слайд 11Расчет растворимости солей с многозарядными ионами
Ca3(PO4)2 ⇄ 3Ca2+ + 2PO43–
= 1.13∙10-7∙310 = 3.53∙10–5 г/дм3
или 3.53∙10–6 г на 100 г растворителя Слайд 12Способы смещения равновесия растворимости
Повышение температуры – S↑
Добавление одноименного иона
– S↓
Добавление реагента, участвующего в конкурирующем равновесии с катионом или
анионом – S↑Добавление электролита, не имеющего общих ионов – обычно S немного ↑ (солевой эффект).
Причина: количество ионов ↑ взаимодействие между ними ↑ активность ионов↓
Слайд 13Влияние одноименных ионов
KtxAny(к) ⇄ xKty+(р) + yAnx–(р)
Повышение концентрации Kty+
Автоматически
снижается концентрация Anx–!
(произведение должно остаться постоянным)
Слайд 14Расчет растворимости по Ks
б) В растворе с одноименным ионом:
Рассчитаем SAgCl
в 0,01М растворе NaCl
моль/дм3
Поскольку x
+ Cl–(р)А в чистой воде?
моль/дм3
Растворимость уменьшилась в 800 раз!
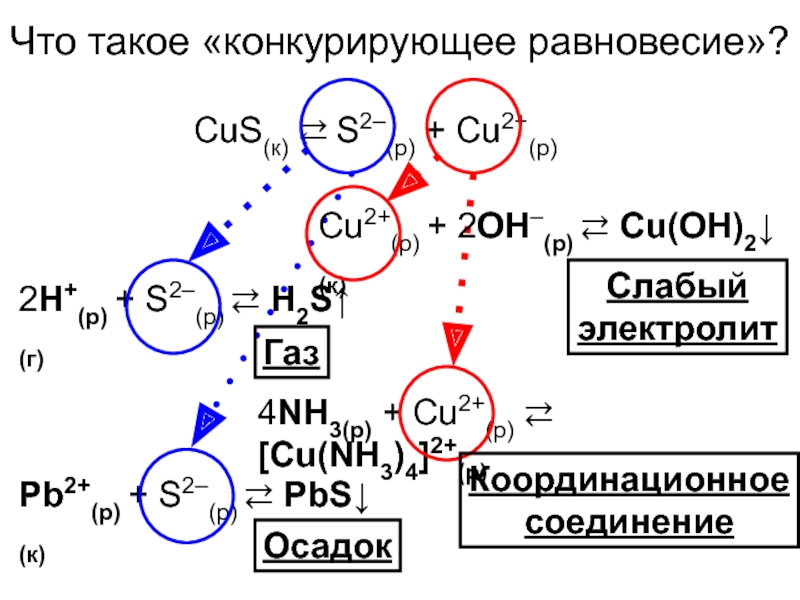
Слайд 15Что такое «конкурирующее равновесие»?
CuS(к) ⇄ S2–(р) + Cu2+(р)
2H+(р) + S2–(р)
⇄ H2S↑(г)
Pb2+(р) + S2–(р) ⇄ PbS↓(к)
Осадок
4NH3(р) + Cu2+(р) ⇄ [Cu(NH3)4]2+(р)
Координационное
соединение
Cu2+(р) + 2OH–(р) ⇄ Cu(OH)2↓(к)
Слабый
электролит
Газ



![Ионные равновесия в растворах
Лекция 15 по курсу Общая и неорганическая химия Водородный показатель (pH)pH = –lg[H+]ЛакмусЛакмусМетил-оранжМетил-оранжФенол-фталеинФенол-фталеинH2O ⇄ H+ + OH–Нейтральная средаКислая средаЩелочная Водородный показатель (pH)pH = –lg[H+]ЛакмусЛакмусМетил-оранжМетил-оранжФенол-фталеинФенол-фталеинH2O ⇄ H+ + OH–Нейтральная средаКислая средаЩелочная среда[H+] > [OH–][H+] < [OH–][H+] =](/img/tmb/3/284694/0f41a2b77bcfb5fb1ef648916704bf86-800x.jpg)