Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
ИОННЫЕ РЕАКЦИИ
Содержание
- 1. ИОННЫЕ РЕАКЦИИ
- 2. Что мы должны знать1. Электролиты и неэлектролиты.
- 3. Вопросы для контроля1. Чем обусловлена электропроводность растворов
- 4. Вопросы для контроляДать определение кислот, оснований, солей.
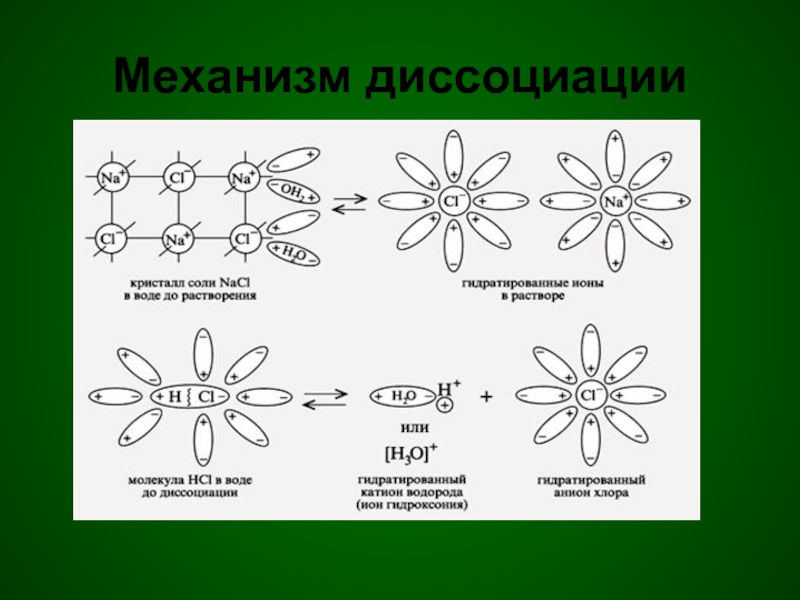
- 5. Механизм диссоциации
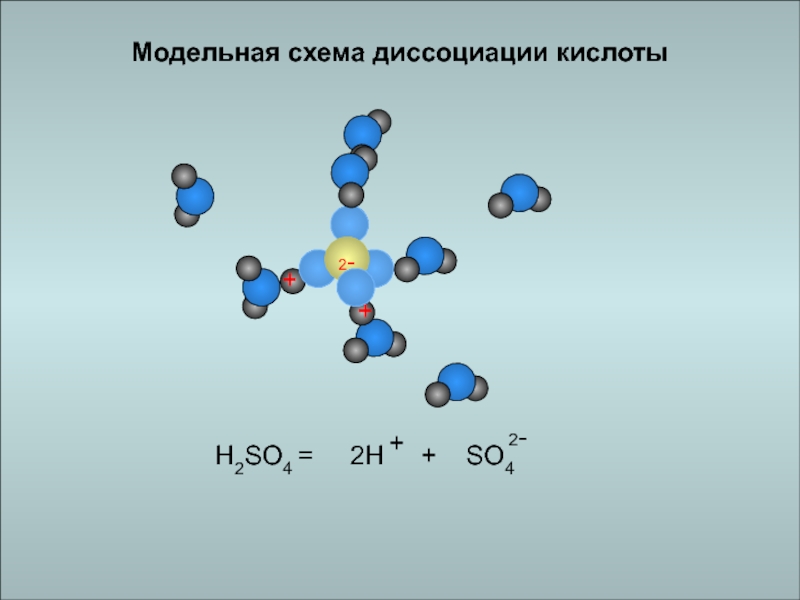
- 6. Диссоциация кислотКислоты - это электролиты, которые диссоциируют
- 7. Слайд 7
- 8. Проверим на практике1. Общие свойства. Добавить метилоранж
- 9. Проверим на практике2. Различие в свойствах. Добавим
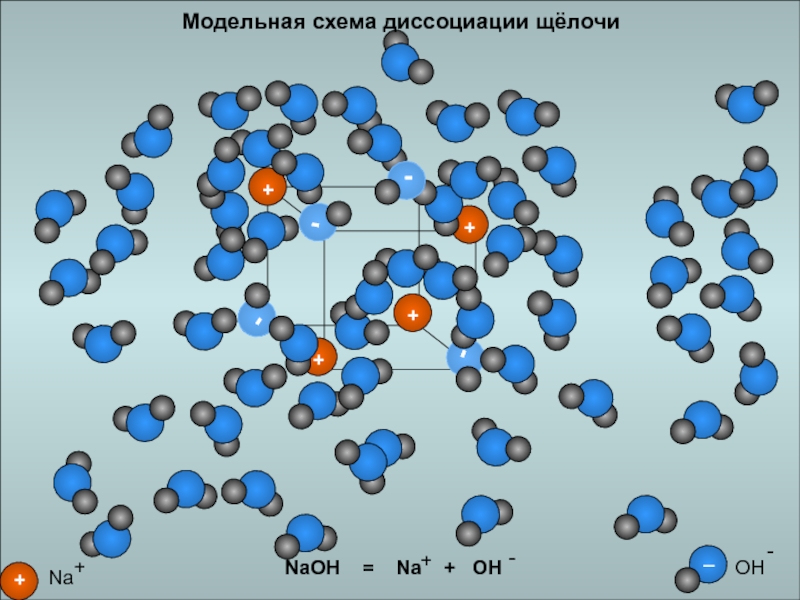
- 10. Модельная схема диссоциации щёлочи
- 11. Диссоциация основанийОснования – это электролиты, которые диссоциируют
- 12. Понятие об индикаторахИНДИКАТОРЫ – это вещества, которые…
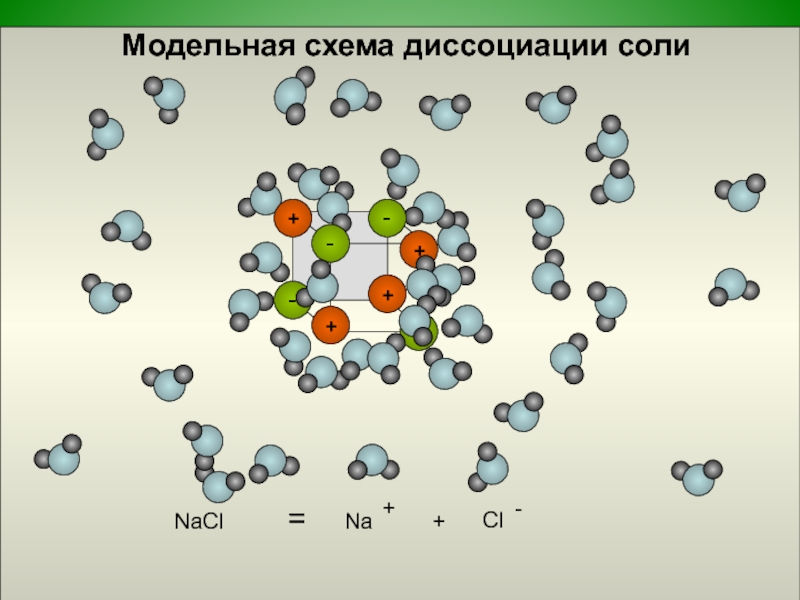
- 13. Диссоциация солейСоли - это электролиты, которые диссоциируют на катион металла и анион кислотного остатка.
- 14. Модельная схема диссоциации солиNaCl = + Na+
- 15. KNO3 ↔ К+ + NO3-Модельная схема диссоциации соли
- 16. СамоконтрольСреди веществ, формулы которых приведены: BaCl2,H2SO4, Ca(OH)2,
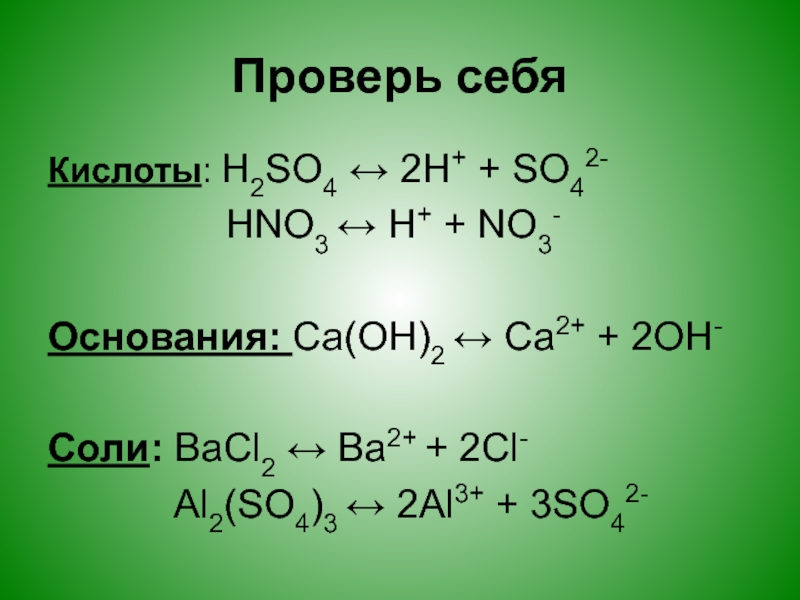
- 17. Проверь себяКислоты: H2SO4 ↔ 2H+ + SO42-
- 18. Химические свойства растворов электролитов определяются свойствами тех ионов, которые они образуют при диссоциации.
- 19. СамоконтрольВ растворе находятся следующие ионы:РО43-, К+, СО32-,
- 20. Ионные реакции – этореакции между ионами в водных растворах электролитов
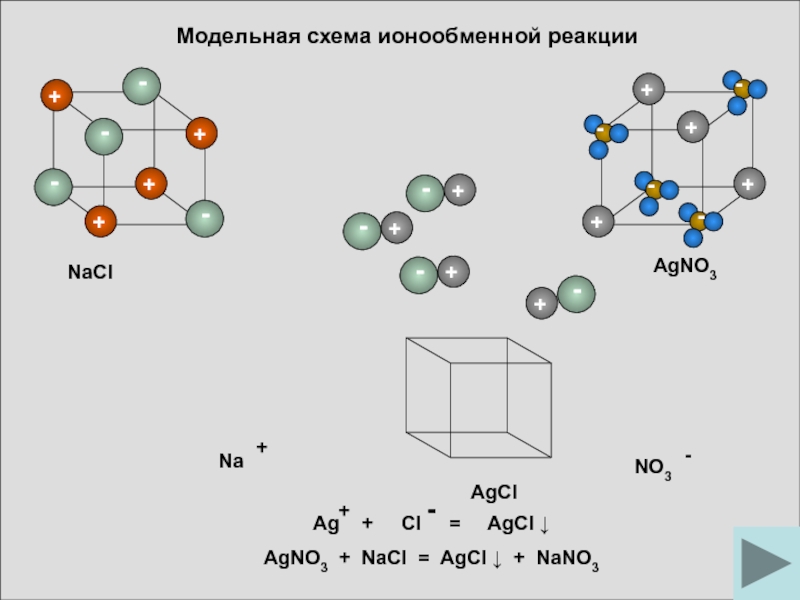
- 21. Модельная схема ионообменной реакцииAgClNaClAgNO3
- 22. Правила составления ионных уравнений 1.Простые
- 23. Проверь себяСоставить уравнение между гидроксидом натрия и хлоридом железа(III) в молекулярном и ионном виде
- 24. Алгоритм составления ионных уравненийЗаписать молекулярное уравнение реакции
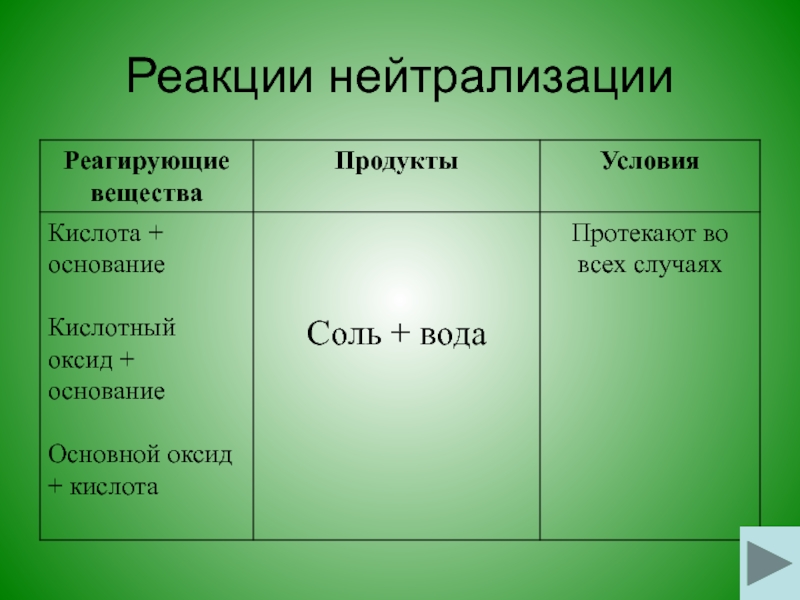
- 25. Реакции нейтрализации
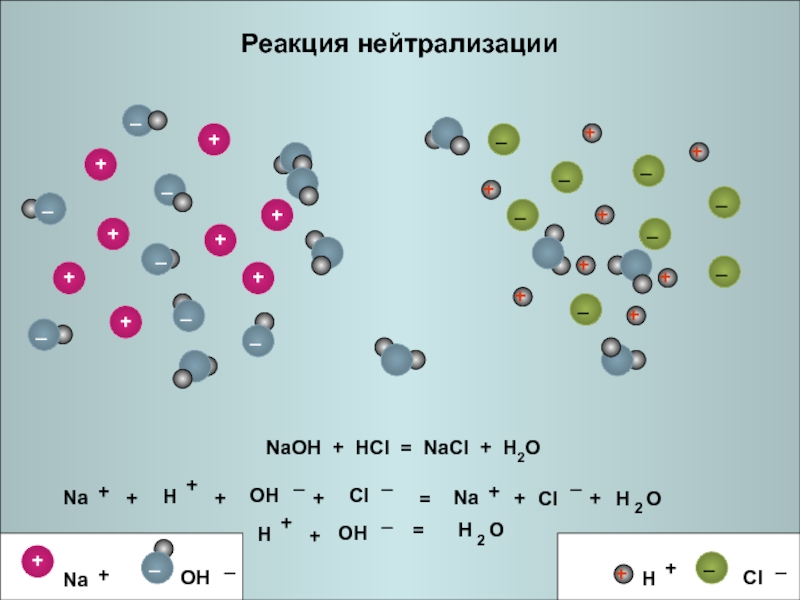
- 26. Реакция нейтрализацииNaOH + HCl = NaCl + H2O++=++++=
- 27. + + + + + + +
- 28. Попробуй самНалить в пробирку раствор NаОН, добавить
- 29. Проверь себяNaOH + HCl = NaCl +
- 30. Свойства кислот, солей, оснований как электролитов
- 31. Попробуй самВыберите из предложенных реактивов те, с
- 32. Проверь себяСоль + ЩелочьCuSO4 + 2Na OH
- 33. Попробуй сам1. Подобрать молекулярные уравнения к каждому
- 34. Основные понятияКислотыКислоты, основанияКислоты, основания, соли как электролиты.Индикаторы.Ионнообменные
- 35. Скачать презентанцию
Что мы должны знать1. Электролиты и неэлектролиты. Особенности свойств растворов электролитов.2. Определение электролитической диссоциации.3. Основные положения.4. Механизм растворения веществ с ионной связьюс молекулярной связью.5. Диссоциация кислот, оснований, солей.6. Общие понятия о
Слайды и текст этой презентации
Слайд 1Электролитическая диссоциация
ИОННЫЕ РЕАКЦИИ
Автор: учитель химии МБОУ СОШ №2,
г. Серпухов
Белоусова Марина
Александровна
Слайд 2Что мы должны знать
1. Электролиты и неэлектролиты. Особенности свойств растворов
электролитов.
2. Определение электролитической диссоциации.
3. Основные положения.
4. Механизм растворения веществ
с
ионной связьюс молекулярной связью.
5. Диссоциация кислот, оснований, солей.
6. Общие понятия о кислотах и основаниях как электролитах.
7. Ионнообменные реакции.
Слайд 3Вопросы для контроля
1. Чем обусловлена электропроводность растворов электролитов?
2. Что
называется процессом ``электролитической диссоциации''?
3. Какую роль при электролитической диссоциации
играет растворитель? 4. Каковы основные положения теории электролитической диссоциации?
5. Что значит сильный или слабый электролит?
6. Что такое : а) катионы? , б) анионы?
7. Как называются ионы, движущиеся при электролизе: а) к катоду, б) к аноду?
8. Как заряжен катод и анод?
Слайд 4Вопросы для контроля
Дать определение кислот, оснований, солей. Привести примеры.
Привести несколько
примеров оксида, соответствующей кислоты и любой соли образованной этой кислотой.
Дать названияСлайд 6Диссоциация кислот
Кислоты - это электролиты, которые диссоциируют на водород и
кислотный остаток.
Кислотные остатки для различных кислот различны, но общим для
всех кислот является наличие в растворах иона водорода. Наличие в растворах кислот иона водорода, точнее, гидратированного иона, обусловливает общие свойства кислот (кислый вкус, действие на индикаторы, взаимодействие с металлами с выделением водорода и др.).
Слайд 8Проверим на практике
1. Общие свойства.
Добавить метилоранж и индикаторную бумагу
к растворам серной и соляной кислот. Что наблюдаем? С каким
ионом взаимодействует метилоранж: катионом или анионом?Добавить несколько кусочков цинка к раствору серной и соляной кислоты. Что наблюдаем? Цинк замещает…(указать ион). Написать уравнения реакций.
Соли – это продукт реакции…. (указать тип реакции, и ион, который замещается и ион, который замещает).
Слайд 9Проверим на практике
2. Различие в свойствах. Добавим хлорид бария к
растворам серной и соляной кислот. Что наблюдаем? С чем реагирует
хлорид бария: с катионом или анионом? С каким?Закончите предложение. Общие свойства кислот обусловлены …, различные свойства …
Слайд 11Диссоциация оснований
Основания – это электролиты, которые диссоциируют на катион металла
и гидроксид-анион.
Лабораторный опыт: добавьте к растворам NаОН и Са(ОН)2
фенолфталеин и индикаторную бумагу. Что наблюдаем?Общие свойства оснований обусловлены….., различие в свойствах - …. (указать ионы)
Слайд 12Понятие об индикаторах
ИНДИКАТОРЫ – это вещества, которые… (указать один из
признаков химической реакции) при взаимодействии с …….(указать названия ионов, с
которыми взаимодействуют индикаторы).
Слайд 13Диссоциация солей
Соли - это электролиты, которые диссоциируют на катион металла
и анион кислотного остатка.
Слайд 16Самоконтроль
Среди веществ, формулы которых приведены:
BaCl2,H2SO4, Ca(OH)2, HNO3, Al2(SO4)3,
выбрать
кислоты, соли, основания, дать им названия, написать уравнения диссоциации.
Слайд 17Проверь себя
Кислоты: H2SO4 ↔ 2H+ + SO42-
HNO3 ↔
H+ + NO3-Основания: Са(ОН)2 ↔ Са2+ + 2ОН-
Соли: BaCl2 ↔ Ba2+ + 2Cl-
Al2(SO4)3 ↔ 2Al3+ + 3SO42-
Слайд 18
Химические свойства растворов электролитов определяются свойствами тех ионов, которые они
образуют при диссоциации.
Слайд 19Самоконтроль
В растворе находятся следующие ионы:
РО43-, К+, СО32-, Н+, ОН-.
Какие вещества
были растворены. Дать им названия.
Ответ: К3РО4, К2СО3, Н3РО4, Н2СО3, КОН
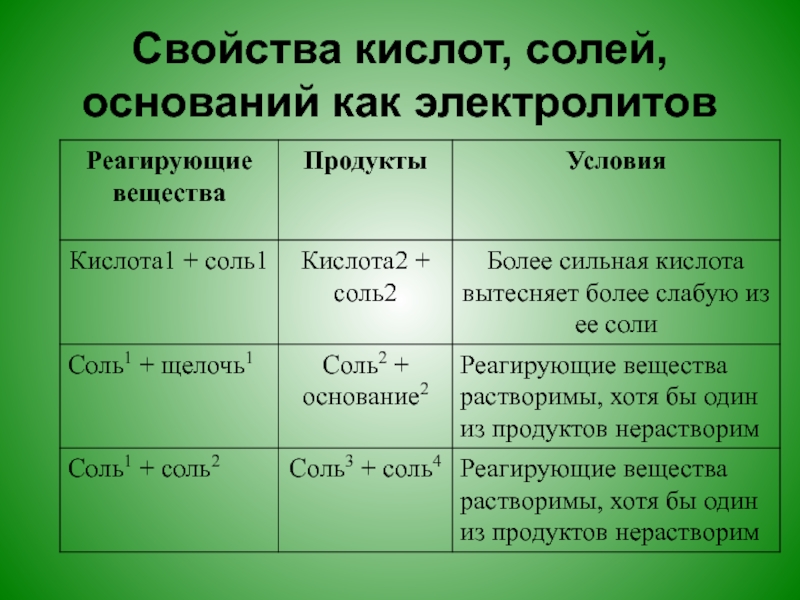
Слайд 22Правила составления ионных уравнений
1.Простые вещества, оксиды, а
также нерастворимые кислоты, основания и соли не диссоциируют.
2.Для реакции берут растворы веществ, поэтому даже малорастворимые вещества находятся в растворах в виде ионов.3.Если малорастворимое вещество образуется в результате реакции, то при записи ионного уравнения его считают нерастворимым.
4.Сумма электрических зарядов ионов в левой части уравнения должна быть равна сумме электрических зарядов ионов в правой части.
Записывая молекулярное уравнение ионного обмена, помним: обмениваются ионы одинакового заряда
Слайд 23Проверь себя
Составить уравнение между гидроксидом натрия и хлоридом железа(III) в
молекулярном и ионном виде
Слайд 24Алгоритм составления ионных уравнений
Записать молекулярное уравнение реакции
3NaOH + FeCl3 = Fe(OH)3 +
3NaClС помощью таблицы растворимости определить растворимость каждого вещества.
р р н р
3NaOH + FeCl3 = Fe(OH)3 + 3NaCl
3. Составляем полное ионное уравнение. Сильные электролиты записывают в виде ионов, а слабые электролиты, малорастворимые вещества и газообразные вещества записывают в виде молекул.
3Na+ + 3OH- + Fe3+ + 3Cl- = Fe(OH)3 + 3Na+ + 3Cl-
4. Найти одинаковые ионы (они не приняли участия в реакции в левой и правой частях уравнения реакции) и сократить их слева и справа.
3Na+ + 3OH- + Fe3+ + 3Cl- = Fe(OH)3 ↓ + 3Na+ + 3Cl-
Составить сокращенное ионное уравнение (выпишите знаки, формулы ионов или веществ, которые приняли участие в реакции).
Fe3+ + 3OH- = Fe(OH)3 ↓
Слайд 27
+
+
+
+
+
+
+
+
+
+
+
+
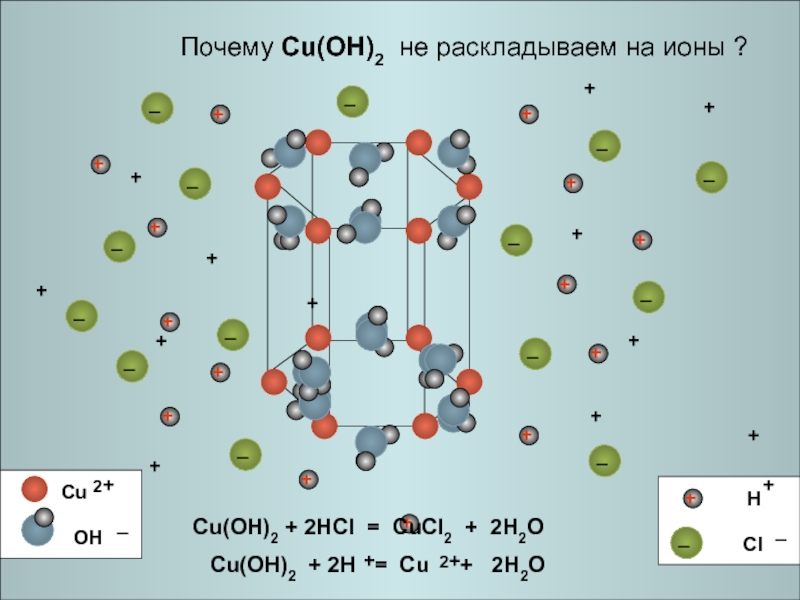
Cu(OH)2 + 2HCl = CuCl2 + 2H2O
Почему
Cu(OH)2 не раскладываем на ионы ?Слайд 28Попробуй сам
Налить в пробирку раствор NаОН, добавить фенолфталеин, затем раствор
соляной кислоты. Записать уравнение реакции в молекулярном и ионном виде.
В
пробирку с оксидом меди добавить раствор серной кислоты, подогреть. Записать уравнение реакции в молекулярном и ионном виде.Взять 2 пробирки. В первую налить раствор Са(ОН)2,, во вторую добавить мрамор и соляную кислоту, заткнуть вторую пробирку пробкой с газоотводной трубкой. Конец газоотводной трубки опустить в раствор Са(ОН)2. Что наблюдаем? Какой газ выделяется? Записать уравнение реакции между СО2 и Са(ОН)2 в молекулярном и ионном виде.
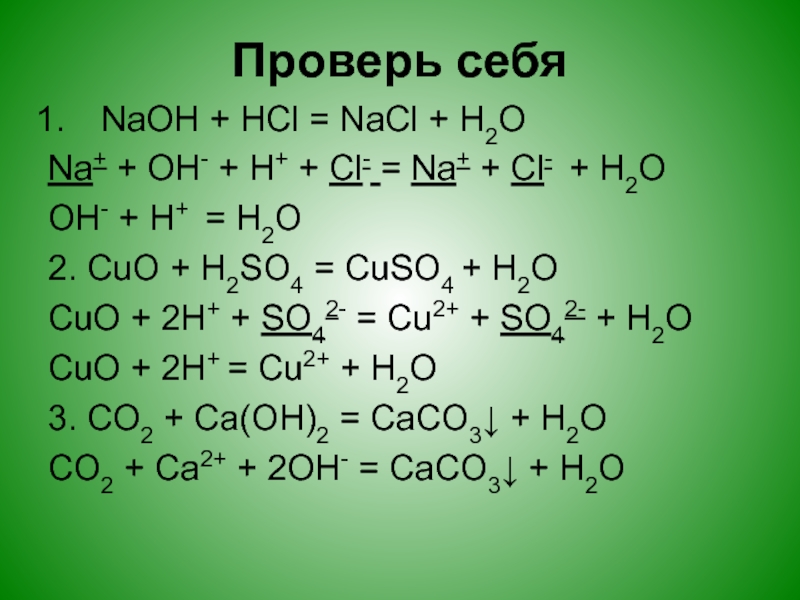
Слайд 29Проверь себя
NaOH + HCl = NaCl + H2O
Na+ + OH-
+ H+ + Cl- = Na+ + Cl- + H2O
OH-
+ H+ = H2O2. CuO + H2SO4 = CuSO4 + H2O
CuO + 2H+ + SO42- = Cu2+ + SO42- + H2O
CuO + 2H+ = Cu2+ + H2O
3. CO2 + Ca(OH)2 = CaCO3↓ + H2O
CO2 + Ca2+ + 2OH- = CaCO3↓ + H2O
Слайд 31Попробуй сам
Выберите из предложенных реактивов те, с которыми можно провести
реакции между солью и щелочью, солью и солью. Проведите реакции.
Запишите уравнения реакций в молекулярном и ионном виде.Слайд 32Проверь себя
Соль + Щелочь
CuSO4 + 2Na OH = Cu(OH)2↓ +
Na2SO4
Cu2+ + SO42- + 2Na+ + 2OH- = SO42- +
2Na+ + Cu(OH)2 ↓Cu2+ + 2OH- = Cu(OH)2 ↓
Соль + соль
Al2(SO4)3 + 3BaCl2 = 2AlCl3 + 3BaSO4 ↓
2Al3+ + 3SO42- + 3Ba2+ + 6Cl- = 2Al3+ + 6Cl- + 3BaSO4 ↓
Ba2+ + SO42- = BaSO4 ↓
Слайд 33Попробуй сам
1. Подобрать молекулярные уравнения к каждому краткому ионному:
а) СО32- + Са2+ = СаСО3 б) 3Mg2+
+ 2PO43- = Mg3(PO4)22. При помощи молекулярных и ионных уравнений ответьте на вопросы:
а) растворы каких солей, присутствующих у вас на столе, надо смешать для получения в осадке йодида свинца?
б) каким способом из NaCl можно получить нитрат натрия?