физике (2008, Физматлит).
Волновая механика Шредингера вскоре была дополнена рядом новых
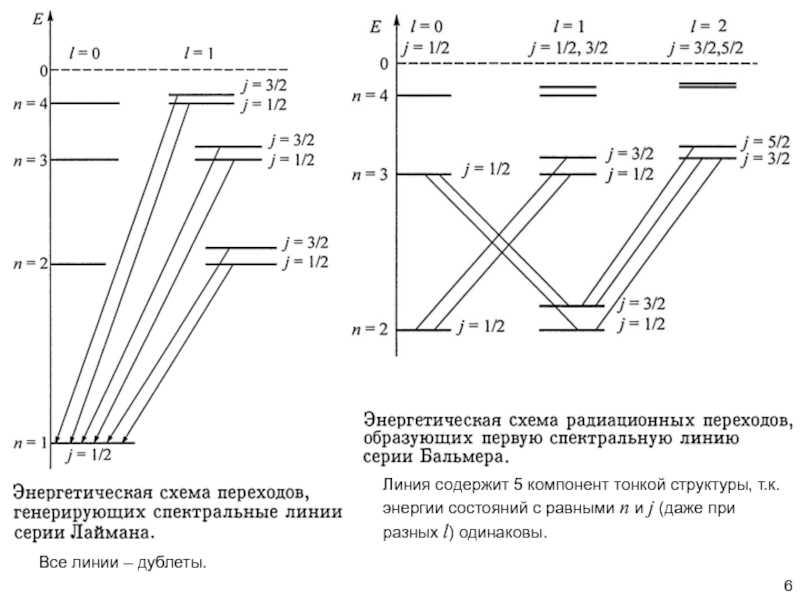
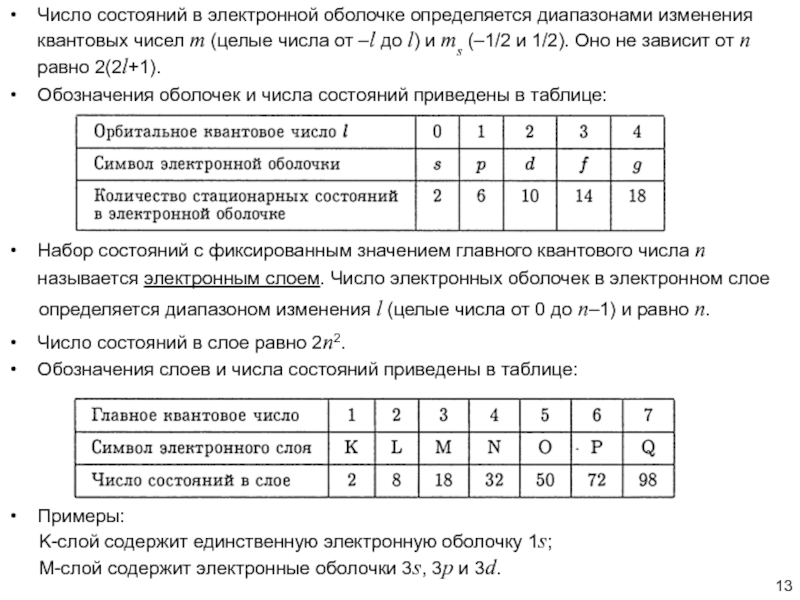
положений, что позволило корректно описать магнитные свойства атомов, «тонкую структуру» атомных спектров, а также свойства многоэлектронных атомов – все то, что не могло быть описано «старой квантовой теорией».Одно из таких дополнений состояло во введении понятия «спина» -- собственного, «внутреннего» момента количества движения микрообъектов.
Еще в 1925 г. была выдвинута гипотеза о вращении электрона вокруг своей оси («spin»), что, в принципе, могло бы позволить объяснить наличие у него собственного момента импульса и магнитного момента. Это потребовалось для объяснения дублетной структуры оптических спектров щелочных металлов и результатов экспериментов по изучению магнетизма атомов – опыта Штерна-Герлаха и др.
Однако численные оценки показали несостоятельность этого предположения – для получения магнитного момента, равного магнетону Бора, требовалось предположить либо большой радиус электрона, либо сверхсветовую скорость вращательного движения.
6.9. Спин. Фермионы и бозоны. Принцип Паули. Многоэлектронные атомы.