Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Исследование физико-химических свойств Трихлорэтана и описание изобретения
Содержание
- 1. Исследование физико-химических свойств Трихлорэтана и описание изобретения
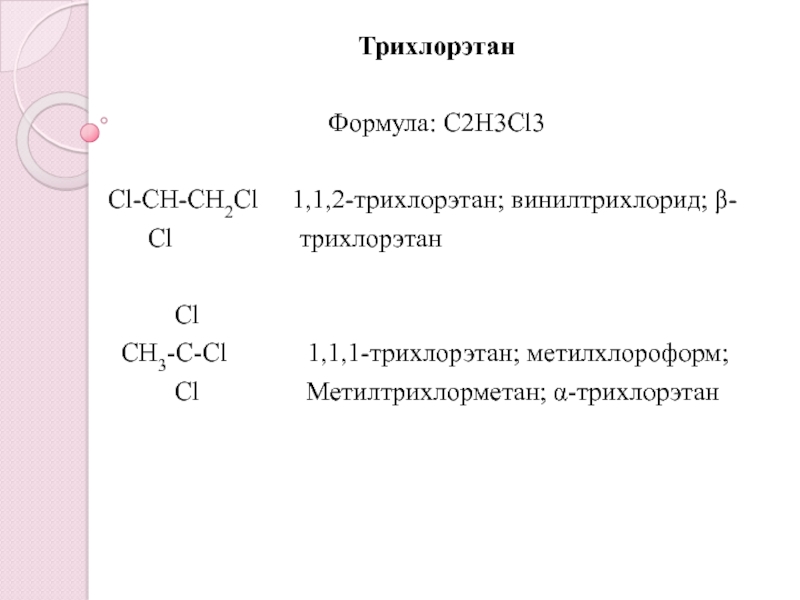
- 2. ТрихлорэтанФормула: C2Н3Cl3Cl-CH-CH2Cl 1,1,2-трихлорэтан; винилтрихлорид; β-
- 3. Свойства: бесцветная жидкость с характерным сладковатым запахом.
- 4. Способы получения: методы получения 1,1,2 – трихлорэтана1,1,2-ТХЭ получают
- 5. Физико-химические свойства реагентов.Винилхлориид (хлористый винил, хлорвинил, хлорэтилен,
- 6. методы получения 1,1,1 – трихлорэтана1,1,1-Т. получают гидрохлорированием
- 7. Аддитивное галогенирование с помощью свободных галогенов (присоединение
- 8. Реакционная способность олефинов зависит от стабильности промежуточного
- 9. Термодинамика реакции галогенирования.Реакции галогенирования сильно различаются энергетическими
- 10. Кинетика и механизм основной реакцииПри хлорировании непредельных
- 11. Вследствие этого расход инициатора на
- 12. При термическом хлорировании, Е≈125-170 кДж/моль d[I]/d[0.5]=A[I]0.52,72-125-170
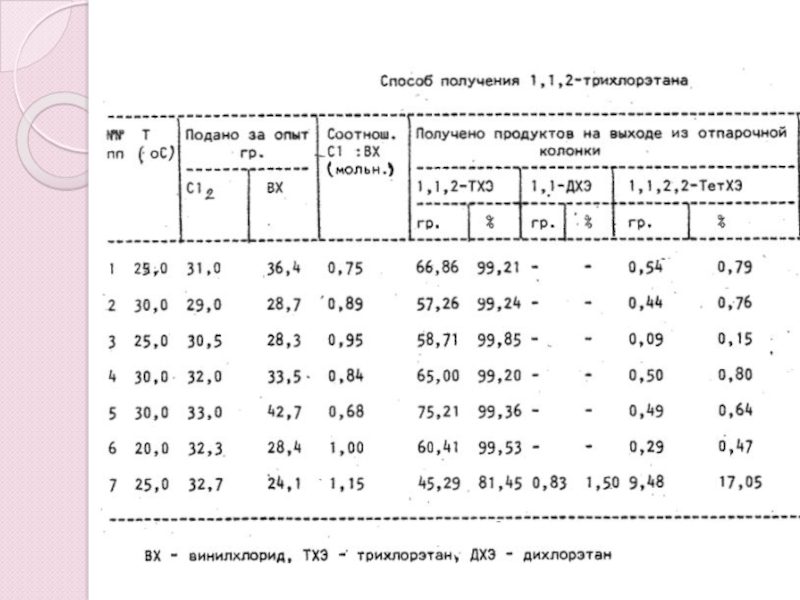
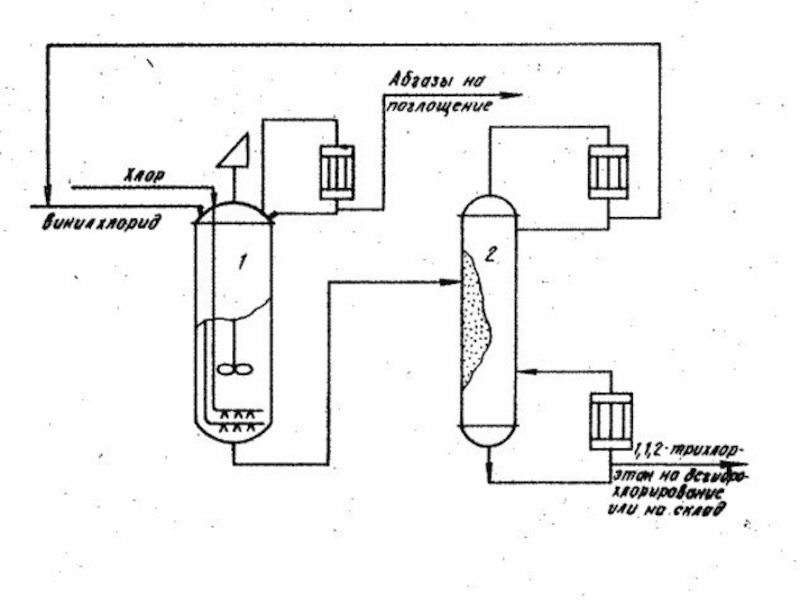
- 13. Способ получения 1,1,2-трихлоэтана
- 14. Слайд 14
- 15. Слайд 15
- 16. Формула изобретения Способ получения 1,1,2-трихлорэтана путем
- 17. Заключение В данной работе сообщается результаты
- 18. Скачать презентанцию
ТрихлорэтанФормула: C2Н3Cl3Cl-CH-CH2Cl 1,1,2-трихлорэтан; винилтрихлорид; β- Cl
Слайды и текст этой презентации
Слайд 1Исследование физико-химических свойств «Трихлорэтана» и описание изобретения по авторским свидетельствам
Работу
выполнили
студенты гр. ХТ-244
Ким Татьяна
Наход Мария
Шайхимова Лаура
Слайд 2Трихлорэтан
Формула: C2Н3Cl3
Cl-CH-CH2Cl 1,1,2-трихлорэтан; винилтрихлорид; β-
Сl
СH3-C-Cl 1,1,1-трихлорэтан; метилхлороформ;
Cl Метилтрихлорметан; α-трихлорэтан
Слайд 3Свойства:
бесцветная жидкость с характерным сладковатым запахом. Хорошо растворим во
многих органических растворителях. Не растворим в воде. 1,1,1-Трихлорэтан легко окисляется
даже при комнатной температуре, реакция ускоряется в присутствии следов воды и некотрых металлов (Al, Fe и др.) . При этом образуются фосген, HCl, CO2, H2O.Слайд 4Способы получения:
методы получения 1,1,2 – трихлорэтана
1,1,2-ТХЭ получают хлорированием винилхлорида в
жидкой фазе в присутствии 0,01-0,1% FeCl3 при 20-30 0C либо
хлорированием 1,2-дихлорэтана в присутствии порофора при 80-90 0C; в последнем случае степень превращения дихлорэтана не должна превышать 40-60%.СН2 = СНCl + Cl2 > СН2Cl -СНCl 2
В процессе получения трихлорэтана происходит образование побочных продуктов:
1,1 – дихлорэтана
1,1,1,2 - тетрахлорэтана
1,1,2,2 – тетрахлорэтана
цис- и транс - дихлорэтиленов
Слайд 5Физико-химические свойства реагентов.
Винилхлориид (хлористый винил, хлорвинил, хлорэтилен, хлорэтен, этиленхлорид) —
органическое вещество; бесцветный газ со слабым сладковатым запахом, имеющий формулу
C2H3Cl и представляющий собой простейшее хлорпроизводное этилена.Хлор - химически активный неметалл, входит в группу галогенов, простое вещество, при нормальных условиях — ядовитый газ желтовато-зелёного цвета тяжелее воздуха, с резким запахом. Молекула хлора двухатомная (формула Cl2).
Слайд 6методы получения 1,1,1 – трихлорэтана
1,1,1-Т. получают гидрохлорированием винилиденхлорида в жидкой
фазе в присутствии 0,1-0,5% FeCl3 при 20-30 0C (выход 98-99%), а также
хлорированием 1,1-дихлорэтана в газовой фазе при 350-400 0C или в присутствии силикагеля, песка, пемзы (без Fe) либо в жидкой фазе в присутствии порофора при 80-90 0C или УФ света при 10-30 0C.СН2=СCl2 +HCl> CH3-CCl3
Физико-химические свойства реагентов.
Винилиденхлорид СН2=СCl2, бесцветная жидкость, tкип 31,7 °С. Применяется главным образом для получения поливинилиденхлорида и сополимеров винилиденхлорида, например, с винилхлоридом, акрилонитрилом.
Хлороводород, хлористый водород (HCl) — бесцветный, термически устойчивый газ (при нормальных условиях) с резким запахом, дымящий во влажном воздухе, легко растворяется в воде (до 500 объёмов газа на один объём воды) с образованиемхлороводородной (соляной) кислоты
Слайд 7Аддитивное галогенирование с помощью свободных галогенов (присоединение галогенов по С=С
связям).
Пропуская исходные реагенты через жидкую фазу, которой обычно являются продукты
реакции, легко осуществить присоединение хлора или брома по двойной связи: RCH=CH2+X2→RCHX-CH2 X. Эта реакция протекает быстро даже при низших температурах, но её ускоряют катализаторы типа апротонных кислот (FeCl3). Слайд 8Реакционная способность олефинов зависит от стабильности промежуточного катиона и изменяется
следующим образом:
RCH=CH2 > CH2=CH2 > CH2=CHCl
Слайд 9Термодинамика реакции галогенирования.
Реакции галогенирования сильно различаются энергетическими характеристиками, что предопределяет
их существенные особенности. Реакции с Cl сопровождаются очень большим выделением
тепла, превышающим энергию разрыва связей С-С и С-Н. Если не принять особых мер, это приведёт к глубокому разложению органического вещества. Температуры кипения при атмосферном давлении: Cl2-34.60C, HCl-83.70C.Слайд 10Кинетика и механизм основной реакции
При хлорировании непредельных углеводородов реакция хлорирования
может протекать по двум направлениям. Это присоединение атома хлора по
двойной связи (присоединительное хлорирование) и замещение атома водорода на хлор с сохранением непредельной связи (заместительное хлорирование). Существуют определенные так называемые критические температуры хлорирования алкенов, при которой наблюдается переход реакции присоединения в реакцию замещения. Для этилена эта температура составляет 250-3500C и этот интервал ориентировочный.Слайд 11 Вследствие этого расход инициатора на единицу количества продукта
выражается дифференциальным уравнением:
d[I]/d[B]=A[I]0.5e-E/2RT
где I-инициатор (изобутиронитрил или
пероксид бензоил), Е-энергия активации его термического разложения, В-продукт, А-коэффициент пропорциональности.Слайд 12При термическом хлорировании, Е≈125-170 кДж/моль
d[I]/d[0.5]=A[I]0.52,72-125-170 /2*8,314*20~30
d[I]/d[0,43]=A[I]0.52,72-125-170
/2*8,314*20~30
d[I]/d[0,44]=A[I]0.52,72-125-170 /2*8,314*20~30
При химическом хлорировании, Е≈85 кДж/моль
d[I]/d[0.5]=A[I]0.52,72-85/2*8,314*20~30
d[I]/d[0,43]=A[I]0.52,72-85/2*8,314*20~30d[I]/d[0,44]=A[I]0.52,72-85/2*8,314*20~30
При фотохимической реакции, Е≈20-40 кДж/моль
d[I]/d[0.5]=A[I]0.52,72-20-40/2*8,314*20~30
d[I]/d[0,43]=A[I]0.52,72-20-40/2*8,314*20~30
d[I]/d[0,44]=A[I]0.52,72-20-40/2*8,314*20~30









![Исследование физико-химических свойств Трихлорэтана и описание изобретения Вследствие этого расход инициатора на единицу количества продукта выражается дифференциальным Вследствие этого расход инициатора на единицу количества продукта выражается дифференциальным уравнением: d[I]/d[B]=A[I]0.5e-E/2RT где](/img/thumbs/cb6ad872590cf84be4d1c5f841ca143f-800x.jpg)
![Исследование физико-химических свойств Трихлорэтана и описание изобретения При термическом хлорировании, Е≈125-170 кДж/моль d[I]/d[0.5]=A[I]0.52,72-125-170 /2*8,314*20~30 d[I]/d[0,43]=A[I]0.52,72-125-170 /2*8,314*20~30 d[I]/d[0,44]=A[I]0.52,72-125-170 /2*8,314*20~30При При термическом хлорировании, Е≈125-170 кДж/моль d[I]/d[0.5]=A[I]0.52,72-125-170 /2*8,314*20~30 d[I]/d[0,43]=A[I]0.52,72-125-170 /2*8,314*20~30 d[I]/d[0,44]=A[I]0.52,72-125-170 /2*8,314*20~30При химическом хлорировании, Е≈85](/img/thumbs/a3688c35cc7d94cbed6b010452e1dd4a-800x.jpg)