Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Ижевск 2019 Кафедра Химия и химическая технология Курс Основы электрохимии в
Содержание
- 1. Ижевск 2019 Кафедра Химия и химическая технология Курс Основы электрохимии в
- 2. Темы лекций Тема 1. Основы электрохимии. Термодинамика
- 3. Тема «Основы электрохимии. Термодинамика электродных процессов»Ижевск2019Кафедра «Химия
- 4. План лекцииХимические источники электрического токаВозникновение электродного потенциалаСтандартный водородный электродТипы электродовГальванические элементыТопливные элементыАккумуляторыПоляризация и перенапряжение
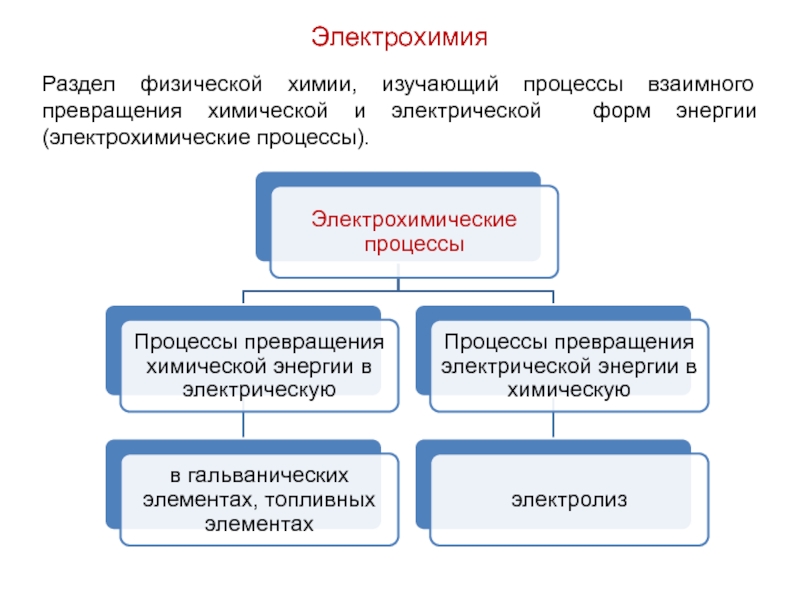
- 5. Раздел физической химии, изучающий процессы взаимного превращения химической и электрической форм энергии (электрохимические процессы).Электрохимия
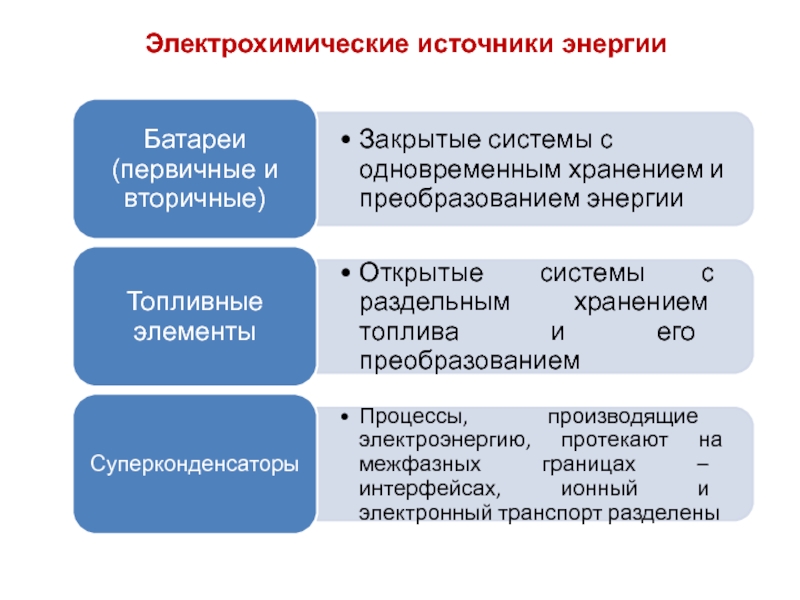
- 6. Электрохимические источники энергии
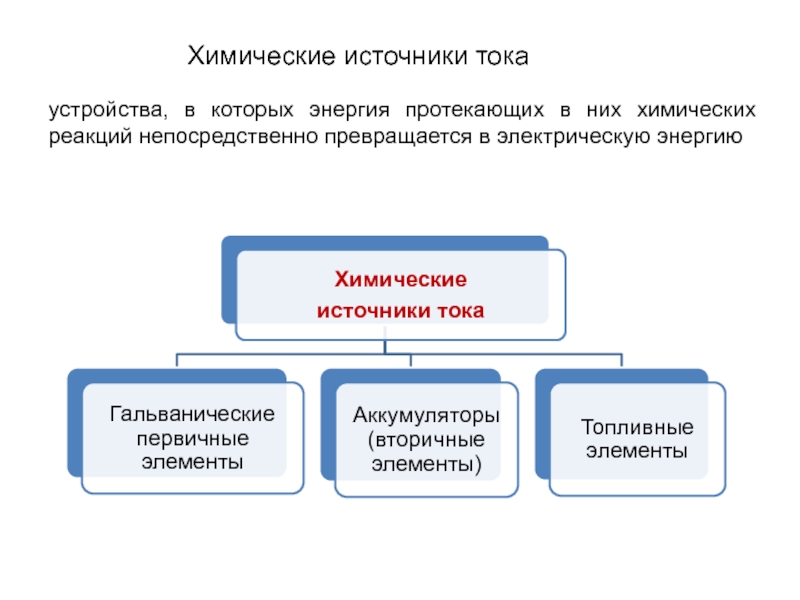
- 7. Химические источники тока устройства, в которых энергия
- 8. Электролит Вещество, которое проводит электрический ток вследствие диссоциации на ионы, что происходит
- 9. Это электрический проводник, имеющий электронную проводимость (проводник 1-го рода)
- 10. РавновесиеВозникновение электродного потенциалаЕсли металл активный (Zn, Mg,
- 11. Схема стандартного водородного электродаСтандартный водородный электродДля характеристики
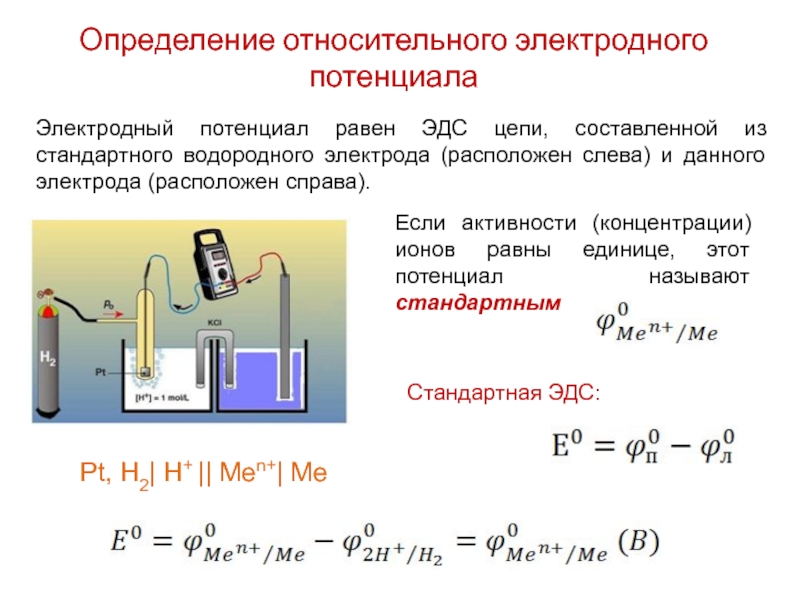
- 12. Определение относительного электродного потенциалаЭлектродный потенциал равен ЭДС
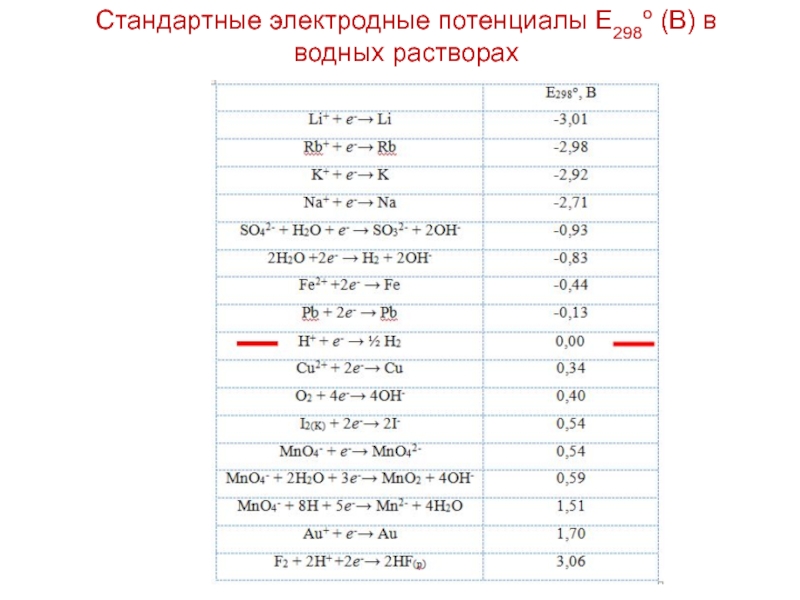
- 13. Стандартные электродные потенциалы полуреакций
- 14. Стандартные электродные потенциалы Е298о (В) в водных растворах
- 15. Равновесный электродный потенциал (В. Нернст, 1889 г.)где
- 16. Равновесный электродный потенциалПри подстановке значений постоянных величин
- 17. Типы электродовРазличаются по химической природе веществ, участвующих
- 18. Электроды второго родаСостоят из металла, покрытого слоем
- 19. Редокс-электродыСостоят из инертного металла (Pt), который не
- 20. Газовые электродыСостоят из инертного металла (Pt), контактирующего
- 21. Кислородный электрод Газовые электродыРt |O2 |OH-Электродные процессы:
- 22. Электрохимическая система, состоящая из двух электродов, растворы
- 23. Связь ЭДС гальванического элемента с протекающей в
- 24. 1. 2. 3. Определение анода и
- 25. Электродные процессы или окислительно – восстановительные полуреакции:Zn
- 26. Характеристики гальванических элементовГальванические элементы характеризуются: э.д.с., емкостью,
- 27. Высокий КПД достигается благодаря прямому превращению энергии
- 28. Водородно-кислородный топливный элементВыделяющаяся энергия непосредственно превращается в
- 29. Топливный элемент с протонопроводящей мембранойПористые электроды с
- 30. Под ред. В.А.Мошникова и Е.И.Терукова. Основы водородной энергетики.
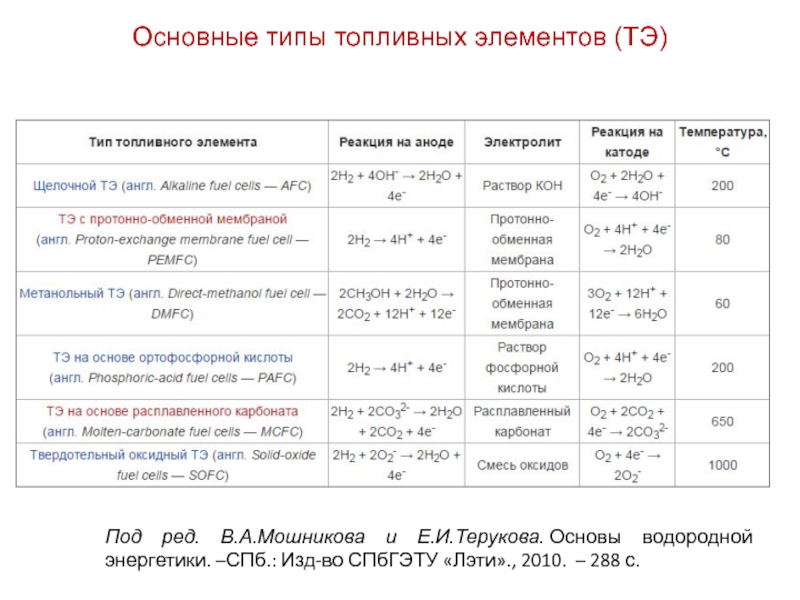
- 31. Основные типы ТЭ и их характеристики
- 32. Основные типы ТЭ и их характеристики
- 33. В твердооксидных топливных элементах роль проводника электричества
- 34. При работе элемента на катоде молекулы кислорода
- 35. КПД 80 – 90 % Экологически чистый Бесшумный Быстрая кинетика электродных процессовТвердооксидный топливный элемент (ТОТЭ)
- 36. Стандартные материалы
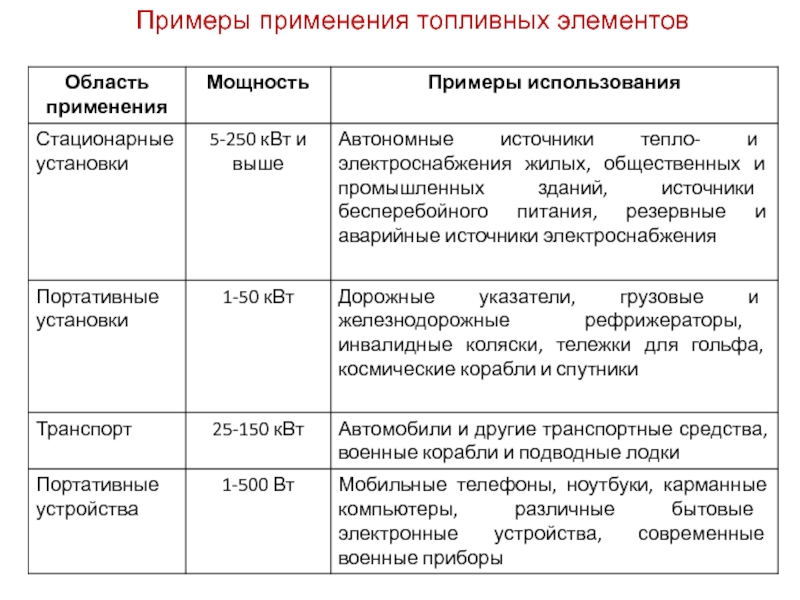
- 37. Примеры применения топливных элементов
- 38. Вклад нанотехнологий в этот вид конверсии энергии
- 39. Ещё более динамично на основе нанотехнологий растет
- 40. Выводы К широко распространенной разновидности окислительно-восстановительных процессов
- 41. Литература 1. Глинка Н.Л. Общая химия. –
- 42. © ФГБОУ ВО ИжГТУ имени М.Т. Калашникова, 2018© Семакина Надежда Владимировна, 2018СПАСИБО ЗА ВНИМАНИЕ
- 43. Скачать презентанцию
Слайды и текст этой презентации
Слайд 1Ижевск
2019
Кафедра «Химия и химическая технология»
Курс «Основы электрохимии в применении
к
накопителям энергии»
Слайд 2Темы лекций
Тема 1. Основы электрохимии. Термодинамика электродных процессов.
Тема 2.
Кинетика электродных процессов. Поляризация.
Тема 3. Процессы превращения электрической энергии в
химическую.Тема 4. Конденсаторы.
Слайд 3Тема «Основы электрохимии. Термодинамика электродных процессов»
Ижевск
2019
Кафедра «Химия и химическая технология»
Курс
«Основы электрохимии в применении
к накопителям энергии»
Автор Семакина Н.В., к.т.н.,
доцентСлайд 4План лекции
Химические источники электрического тока
Возникновение электродного потенциала
Стандартный водородный электрод
Типы электродов
Гальванические
элементы
Топливные элементы
Аккумуляторы
Поляризация и перенапряжение
Слайд 5Раздел физической химии, изучающий процессы взаимного превращения химической и электрической
форм энергии (электрохимические процессы).
Электрохимия
Слайд 7Химические источники тока
устройства, в которых энергия протекающих в них
химических реакций непосредственно превращается в электрическую энергию
Слайд 8Электролит
Вещество, которое проводит электрический ток вследствие диссоциации на ионы, что происходит в растворах и расплавах, или
движения ионов в кристаллических решетках твёрдых электролитов.
Примеры электролитов: водные растворы кислот, солей и оснований и некоторые кристаллы (например, иодид
серебра, диоксид циркония). Электролиты – проводники второго рода, вещества, электропроводность которых обусловлена подвижностью положительно или отрицательно заряженных ионов.
Электролиты являются важной частью химических источников тока: гальванических элементов и аккумуляторов. Электролит участвует в химических реакциях окисления и восстановления с электродами, благодаря чему возникает ЭДС.
В источниках тока электролит может находиться в жидком состоянии (обычно это – водный раствор), или загущённым до состояния геля.
Слайд 9 Это электрический проводник, имеющий электронную проводимость (проводник 1-го рода) и находящийся в
контакте с ионным проводником – электролитом (ионной жидкостью, ионизированным газом, твёрдым электролитом).
Важнейшей характеристикой электродов является электродный
потенциал, устанавливающийся на границе электрод/электролит.В электрохимии – это часть электрохимической системы, включающая в себя проводник и окружающий его раствор (например, водородный электрод, хлорсеребряный электрод, электрод сравнения, стеклянный электрод).
Системы двух различных электродов могут использоваться как химические источники тока, а при пропускании через такие системы постоянного тока – в качестве электролизеров.
Электрод
Слайд 10Равновесие
Возникновение электродного потенциала
Если металл активный (Zn, Mg, Al), происходит его
окисление
Если металл неактивный (Cu, Ag), происходит восстановле-ние ионов металла из
раствора электролитаВеличину электродного потенциала нельзя ни измерить, ни рассчитать
ДЭС ДЭС
Слайд 11Схема стандартного водородного электрода
Стандартный водородный электрод
Для характеристики полуэлементов используют величину
электродвижущей силы – разности потенциалов между данным полуэлементом и так
называемым электродом сравнения – стандартным водородным электродомСлайд 12Определение относительного электродного потенциала
Электродный потенциал равен ЭДС цепи, составленной из
стандартного водородного электрода (расположен слева) и данного электрода (расположен справа).
Если
активности (концентрации) ионов равны единице, этот потенциал называют стандартнымСтандартная ЭДС:
Pt, H2| H+ || Men+| Me
Слайд 15Равновесный электродный потенциал
(В. Нернст, 1889 г.)
где
– стандартный
электродный потенциал;R – молярная газовая постоянная, 8,31 Дж/моль К;
T – абсолютная температура;
F – постоянная Фарадея, 96500 Кл/моль;
n – число электронов, участвующих в окислительно-восстановительном процессе;
и – активности окисленной и восстановленной форм вещества, участвующего в электродной реакции.
Слайд 16Равновесный электродный потенциал
При подстановке значений постоянных величин R (8,31 Дж/моль
К), F (96500 Кл/моль), стандартной температуры Т (250C = 298
К) и переходе к десятичным логарифмам :Слайд 17Типы электродов
Различаются по химической природе веществ, участвующих в электродном процессе
Электроды
первого рода
Восстановленная форма (Red) – металл электрода; окисленная (Ox) -
ионы этого металла Для чистых твердых и жидких веществ = 1
В разбавленных растворах активность равна молярной концентрации :
a = (моль/л).
Упрощенное уравнение Нернста:
Cu2+ + 2e = Cu0
Слайд 18Электроды второго рода
Состоят из металла, покрытого слоем его труднорастворимой соли,
погруженного в раствор, содержащий анионы этой соли
Хлорсеребряный электрод: Ag
| AgCl | Cl-Уравнение реакции, протекающей на электроде:
AgCl + e = Ag0 + Cl-
Слайд 19Редокс-электроды
Состоят из инертного металла (Pt), который не участвует в реакции,
а является переносчиком электронов между окисленной (Ox) и восстановленной (Red)
формами вещества.Fe3+ + e = Fe2+
Pt |Ox, Red
Схема электрода:
Электродная реакция:
Слайд 20Газовые электроды
Состоят из инертного металла (Pt), контактирующего одновременно с газом
и раствором, содержащим ионы этого газа.
Восстановленная форма – газ, окисленная
– ионы в раствореВодородный электрод Pt, H2|H+
Электродная реакция:
Зависимость электродного потенциала от рН среды (для идеальных газов a = p(бар)):
Слайд 21Кислородный электрод
Газовые электроды
Рt |O2 |OH-
Электродные процессы: в кислой среде:
в
нейтральной и щелочной средах:
Зависимость электродного потенциала от рН:
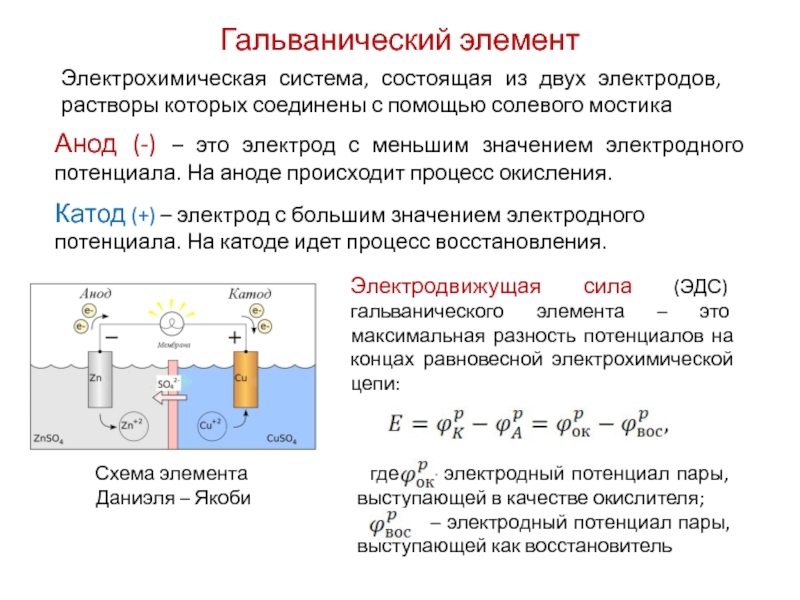
Слайд 22Электрохимическая система, состоящая из двух электродов, растворы которых соединены с
помощью солевого мостика
Гальванический элемент
Схема элемента
Даниэля – Якоби
Анод
(-) – это электрод с меньшим значением электродного потенциала. На аноде происходит процесс окисления.Катод (+) – электрод с большим значением электродного потенциала. На катоде идет процесс восстановления.
Электродвижущая сила (ЭДС) гальванического элемента – это максимальная разность потенциалов на концах равновесной электрохимической цепи:
где – электродный потенциал пары, выступающей в качестве окислителя;
– электродный потенциал пары, выступающей как восстановитель
Слайд 23Связь ЭДС гальванического элемента с протекающей в нем химической реакции
При
постоянных температуре (Т) и давлении (р) уменьшение энергии Гиббса
равно электрической работе, которую может совершить гальванический элемент:Следовательно, окислительно – восстановительный процесс возможен, если
Электродвижущая сила гальванического элемента
Максимальная разность потенциалов на концах равновесной электрохимической цепи:
где – электродный потенциал пары, выступающей в качестве окислителя;
– электродный потенциал пары, выступающей как восстановитель
Слайд 24
1.
2.
3. Определение анода и катода:
Расчет равновесных
электродных потенциалов:
4. Расчет ЭДС:
А – Zn; K – Cu
Слайд 25Электродные процессы или окислительно – восстановительные полуреакции:
Zn + Сu2+ =
Zn2+ + Сu
или Zn + СuSО4 = ZnSО4 +
Сu А (-): Zn 0 - 2ē Zn 2+ (окисление )
К (+): Сu 2+ + 2ē Сu 0 (восстановление)
Уравнение токообразующей реакции:
Схема медно-цинкового гальванического элемента:
(-) Zn|ZnSO4||CuSO4|Cu (+)
или в ионной форме:
(-) Zn|Zn2+||Cu2+|Cu (+)
Слайд 26Характеристики гальванических элементов
Гальванические элементы характеризуются: э.д.с., емкостью, энергией, которую он
может отдать во внешнюю цепь, сохраняемостью.
Электродвижущая сила (ЭДС) гальванического элемента зависит
от материала электродов и состава электролита. ЭДС описывается термодинамическими функциями протекающих электрохимических процессов, в виде уравнения Нернста.Емкость элемента – это количество электричества, которое источник тока отдает при разряде. Емкость зависит от массы запасенных в источнике реагентов и степени их превращения, снижается с понижением температуры или увеличением разрядного тока.
Энергия гальванического элемента численно равна произведению его емкости на напряжение. С увеличением количества вещества реагентов в элементе и до определенного предела, с увеличением температуры, энергия возрастает. Энергию уменьшает увеличение разрядного тока.
Сохраняемость — это срок хранения элемента, в течение которого его характеристики остаются в заданных пределах. Сохраняемость элемента уменьшается с ростом температуры хранения.
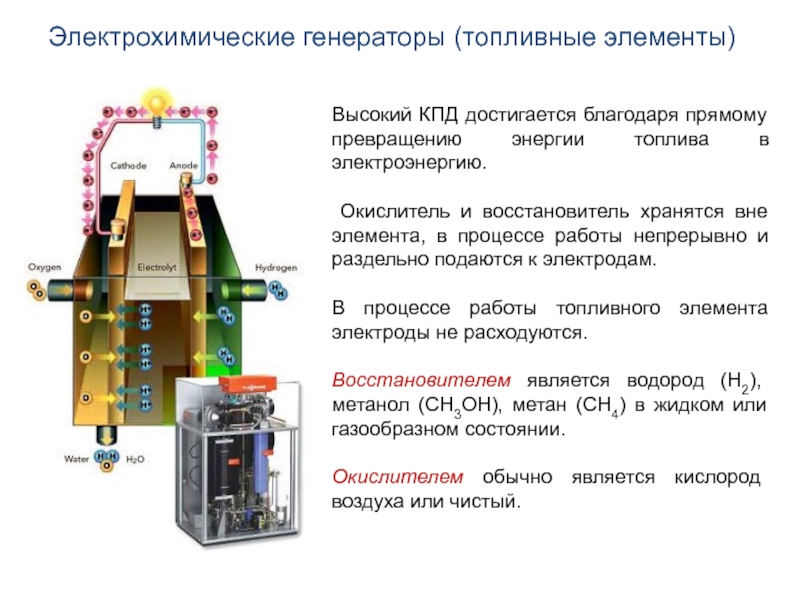
Слайд 27Высокий КПД достигается благодаря прямому превращению энергии топлива в электроэнергию.
Окислитель и восстановитель хранятся вне элемента, в процессе работы непрерывно
и раздельно подаются к электродам.В процессе работы топливного элемента электроды не расходуются.
Восстановителем является водород (H2), метанол (CH3OH), метан (CH4) в жидком или газообразном состоянии.
Окислителем обычно является кислород воздуха или чистый.
Электрохимические генераторы (топливные элементы)
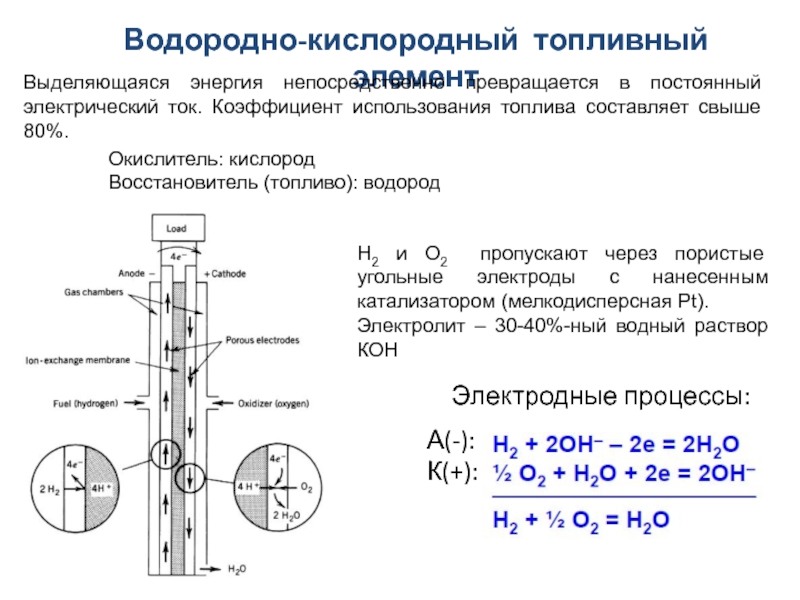
Слайд 28Водородно-кислородный топливный элемент
Выделяющаяся энергия непосредственно превращается в постоянный электрический ток.
Коэффициент использования топлива составляет свыше 80%.
А(-):
К(+):
Электродные процессы:
Окислитель: кислород
Восстановитель (топливо):
водородН2 и О2 пропускают через пористые угольные электроды с нанесенным катализатором (мелкодисперсная Pt).
Электролит – 30-40%-ный водный раствор КОН
Слайд 29Топливный элемент с протонопроводящей
мембраной
Пористые электроды с нанесенным катализатором (мелкодисперсные платиновые
металлы).
Электролит – твердая полимерная мембрана, которая в водном растворе пропускает
протоны, но не проводит электрического тока. Суммарная реакция:
Слайд 30Под ред. В.А.Мошникова и Е.И.Терукова. Основы водородной энергетики. –СПб.: Изд-во СПбГЭТУ
«Лэти»., 2010. – 288 с.
Основные типы топливных элементов (ТЭ)
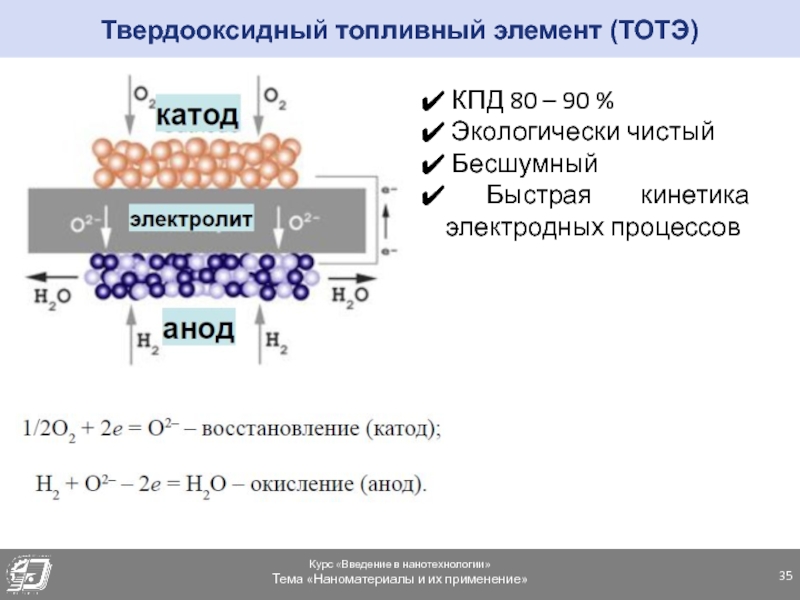
Слайд 33В твердооксидных топливных элементах роль проводника электричества выполняют ионы кислорода
O2-. Электролитом служит тонкий слой керамического материала, проводящего ионы O2-.
Керамика представляет собой наноструктурированный композит на основе металлического никеля и оксида циркония, легированного оксидом иттрия (Ni – ZrO2 (Y2O3). В композите ZrO2(Y2O3) служит для транспорта ионов O2-, а металлический Ni необходим для отвода электронов и, в некоторой степени, для атомизации молекулярного водорода. Он также должен находиться в высокодисперсной форме для увеличения реакционной поверхности.
Композит представляет собой пористый материал, который содержит упаковку ажурных горизонтальных трубок из диоксида циркония с внутренним диаметром и толщиной стенок 3–5 нм, свободно пропускающих газообразный водород и начиненных нанокластерами металлического никеля.
Твердооксидный топливный элемент (ТОТЭ)
Слайд 34При работе элемента на катоде молекулы кислорода присоединяют электроны, восстанавливаясь
в ионы, которые проходят через композит и участвуют в окислении
молекулярного водорода до воды:Выделяющиеся электроны поступают во внешнюю цепь, что и создает электрический ток.
Твердооксидные элементы работают при температуре от 600 до 1000 °C – это самая высокая температура среди всех химических источников тока.
Их КПД также один из самых высоких – около 60 %.
Пригодны для использования в крупномасштабных источниках тока. Доля – 4 %.
Твердооксидный топливный элемент (ТОТЭ)
Слайд 35 КПД 80 – 90 %
Экологически чистый
Бесшумный
Быстрая кинетика электродных процессов
Твердооксидный топливный элемент (ТОТЭ)
Слайд 38Вклад нанотехнологий в этот вид конверсии энергии – это миниатюризация
устройства, совершенствование разделительных мембран, наноструктурированных электродов, использование нанокатализаторов.
Слайд 39Ещё более динамично на основе нанотехнологий растет мировое производство топливных
элементов.
В 2013 году их было произведено на 18 миллиардов
долл. США. В Европе в 2010 году было произведено топливных элементов на 1 миллиард евро,
а в 2020 году производство планируется увеличить более чем в 20 раз (21,5 миллиардов евро).
Такой рост производства топливных элементов связан с переходом в европейском и мировом автопроме от бензиновых и дизельных двигателей на электро-, гибридные и водородные двигатели.
Нанотехнологии в современной энергетике и в энергетике будущего (производство энергии)
http://www.rusnor.org/pubs/reviews/12800.htm
Слайд 40Выводы
К широко распространенной разновидности окислительно-восстановительных процессов относятся электрохимические, включающие
реакции превращения химической энергии в электрическую и электрической энергии в
химическую.Важным параметром электрохимических реакций является электродный потенциал, зависящий от природы реакции, температуры, активности ионов и парциального давления газообразных реагентов и продуктов реакции.
В гальваническом элементе окислительно-восстановительная реакция может самопроизвольно протекать в таком направлении, при котором электрохимическая система с более высоким значением электродного потенциала выступает в качестве окислителя, т.е. восстанавливается.
Слайд 41Литература
1. Глинка Н.Л. Общая химия. – М.: Кнорус, 2010.
2.
Коровин Н.В. Общая химия: учебник техн. напр. и спец. вузов.
– 12-е изд., испр. – М.: Высш. шк., 2010. – 557 с.3. Еремин В.В. Общая и физическая химия лекция (курс лекций) [2007, PDF, RUS]. http://rutracker.org/forum/viewtopic.php?t=3344654
4. Неорганическая химия: В 3 т. / Под ред. Ю.Д.Третьякова. Т. 2: Химия непереходных элементов: Учебник для студ. высш. учеб. заведений / А.А.Дроздов, В.П.Зломанов, Г.Н.Мазо, Ф.М.Спиридонов. - М.: Издательский центр «Академия», 2004. -368 с.
5. Основы водородной энергетики/ Под ред. В.А. Мошникова и Е.И. Терукова. – СПб.: Изд-во СПбГЭТУ «Лэти»., 2010. – 288 с.