Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Изотопы
Содержание
- 1. Изотопы
- 2. ИзотопыЭто разновидности данного химического элемента, различающиеся по
- 3. История открытия изотоповПервое доказательство того, что вещества,
- 4. Вещества, идентичные по химическим свойствам, но различные
- 5. Изотопы водородаВодород встречается в виде трёх изотопов,
- 6. Изотопы водорода3 Н — тритий
- 7. изотопы находятся в одном и том же
- 8. Радиоактивные изотопы— изотопы, ядра которых нестабильны и
- 9. Скачать презентанцию
ИзотопыЭто разновидности данного химического элемента, различающиеся по массе атомных ядер. Это разновидности атомов (и ядер) одного химического элемента с разным количеством нейтронов в ядре.
Слайды и текст этой презентации
Слайд 2Изотопы
Это разновидности данного химического элемента, различающиеся по массе атомных ядер.
Слайд 3История открытия изотопов
Первое доказательство того, что вещества, имеющие одинаковое химическое
поведение, могут иметь различные физические свойства, было получено при исследовании
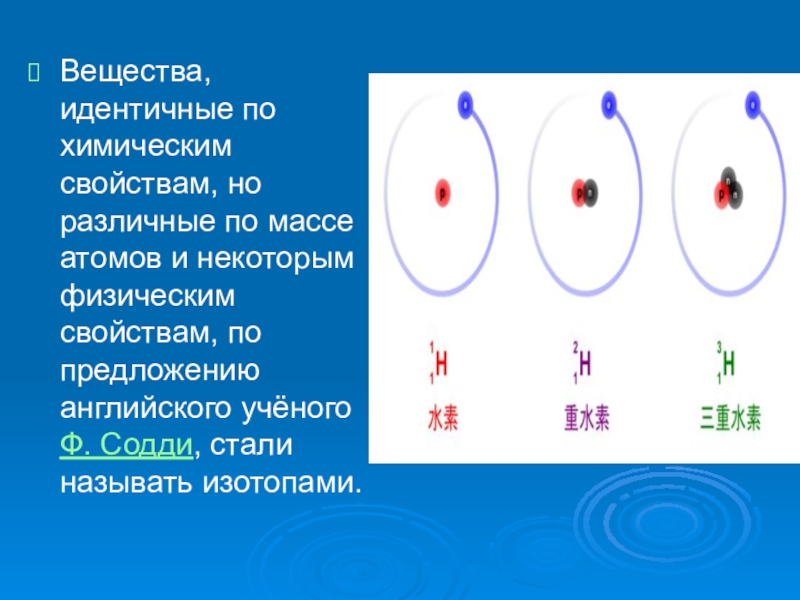
радиоактивных превращений атомов тяжёлых элементов. В 1906—07 выяснилось, что продукт радиоактивного распада урана — ионий и продукт радиоактивного распада тория — радиоторий, имеют те же химические свойства, что и торий, но отличаются от него атомной массой и характеристиками радиоактивного распада. Было обнаружено позднее, что у всех трёх продуктов одинаковы оптические и рентгеновские спектры.Слайд 4Вещества, идентичные по химическим свойствам, но различные по массе атомов
и некоторым физическим свойствам, по предложению английского учёного Ф. Содди, стали
называть изотопами.Слайд 5Изотопы водорода
Водород встречается в виде трёх изотопов, которые имеют индивидуальные
названия: 1H — протий (Н), 2Н — дейтерий (D), 3Н — тритий (T;
радиоактивный).Протий и дейтерий являются стабильными изотопами с массовыми числами 1 и 2. Содержание их в природе соответственно составляет 99,98% и 0,01 %. Это соотношение может незначительно меняться в зависимости от источника и способа получения водорода..
Слайд 6Изотопы водорода
3
Н — тритий (T) радиоактивный).
Изотоп водорода
3Н (тритий) нестабилен. Его период полураспада составляет 12,32 лет. Тритий
содержится в природе в очень малых количествах.Слайд 7изотопы находятся в одном и том же месте (в одной
клетке) таблицы Менделеева.
16 17
18O, O, O
— три стабильных изотопа кислорода
Все изотопы одного элемента имеют одинаковый заряд ядра ( у кислорода 8), отличаясь лишь числом нейтронов. Обычно изотоп обозначается символом химического элемента, к которому он относится, с добавлением верхнего левого индекса, означающего массовое число