Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
КАФЕДРА ФИЗИЧЕСКОЙ ХИМИИ СПбГТИ (ТУ) ОС ЕННИЙ СЕМЕСТР 201 8 -201 9 учебный
Содержание
- 1. КАФЕДРА ФИЗИЧЕСКОЙ ХИМИИ СПбГТИ (ТУ) ОС ЕННИЙ СЕМЕСТР 201 8 -201 9 учебный
- 2. раздел химии, изучающий энергетику химическихи фазовых превращений,
- 3. Предмет исследования в термодинамике – СИСТЕМА ГраницаЛюбой
- 4. ГомогенныеИнтенсивные свойства одинаковы во всех частях системыХотя
- 5. СИСТЕМЫ1. Основные понятия и определения1.1. Термодинамические системы
- 6. 1. Основные понятия и определения1.1. Термодинамические системы
- 7. Интенсивные свойства имеют определенное значение в каждой
- 8. В гомогенных системах совокупность интенсивных термодинамических свойств
- 9. Термодинамические переменные – это величины, количественно выражающие
- 10. Набор независимых переменных задает термодинамическое состояние системыВ
- 11. 1. Основные понятия и определения1.3. Термодинамические процессыРабота
- 12. Существует аддитивная функция состояния термодинамической системы –
- 13. Понятие энергииАбсолютное значение внутренней энергии нельзя измерить
- 14. 2. Законы термодинамики2.1.1. Энтальпия и Теплоемкостьэнтальпия- внутреннее
- 15. Закон Гесса (основной закон термохимии)Химические превращения веществ,
- 16. Первое следствие из Закона Гесса Тепловой эффект
- 17. Стандартные состояния (состояния сравнения) Если не оговорено
- 18. 2. Законы термодинамики2.1.1. Теплоемкость и энтальпияПростые веществаПродукты реакцииИсходные веществаХимическая термодинамика
- 19. При поглощении тепла веществом его температура, как
- 20. 2. Законы термодинамики2.1.1. Теплоемкость и энтальпияХимическая термодинамика
- 21. Изменение энтальпии при нагревании веществTЖГTпл.Tисп.Изменение энтальпии без
- 22. Изменение энтальпии при нагревании веществ2. Законы термодинамики2.1.1.
- 23. Первый закон термодинамики утверждает, что в системах
- 24. Существует аддитивная функция состояния термодинамической системы –
- 25. 2.2.1. Формулировка второго закона термодинамики2. Законы термодинамики2.2.
- 26. 2.2.1. Формулировка второго закона термодинамики2. Законы термодинамики2.2.
- 27. 2.2.1. Формулировка второго закона термодинамики2. Законы термодинамики2.2.
- 28. 2.2.1. Формулировка второго закона термодинамики2. Законы термодинамики2.2.
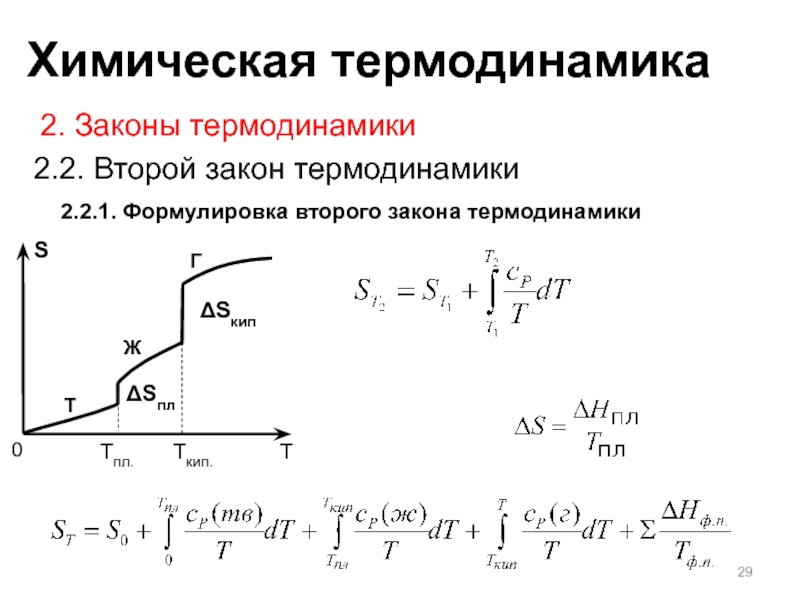
- 29. 2.2.1. Формулировка второго закона термодинамики2. Законы термодинамики2.2. Второй закон термодинамикиTЖГTпл.Tкип.0SΔSкипΔSплTХимическая термодинамика
- 30. 2.2.1. Формулировка второго закона термодинамики2. Законы термодинамики2.2.
- 31. 2.2.1. Формулировка второго закона термодинамики2. Законы термодинамики2.2.
- 32. 3. Критерии самопроизвольного протекания процесса3.1. Энергии Гиббса
- 33. 3. Критерии самопроизвольного протекания процесса3.1. Энергии Гиббса
- 34. 3. Критерии самопроизвольного протекания процесса3.1. Энергии Гиббса
- 35. 3. Критерии самопроизвольного протекания процесса3.1. Энергии Гиббса и ГельмгольцаКритерии самопроизвольного протекания процессаХимическая термодинамика
- 36. 4. Зависимость изменения энергии Гиббса от реальных
- 37. 4. Зависимость изменения энергии Гиббса от реальных
- 38. 4. Зависимость изменения энергии Гиббса от реальных
- 39. Условие равновесия Константа равновесия – критерий полноты протекания реакцииK>>1 в равновесной смеси преобладают продукты реакцииK
- 40. Следует различать истинное равновесие и мнимое или
- 41. (с учетом ΔGo=ΔHo-TΔSo)к уменьшению K для экзотермических
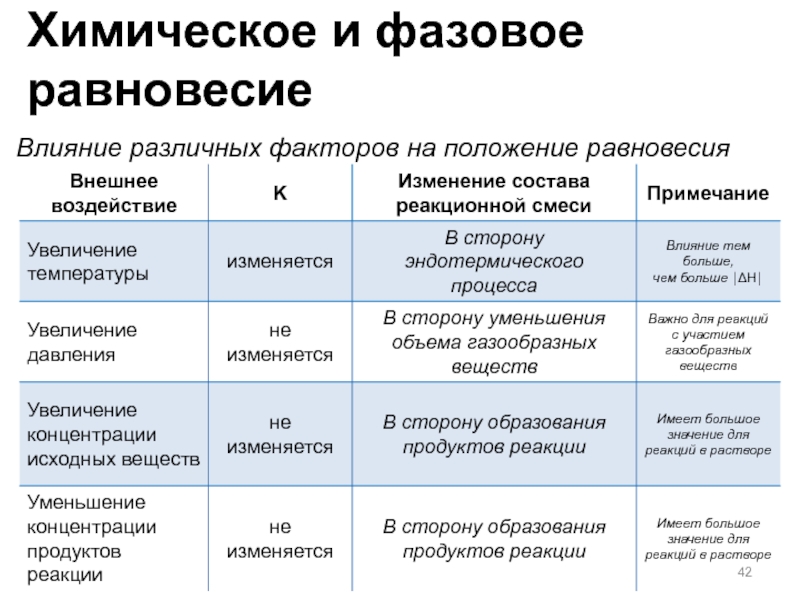
- 42. Влияние различных факторов на положение равновесияХимическое и фазовое равновесие
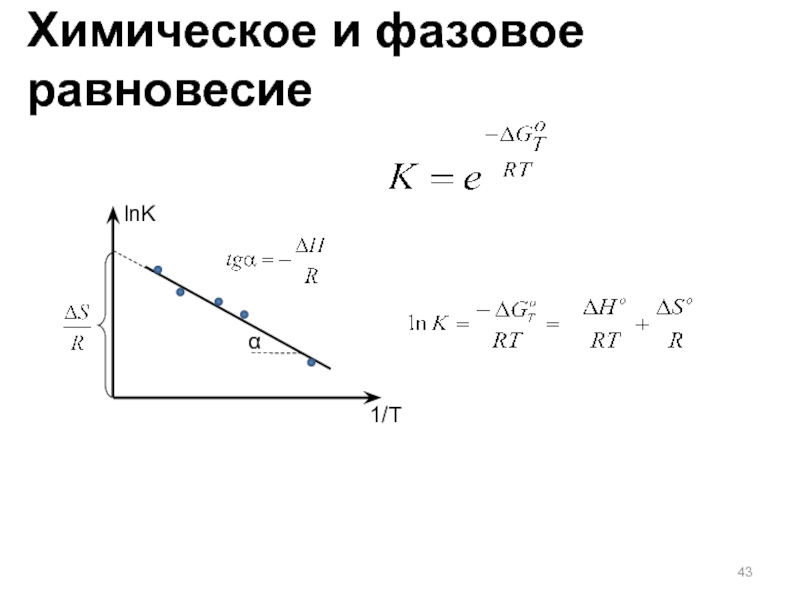
- 43. lnK1/TαХимическое и фазовое равновесие
- 44. Фазовые диаграммыОт химического индивида к фазеКлод Луи
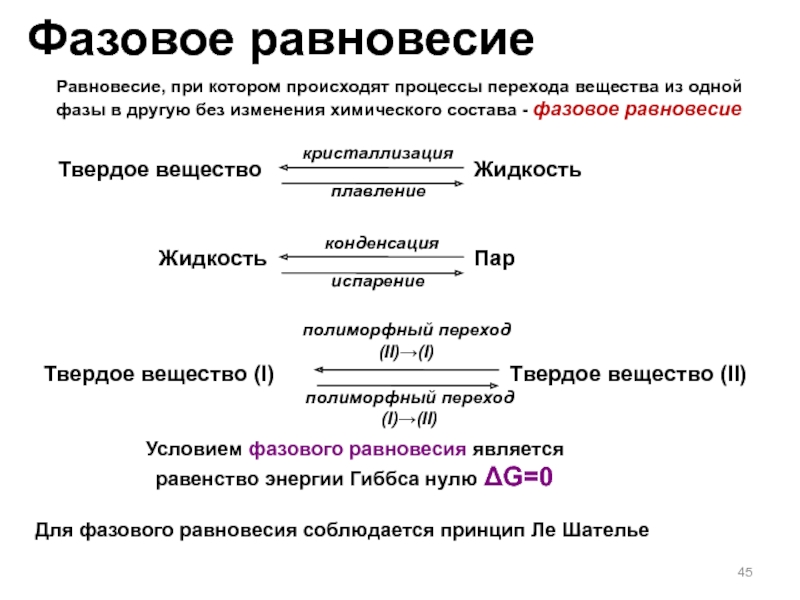
- 45. Фазовое равновесиеРавновесие, при котором происходят процессы перехода
- 46. Фазовое равновесиеВыбор параметров, влияющих на равновесие гетерогенной
- 47. Физико-химический анализФИЗИКО-ХИМИЧЕСКИЙ АНАЛИЗ изучает зависимости между составом
- 48. Преимущество физико-химического анализа как метода исследования заключается
- 49. Наглядное обобщение физико-химической информацииФазовые диаграммы
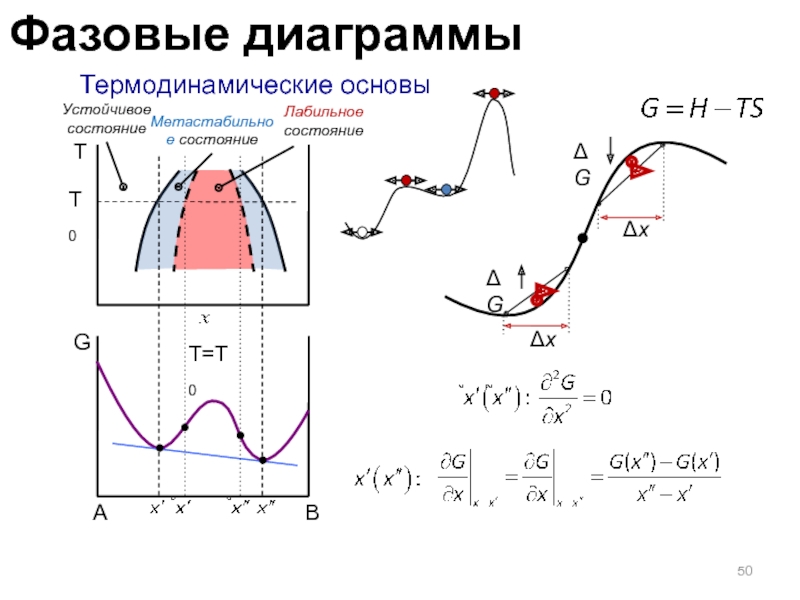
- 50. Термодинамические основыTGT0T=T0AΔxΔxΔGΔGУстойчивое состояниеМетастабильное состояниеЛабильное состояниеBФазовые диаграммы
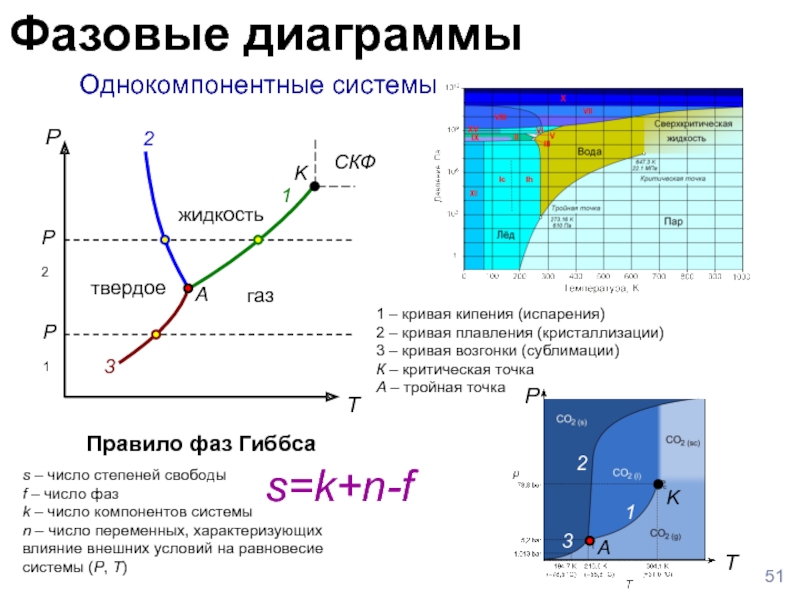
- 51. Однокомпонентные системы1 – кривая кипения (испарения)2 – кривая плавления (кристаллизации)3
- 52. Термический анализФазовые диаграммыТЕТАТВТАВвремяТАТВТТТЕ12Е34 А FG12Е34Кривые охлажденияДиаграмма состояния (плавкости)Пирометр КурнаковаСовременный термоанализатор состав B х1х2х3хeх4
- 53. Двухкомпонентные системыЭвтектический типABСостав по компоненту B ТемператураTATBжидкость (L)L+AA+BEL+BNMQOCDПравило рычагаTAETB - ликвидусМEN - солидусФазовые диаграммы
- 54. Двухкомпонентные системыЭвтектический типBiCdx, мол. %Т, °С271°CLBi +
- 55. Двухкомпонентные системыЭвтектический типс ограниченной растворимостью компонентовABСостав по компоненту BТемператураTATBLL+αEL+ βFNαMGα+ ββDOQxOxDxQПравило рычагаMgOBeOxBeO, мол. %Т, °С 10 20 30 40 50 60 70 80 9016002000240028001855°Фазовые диаграммы
- 56. Двухкомпонентные системыПеритектический тип с ограниченной растворимостью компонентовABТемпература TATBLL+αL+ βFNαMGα+ ββPСостав по компоненту BФазовые диаграммыβαL
- 57. Двухкомпонентные системыЭвтектический тип с конгруэнтно плавящимся соединением ABСостав по компоненту BТемператураTALL+ ATBE1E2AmBnL+ AmBnL+ AmBnL+ BAmBn+BA+AmBnФазовые диаграммы
- 58. Двухкомпонентные системыЭвтектический тип с соединением с эвтектоидным
- 59. Двухкомпонентные системыЭвтектический тип с инконгруэнтно плавящимся соединениемABТемператураTALL+ ATBEAmBnL+ AmBnL+ BAmBn+BA+AmBnPСостав по компоненту BAl2Si6O13Фазовые диаграммы
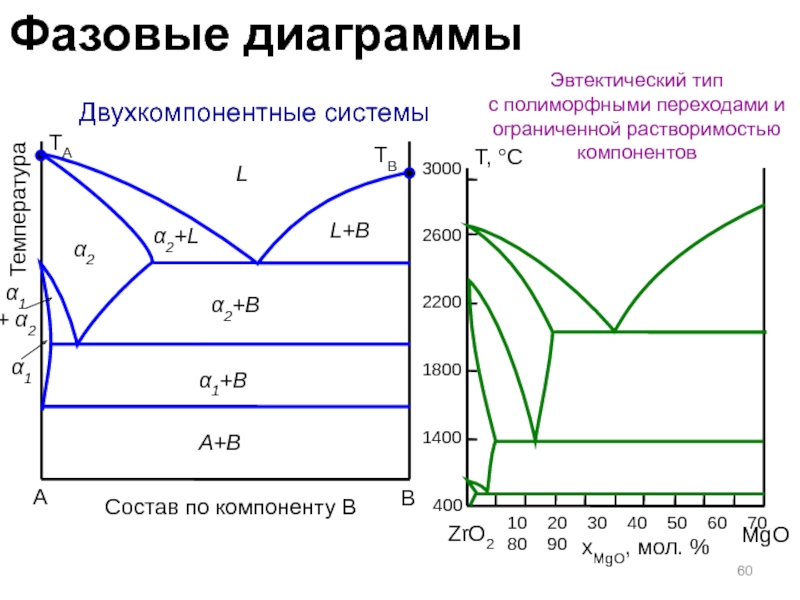
- 60. Двухкомпонентные системыЭвтектический тип с полиморфными переходами и ограниченной растворимостью компонентовABТемператураTATBLα1+BL+Bα2+Bα2α1α2+LА+BСостав по компоненту Bα1 + α2Фазовые диаграммы
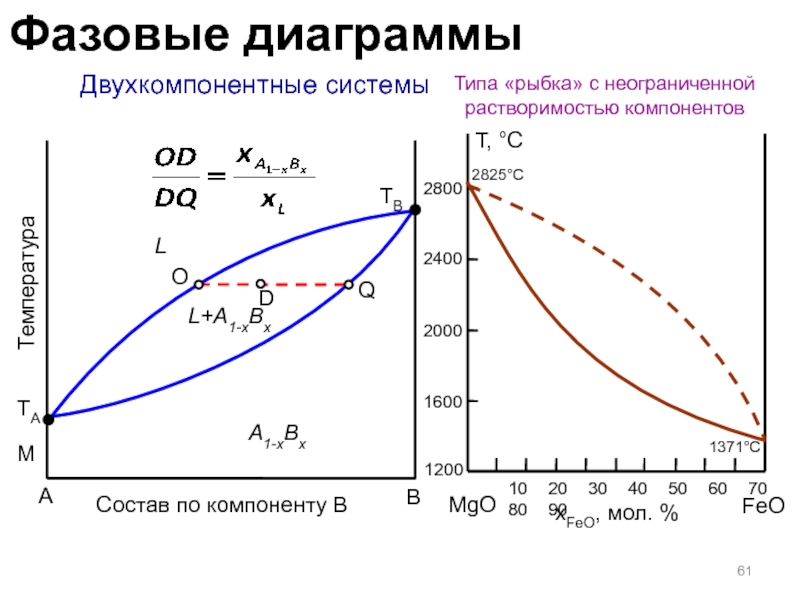
- 61. Двухкомпонентные системыТипа «рыбка» с неограниченной растворимостью компонентовABТемператураLMTBA1-xBxL+A1-xBxMgOFeOxFeO, мол. %Т, °С 10 20 30 40 50 60 70 80 90120016002000280024002825°C1371°CСостав по компоненту BTAQODФазовые диаграммы
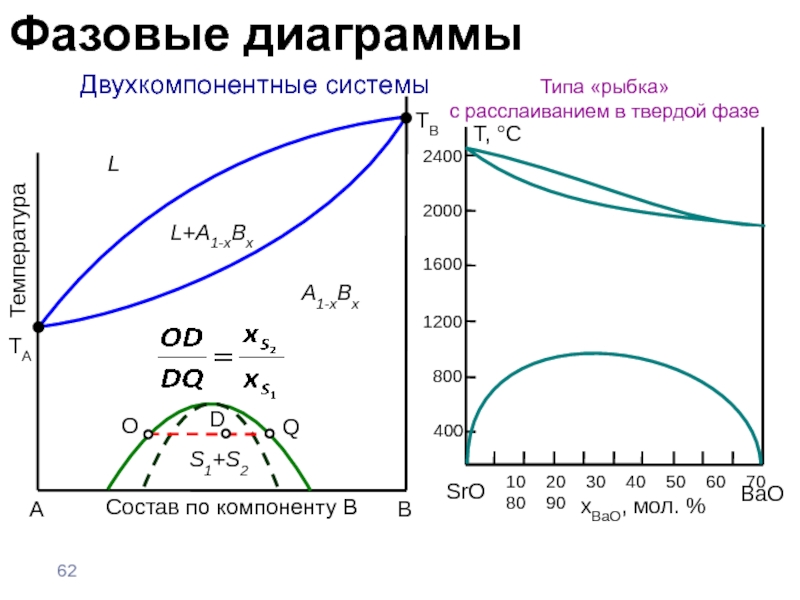
- 62. Двухкомпонентные системыТипа «рыбка» с расслаиванием в твердой фазеABТемператураTALA1-xBxL+A1-xBxS1+S2Состав по компоненту BQODTBФазовые диаграммы
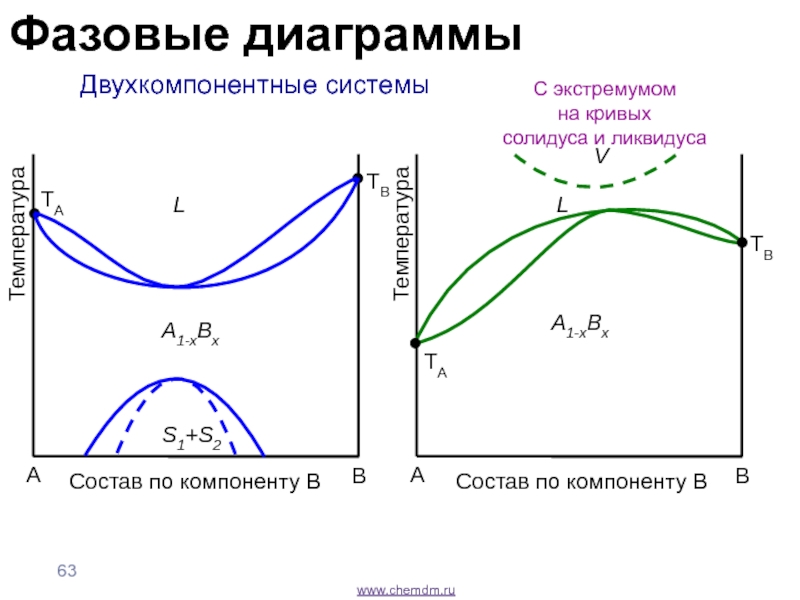
- 63. www.chemdm.ru Двухкомпонентные системыС экстремумом на кривых солидуса и ликвидусаABТемператураTALTBA1-xBxS1+S2ABТемператураTALA1-xBxСостав по компоненту BСостав по компоненту BTBVФазовые диаграммы
- 64. Двухкомпонентные системыС ограниченной растворимостьюв жидкой фазеABТемператураTALL1+ ATBL1+
- 65. Трехкомпонентные системыЭвтектического типаBACB,CTeut ABCTeut ABTeut ACTeut BCTATCTBTB,СTeut
- 66. Системы высшего порядкаУра! Я, наконец-то понял, как
- 67. Обобщение, экспертиза и выпуск справочниковСправочник «Диаграммы
- 68. Диаграмма плавкости железо-углерод60080010001200140016000.0020.82.144.36.67Температура АустенитАустенитЖидкостьЖидкостьПервичный цементитПервичный цементитЛедебуритПервичный
- 69. Микроструктура материалов на основе системы Fe-CЭлектромагнитПружиныШестерниИнструментВалкиДля
- 70. Скачать презентанцию
Слайды и текст этой презентации
Слайд 1КАФЕДРА ФИЗИЧЕСКОЙ ХИМИИ СПбГТИ(ТУ)
ОСЕННИЙ СЕМЕСТР 2018-2019 учебный год
ХИМИЧЕСКАЯ ТЕРМОДИНАМИКА
Слайд 2раздел химии,
изучающий энергетику химических
и фазовых превращений,
направление протекания процессов
в
физико-химических системах,
Слайд 3Предмет исследования в термодинамике – СИСТЕМА
Граница
Любой макроскопический объект, выделенный
из
внешней среды граничной поверхностью
(реальной или воображаемой)
называется СИСТЕМОЙ
Система
Среда
1.
Основные понятия и определения1.1. Термодинамические системы и их свойства
Химическая термодинамика
Слайд 4Гомогенные
Интенсивные свойства одинаковы во всех частях системы
Хотя бы некоторые интенсивные
свойства в пределах системы изменяются скачкообразно
1. Основные понятия и определения
1.1.
Термодинамические системы и их свойстваТЕРМОДИНАМИЧЕСКИЕ СИСТЕМЫ
Гетерогенные
Идеализированные модели реального строения систем
Химическая термодинамика
Слайд 5СИСТЕМЫ
1. Основные понятия и определения
1.1. Термодинамические системы и их свойства
открытые
системы – обмен веществом и энергией
В зависимости от характера обмена
веществом и энергией через граничную поверхность выделяют:закрытые системы – обмен энергией
изолированные системы
Химическая термодинамика
Слайд 61. Основные понятия и определения
1.1. Термодинамические системы и их свойства
Термодинамические
свойства – любые свойства, имеющие количественную меру и относящиеся к
системе в целом или к ее макроскопическим частям, кроме свойств характеризующих потоки энергии и веществаПримеры:
Термодинамические свойства:
масса, плотность, давление, температура, …
Не термодинамические свойства:
вязкость, диффузия, теплопроводность, скорость химической реакции
ТЕРМОДИНАМИЧЕСКИЕ СВОЙСТВА
Химическая термодинамика
Слайд 7Интенсивные свойства имеют определенное значение
в каждой точке системы
Примеры интенсивных свойств:
давление, концентрация, температура, …
1. Основные понятия и определения
1.1. Термодинамические системы
и их свойстваТЕРМОДИНАМИЧЕСКИЕ СВОЙСТВА
Экстенсивные свойства характеризуют
некоторую конечную область системы
Примеры экстенсивных свойств: объем, масса, энергия, …
Интенсивные свойства выражают
физико-химическую индивидуальность объекта
Экстенсивные свойства характеризуют
образец вещества в целом
Химическая термодинамика
Слайд 8В гомогенных системах совокупность интенсивных термодинамических свойств характеризует
термодинамическое состояние системы
Для обозначения термодинамического состояния вещества используется
специальное название –
фаза вещества Понятие фазы вещества введено Гиббсом в качестве наиболее общей характеристики вещества, не зависящей от размеров и формы системы
1. Основные понятия и определения
1.1. Термодинамические системы и их свойства
ТЕРМОДИНАМИЧЕСКИЕ СВОЙСТВА
Фаза – совокупность всех гомогенных частей системы, одинаковых по составу
и по всем химическим и физическим свойствам, не зависящим от количества вещества,
и отграниченных друг от друга поверхностями раздела,
на которых все свойства фазы резко меняются
Химическая термодинамика
Слайд 9Термодинамические переменные – это величины, количественно выражающие термодинамические свойства
Все термодинамические
свойства связаны друг с другом
Этот выбор условен
1. Основные понятия и
определения1.1. Термодинамические системы и их свойства
Выделяют
Независимые переменные – те, что относительно легко измерить (температура, давление, …)
Функции – те, что легче
рассчитать (внутренняя энергия, энтропия, …)
Химическая термодинамика
Слайд 10Набор независимых переменных
задает термодинамическое состояние системы
В отличие от состояния
вещества (фазы) для описания состояния системы надо знать не только интенсивные
свойства, но и хотя бы одну экстенсивную характеристикуТермодинамические параметры системы – это переменные фиксированные в конкретных условиях существования системы
Примеры:
Изобарно-изотермические: P = const, T = const
Изохорно-изотермические: V = const, T = const
1. Основные понятия и определения
1.1. Термодинамические системы и их свойства
Химическая термодинамика
Слайд 111. Основные понятия и определения
1.3. Термодинамические процессы
Работа – упорядоченная (макрофизическая)
форма передачи энергии от системы, совершающей работу, к системе, над
которой она совершаетсяТеплота – не упорядоченная (микрофизическая) форма обмена энергии между системами вследствие хаотического
(теплового) движения частиц
Виды работы (обобщенные термодинамические силы)
- вектор обобщенных сил
- вектор обобщенных координат
- механическая работа
- работа сил поверхностного натяжения
- коэффициент поверхностного натяжения
- площадь поверхности
Химическая термодинамика
Слайд 12Существует аддитивная функция состояния термодинамической системы – внутренняя энергия (U),
такая что мерой изменения внутренней энергии (ΔU) являются количество поступающей в
систему теплоты (Q) и совершаемая ею работа (W)Интегральная форма
Соглашение:
1. положительной считается работа, совершаемая системой над окружающей средой
2. положительным считается количество теплоты, полученное системой из внешней среды
W>0
Q>0
2. Законы термодинамики
2.1. Первый закон термодинамики
Дифференциальная форма
Химическая термодинамика
Слайд 13Понятие энергии
Абсолютное значение внутренней энергии
нельзя измерить и рассчитать
В термодинамике
обычно выбирают какой-то исходный уровень энергии вещества, не рассматривая более
глубоких уровней изменения энергии. Т.е. термодинамика рассматривает системы как иерархически организованные2. Законы термодинамики
2.1. Первый закон термодинамики
Химическая термодинамика
Слайд 142. Законы термодинамики
2.1.1. Энтальпия и Теплоемкость
энтальпия
- внутреннее теплосодержание термодинамической системы
В
изобарном процессе P=const
и является внешним проявлением внутреннего теплосодержания системы
В изохорном
процессе V=constХимическая термодинамика
Слайд 15Закон Гесса (основной закон термохимии)
Химические превращения веществ, происходящие при постоянстве
всех рабочих координат, либо при постоянстве давления и всех рабочих координат,
кроме объема, сопровождаются теплотой, количество которой зависит только от исходного и конечного состояний системы и не зависит от того, какие промежуточные вещества образуются в ходе таких превращений2. Законы термодинамики
2.1.1. Теплоемкость и энтальпия
Химическая термодинамика
Слайд 16Первое следствие из Закона Гесса
Тепловой эффект реакции равен разности
между суммой теплот горения исходных веществ и суммой теплот горения
продуктов реакции с учетом стехиометрических коэффициентов2. Законы термодинамики
2.1.1. Теплоемкость и энтальпия
Теплота горения – тепловой эффект реакции окисления данного соединения кислородом с образованием высших оксидов соответствующих элементов
или соединений этих оксидов
Теплота образования – тепловой эффект реакции образования данного соединения из простых веществ, отвечающих наиболее устойчивому состоянию элементов
при данных температуре и давлении
В связи с тем, что тепловые эффекты реакции зависят от условий (температура, давление) их проведения, то в целях единообразия условились относить температуры теплот образования к температуре 298 К и давлению 1 атм.
Второе следствие из Закона Гесса
Тепловой эффект реакции равен разности между суммой теплот образования продуктов реакции и суммой теплот образования исходных веществ с учетом стехиометрических коэффициентов
Химическая термодинамика
Слайд 17Стандартные состояния (состояния сравнения)
Если не оговорено особо, то обычно
за стандартное состояние вещества выбирают его состояние при давлении 1
атм и со структурой, наиболее стабильной для данного вещества при температуре его исследованияСтандартное состояние может быть гипотетическим, т.е. физически не реализуемым, если для него могут быть рассчитаны термодинамические функции
Термодинамические функции в стандартном состоянии помечают верхним индексом «о»
Стандартные энтальпии веществ обычно табулируют в виде разности стандартного значения энтальпии при некоторой температуре и соответствующим значением при комнатной температуре (298 К)
2. Законы термодинамики
2.1.1. Теплоемкость и энтальпия
Химическая термодинамика
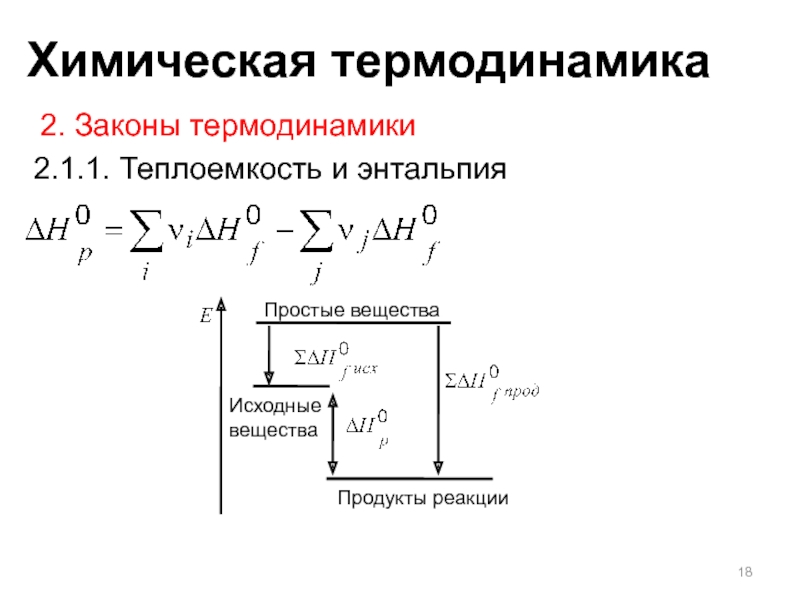
Слайд 182. Законы термодинамики
2.1.1. Теплоемкость и энтальпия
Простые вещества
Продукты реакции
Исходные вещества
Химическая термодинамика
Слайд 19При поглощении тепла веществом его температура, как правило, увеличивается
Теплоемкость зависит
от пути процесса,
т.е. является функцией процесса
Теплоемкость – отношение изменения количества
тепла к изменению температуры системыВиды процессов
при постоянном объеме:
при постоянном давлении:
Теплоемкость при постоянном объеме:
Теплоемкость при постоянном давлении:
2. Законы термодинамики
2.1.1. Теплоемкость и энтальпия
Химическая термодинамика
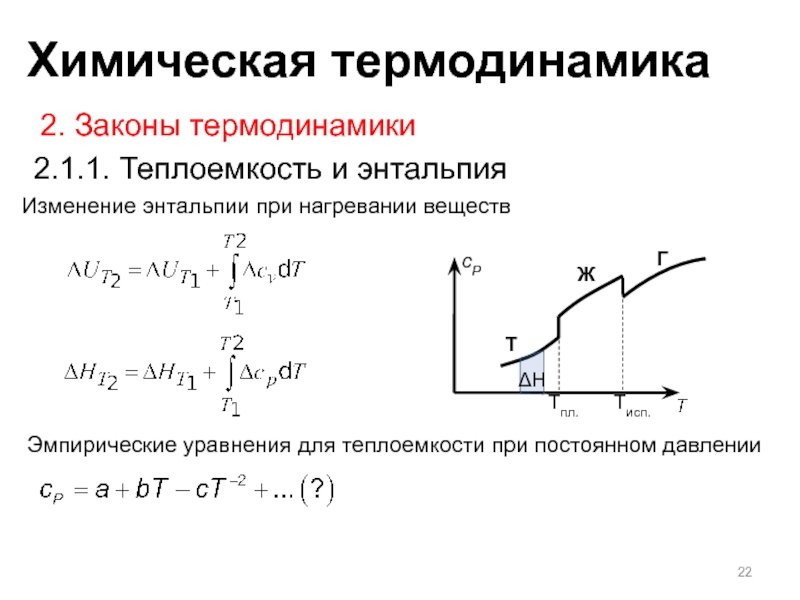
Слайд 21Изменение энтальпии при нагревании веществ
T
Ж
Г
Tпл.
Tисп.
Изменение энтальпии без изменения температуры
(плавление,
испарение, другие фазовые переходы первого рода)
2. Законы термодинамики
2.1.1. Теплоемкость и
энтальпияЗакон Кирхгоффа Температурный коэффициент теплового эффекта процесса равен изменению теплоемкости системы,
происходящему в результате процесса
сP
ΔH
Химическая термодинамика
Слайд 22Изменение энтальпии при нагревании веществ
2. Законы термодинамики
2.1.1. Теплоемкость и энтальпия
Эмпирические
уравнения для теплоемкости при постоянном давлении
T
Ж
Г
Tпл.
Tисп.
сP
ΔH
Химическая термодинамика
Слайд 23Первый закон термодинамики утверждает, что в системах вообще говоря могут
протекать любые процессы, в которых энергия системы постоянна
Опыт показывает, что
реализуются не все процессы, а только те, которые приводят систему к состоянию покоя (равновесия) Обратимые процессы (квазистатические процессы) – т.е. такой процесс, который проводится бесконечно медленно и так, чтобы система находилась все время практически в состоянии равновесия
Состояние равновесия – свойство системы и, следовательно, должно описываться некоторой функцией состояния
2. Законы термодинамики
2.2. Второй закон термодинамики
Химическая термодинамика
Слайд 24Существует аддитивная функция состояния термодинамической системы – энтропия. При обратимых
процессах в адиабатически изолированной системе энтропия системы не изменяется, а
при необратимых процессах – энтропия системы увеличивается2.2.1. Формулировка второго закона термодинамики
Рудольф Клаузиус (самая лаконичная формулировка первого и второго законов термодинамики): «Энергия мира постоянна,
энтропия мира стремится к максимуму»
(обратимый процесс)
(необратимый процесс)
Количественное выражение второго закона термодинамики
2. Законы термодинамики
2.2. Второй закон термодинамики
Химическая термодинамика
Слайд 252.2.1. Формулировка второго закона термодинамики
2. Законы термодинамики
2.2. Второй закон термодинамики
Энтропия
определяется термодинамической вероятностью:
она тем выше, чем больше способов реализации
макросостояния⇒ Энтропия – мера неупорядоченности системы
Людвиг Больцман
– термодинамическая вероятность данного состояния системы при определенном запасе внутренней энергии U и объеме V
– постоянная Больцмана, равная 1.3810-23 Дж/K
Химическая термодинамика
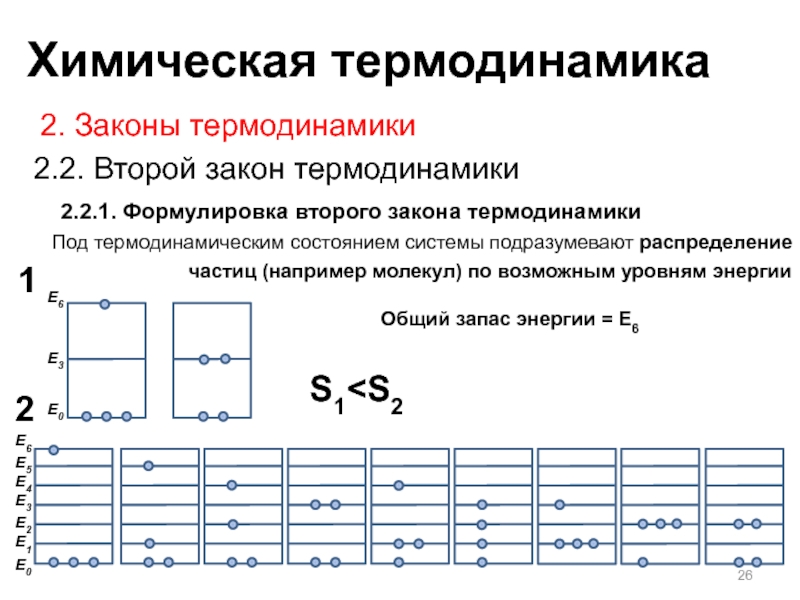
Слайд 262.2.1. Формулировка второго закона термодинамики
2. Законы термодинамики
2.2. Второй закон термодинамики
Под
термодинамическим состоянием системы подразумевают распределение частиц (например молекул) по возможным
уровням энергииE6
E5
E4
E3
E2
E1
E0
E0
E3
E6
Общий запас энергии = E6
S1 1 2 Химическая термодинамика
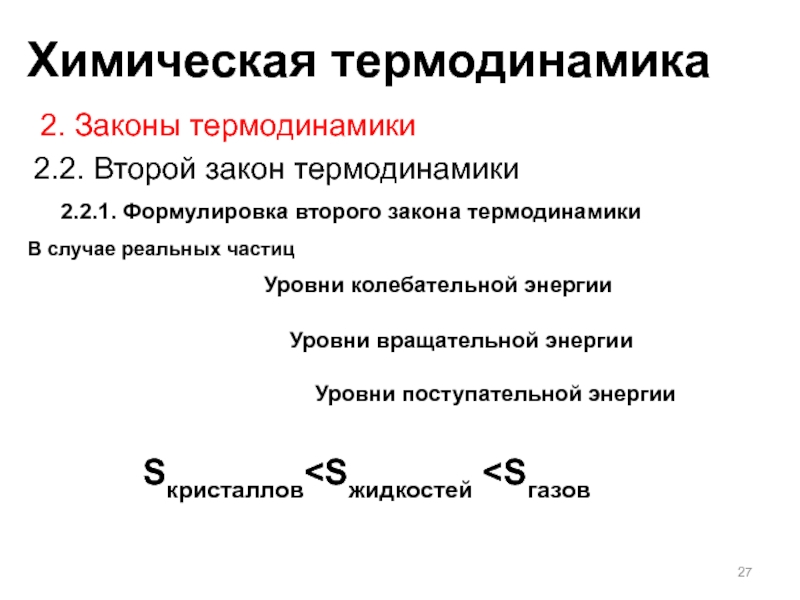
Слайд 272.2.1. Формулировка второго закона термодинамики
2. Законы термодинамики
2.2. Второй закон термодинамики
В
случае реальных частиц
Уровни колебательной энергии
Уровни вращательной энергии
Уровни поступательной энергии
Sкристаллов
Химическая термодинамика
Слайд 282.2.1. Формулировка второго закона термодинамики
2. Законы термодинамики
2.2. Второй закон термодинамики
Энтропия
идеального кристалла индивидуального вещества при температуре абсолютного нуля (0 K)
равна 0постулат Планка
третий закон термодинамики
Sреальных кристаллов≠ 0
Химическая термодинамика
Слайд 292.2.1. Формулировка второго закона термодинамики
2. Законы термодинамики
2.2. Второй закон термодинамики
T
Ж
Г
Tпл.
Tкип.
0
S
ΔSкип
ΔSпл
T
Химическая
термодинамика
Слайд 302.2.1. Формулировка второго закона термодинамики
2. Законы термодинамики
2.2. Второй закон термодинамики
Во
многих случаях изменение энтропии процесса можно оценить качественно
Энтропия всегда увеличивается
при переходе из конденсированного состояния (твердого или жидкого) в парообразноеЭнтропия возрастает при растворении твердого или жидкого вещества, причем чем больше степень диссоциации, тем заметнее увеличивается энтропия
Чем сложнее состав вещества, тем больше его энтропия
В химических реакциях энтропия возрастает, если в результате их протекания увеличивается количество газообразных веществ
Химическая термодинамика
Слайд 312.2.1. Формулировка второго закона термодинамики
2. Законы термодинамики
2.2. Второй закон термодинамики
Второе
начало термодинамики регламентирует принципиальную возможность протекания различных процессов
Невозможно осуществить перенос
тепла от более холодного тела к более горячему, не затрачивая на это работу (Р.Клаузиус)Теплота более холодного из участвующих в процессе тел не может быть источником работы (У. Томсон)
В изолированных системах самопроизвольно идут процессы при которых происходит увеличение энтропии (ΔSизол>0)
т.е. процессы протекают самопроизвольно лишь в сторону менее упорядоченного состояния, т.е. нарастания беспорядка и увеличение энтропии является критерием самопроизвольного протекания процессов, но только в изолированных системах
Химическая термодинамика
Слайд 323. Критерии самопроизвольного протекания процесса
3.1. Энергии Гиббса и Гельмгольца
Любая система
стремится к минимуму энтальпии и максимуму энтропии
Какие же процессы идут
самопроизвольно в неизолированных системах?2H2(г)+O2(г)=2H2O(г)
Энтропия уменьшается, но выделяется большое количество теплоты
ΔS<0, ΔH<0
т.е. самопроизвольному протеканию процесса способствует уменьшение энтальпии
NH4Cl(тв) + aq=NH4+(р) + Cl-(р)
Этот процесс сопровождается понижением температуры (поглощением теплоты) и увеличением энтропии
ΔS>0, ΔH>0
причем главную роль играет последний фактор
Химическая термодинамика
Слайд 333. Критерии самопроизвольного протекания процесса
3.1. Энергии Гиббса и Гельмгольца
G
H-TS
Новая функция, связывающая энтальпию и энтропию –
– энергия
Гиббса ΔG = (ΔH-TΔS)<0
Изменение энергии Гиббса
при P=const и T=const определяет самопроизвольность процесса
ΔU = Q – Aрасш+ E
Если процесс обратимый, то согласно II закону термодинамики
ΔU = TΔS – Aрасш+ E
При P=const
E = ΔU +PΔV – TΔS =ΔG
Величина ΔG характеризует ту часть изменения внутренней энергии, которая может быть превращена в полезную работу
Химическая термодинамика
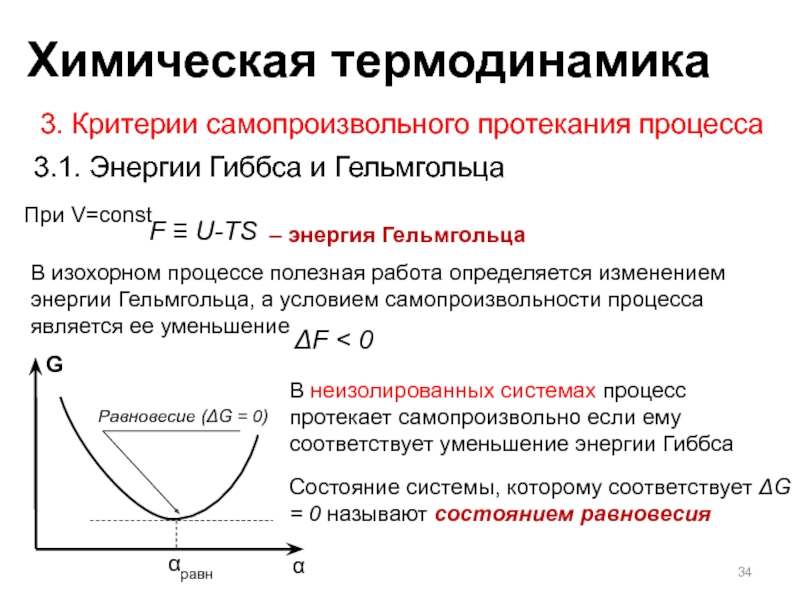
Слайд 343. Критерии самопроизвольного протекания процесса
3.1. Энергии Гиббса и Гельмгольца
F
U-TS
– энергия Гельмгольца
При V=const
В изохорном процессе полезная работа
определяется изменением энергии Гельмгольца, а условием самопроизвольности процесса является ее уменьшение ΔF < 0
G
α
αравн
Равновесие (ΔG = 0)
Состояние системы, которому соответствует ΔG = 0 называют состоянием равновесия
В неизолированных системах процесс протекает самопроизвольно если ему соответствует уменьшение энергии Гиббса
Химическая термодинамика
Слайд 353. Критерии самопроизвольного протекания процесса
3.1. Энергии Гиббса и Гельмгольца
Критерии самопроизвольного
протекания процесса
Химическая термодинамика
Слайд 364. Зависимость изменения энергии Гиббса
от реальных условий
При изменении
давления энергия Гиббса меняется следующим образом
- активность (а)
Активность – величина
безразмерная Для конденсированного состояния под активностью понимают отношение его концентрации к концентрации в стандартном состоянии
т.к. стандартное состояние это то, для которого p = 1,
то
численно равно давлению, выраженному в атмосферах
это можно показать дифференцируя уравнение G=U+PV-TS
Химическая термодинамика
Слайд 374. Зависимость изменения энергии Гиббса
от реальных условий
Стандартные состояния
и активности,
принятые для расчета энергии Гиббса и констант равновесия
Химическая термодинамика
Слайд 384. Зависимость изменения энергии Гиббса
от реальных условий
В общем
виде для произвольной реакции зависимость изменения энергии Гиббса от реальных
условийj – продукты реакции;
i – исходные вещества;
ν – стехиометрические коэффициенты в уравнении реакции;
Изотерма химической реакции
Химическая термодинамика
Слайд 39Условие равновесия
Константа равновесия – критерий полноты протекания реакции
K>>1 в
равновесной смеси преобладают продукты реакции
K
равновесияпоказывает глубину протекания процесса
Химическое и фазовое равновесие
Слайд 40Следует различать истинное равновесие и мнимое или кажущееся, которое называют еще
заторможенным равновесием
или метастабильным состоянием
Условия истинного равновесия:
при сохранении внешних
условий состояние системы не меняется во времени;при изменении условий (введение дополнительных количеств реагирующих веществ, изменение давления или температуры) система приходит к новому состоянию равновесия;
к состоянию равновесия можно подойти с противоположных сторон
Химическое и фазовое равновесие
Слайд 41(с учетом ΔGo=ΔHo-TΔSo)
к уменьшению K для экзотермических реакций
к увеличению K
для эндотермических реакций
Повышение температуры приводит
Изменение активности компонентов реакции и давления
влияют не на величину K, которая постоянна, а на положение равновесия (степень превращения реагентов) и это влияние регламентирует Если на систему, находящуюся в равновесии, оказывать внешнее воздействие,
то в результате протекающих в ней процессов
положение равновесия смещается в сторону,
ослабляющую это воздействие
Принцип подвижного равновесия Ле Шателье
K – зависит от температуры
Химическое и фазовое равновесие
Слайд 44Фазовые диаграммы
От химического индивида к фазе
Клод Луи Бертолле
Джон Дальтон
Герман Минковский
Джозайя
Уиллард Гиббс
Фаза - однородная по составу и свойствам часть системы,
отделенная от других частей поверхностью раздела, на которой скачком изменяются свойства системы
Наличие единого уравнения состояния -
необходимый признак отдельной фазы
Анри Луи Ле Шателье
Николай Семёнович
Курнаков
Физико-химический анализ -
экспериментальный инструмент построения геометрической или аналитической модели
функции состояния системы
Дж. У. Грейг
Р. Рой
А. Муан
Р. Кан
Н. А. Торопов
Ф. Я. Галахов
В. Юм-Розери
СОСТАВ – СВОЙСТВО
Хенрик Розебом
Якоб Вант-Гофф
Д.П. Коновалов
Слайд 45Фазовое равновесие
Равновесие, при котором происходят процессы перехода вещества из одной
фазы в другую без изменения химического состава - фазовое равновесие
Твердое
веществоЖидкость
плавление
кристаллизация
Жидкость
Пар
испарение
конденсация
Твердое вещество (I)
Твердое вещество (II)
полиморфный переход
(I)→(II)
полиморфный переход
(II)→(I)
Условием фазового равновесия является
равенство энергии Гиббса нулю ΔG=0
Для фазового равновесия соблюдается принцип Ле Шателье
Слайд 46Фазовое равновесие
Выбор параметров, влияющих на равновесие гетерогенной системы и условие
равновесия определяется ПРАВИЛОМ ФАЗ
Правило фаз Гиббса
Это наиболее общий закон гетерогенного
химического и фазового равновесияЧисло степеней свободы в гетерогенной системе равно числу компонентов, плюс число внешних условий и минус число фаз
где С – число степеней свободы;
К – число компонентов;
Ф – число фаз
С=K+n-Ф
Число степеней свободы – число независимых параметров состояния системы, которые можно изменять независимо друг от друга
Фаза – вещество или раствор, все составные части которого описываются одним и тем же уравнением состояния
Компоненты – вещества, которые необходимы и достаточны для определения состава и свойств любых фаз системы
Слайд 47Физико-химический анализ
ФИЗИКО-ХИМИЧЕСКИЙ АНАЛИЗ изучает зависимости
между составом и свойствами макроскопических систем,
составленных из нескольких исходных веществ (компонентов), представляя эти зависимости графически, в
виде диаграммы состав-свойствоПринцип соответствия. Каждой совокупности фаз, находящихся в данной системе в равновесии в соответствии с правилом фаз, на диаграмме отвечает определенный геометрический образ
Основные принципы физико-химического анализа
(Н.С. Курнаков)
Принцип непрерывности. При непрерывном изменении параметров, определяющих состояние системы, свойства отдельных ее фаз изменяются непрерывно. Свойства системы в целом изменяются также непрерывно, но при условии, что не возникают новые фазы и не исчезают старые; если же число фаз меняется, то изменяются и свойства системы, причем, как правило, скачкообразно
Принцип совместимости. Любой набор компонентов, независимо от их числа и физико-химических свойств, может составить систему. Диаграмма состояния любой общей системы содержит все элементы диаграммы состояния частных систем
(Я.Г. Горощенко)
Слайд 48Преимущество физико-химического анализа как метода исследования заключается в том, что он не
требует выделения продукта химического взаимодействия компонентов из реакционной смеси, вследствие чего метод позволяет
исследовать химические превращения в растворах, смесях любой природы, стеклах и т. п. объектах, которые практически невозможно исследовать с применением классических препаративно-синтетических методовФазовая диаграмма (диаграмма состояния) - диаграмма, по которой можно определить условия устойчивости фаз и фазового равновесия
Физико-химический анализ
Слайд 50 Термодинамические основы
T
G
T0
T=T0
A
Δx
Δx
ΔG
ΔG
Устойчивое состояние
Метастабильное состояние
Лабильное состояние
B
Фазовые диаграммы
Слайд 51 Однокомпонентные системы
1 – кривая кипения (испарения)
2 – кривая плавления (кристаллизации)
3 – кривая возгонки (сублимации)
К – критическая точка
А – тройная точка
газ
жидкость
твердое
1
2
3
P
T
A
K
P2
P1
Правило фаз Гиббса
s=k+n-f
s
– число степеней свободыf – число фаз
k – число компонентов системы
n – число переменных, характеризующих влияние внешних условий на равновесие системы (P, T)
СКФ
Фазовые диаграммы
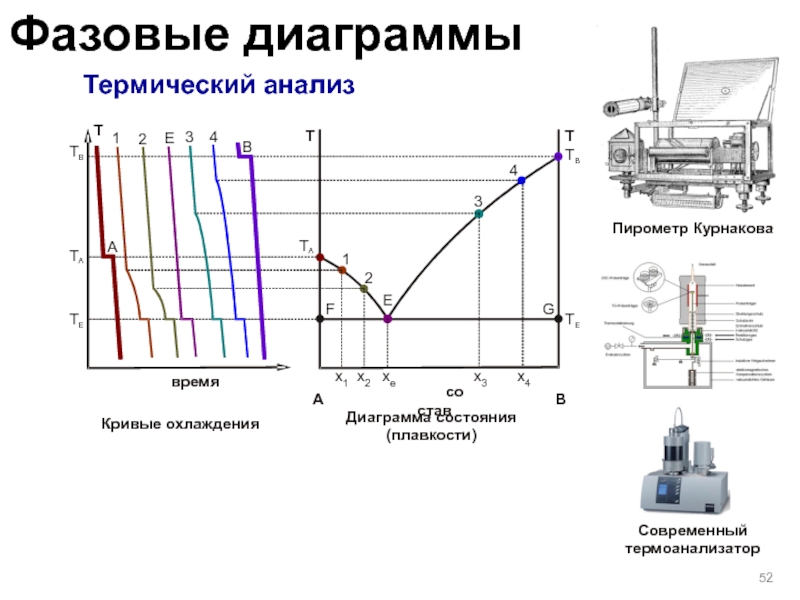
Слайд 52 Термический анализ
Фазовые диаграммы
Т
Е
Т
А
Т
В
Т
А
В
время
Т
А
Т
В
Т
Т
Т
Е
1
2
Е
3
4
А
F
G
1
2
Е
3
4
Кривые охлаждения
Диаграмма состояния (плавкости)
Пирометр Курнакова
Современный термоанализатор
состав
B
х1
х2
х3
хe
х4
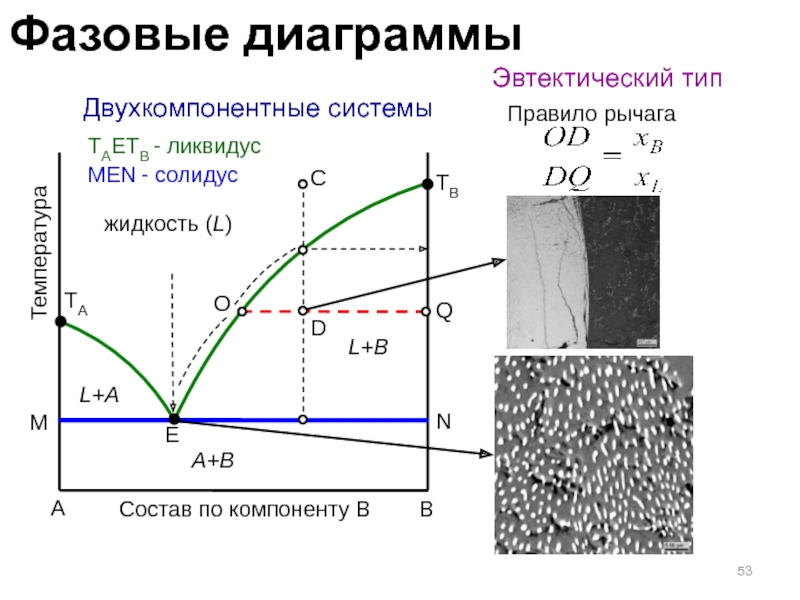
Слайд 53 Двухкомпонентные системы
Эвтектический тип
A
B
Состав по компоненту B
Температура
TA
TB
жидкость (L)
L+A
A+B
E
L+B
N
M
Q
O
C
D
Правило рычага
TAETB -
ликвидус
МEN - солидус
Фазовые диаграммы
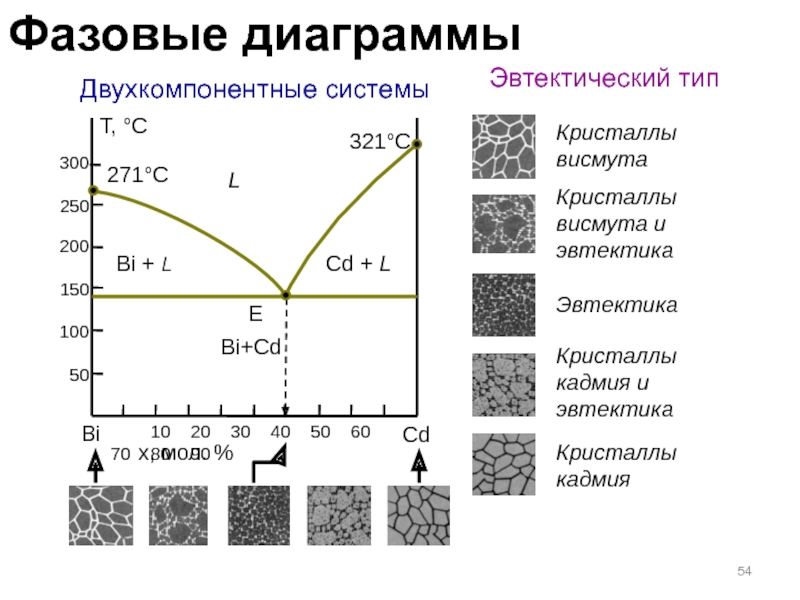
Слайд 54 Двухкомпонентные системы
Эвтектический тип
Bi
Cd
x, мол. %
Т, °С
271°C
L
Bi + L
E
321°C
10 20 30 40 50 60 70 80 90
50
100
150
200
250
300
Bi+Cd
Cd + L
Кристаллы
висмута
Кристаллы висмута и эвтектика
Эвтектика
Кристаллы кадмия и эвтектика
Кристаллы кадмия
Фазовые диаграммы
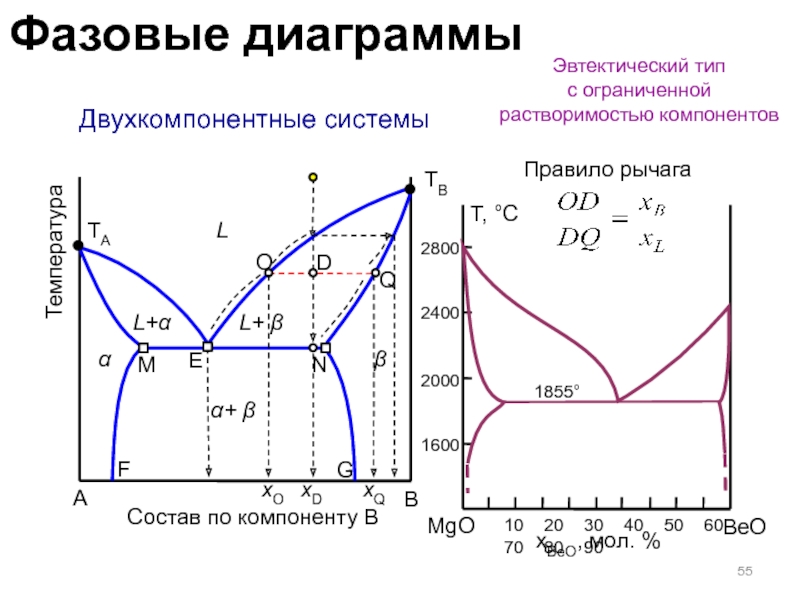
Слайд 55 Двухкомпонентные системы
Эвтектический тип
с ограниченной растворимостью компонентов
A
B
Состав по компоненту B
Температура
TA
TB
L
L+α
E
L+ β
F
N
α
M
G
α+
β
β
D
O
Q
xO
xD
xQ
Правило рычага
MgO
BeO
xBeO, мол. %
Т, °С
10 20 30 40 50 60 70 80 90
1600
2000
2400
2800
1855°
Фазовые диаграммы
Слайд 56 Двухкомпонентные системы
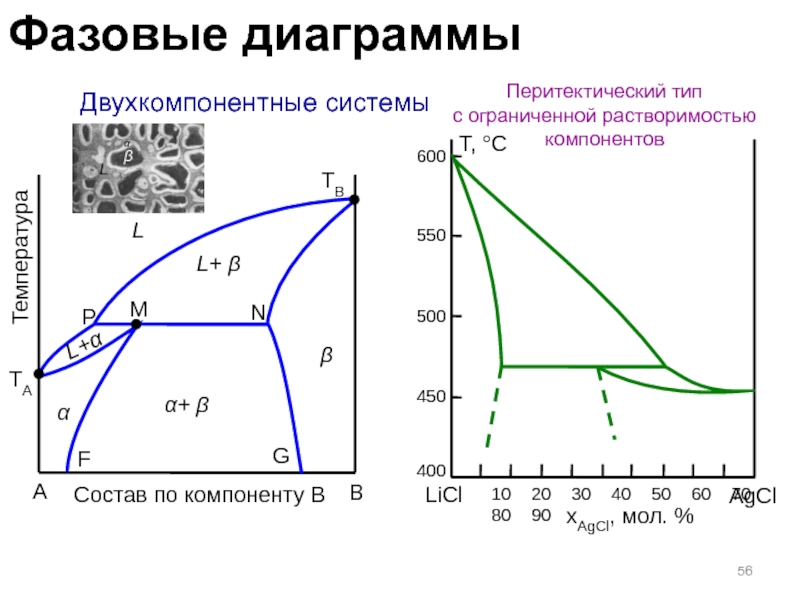
Перитектический тип
с ограниченной растворимостью компонентов
A
B
Температура
TA
TB
L
L+α
L+ β
F
N
α
M
G
α+ β
β
P
Состав по
компоненту B
Фазовые диаграммы
β
α
L
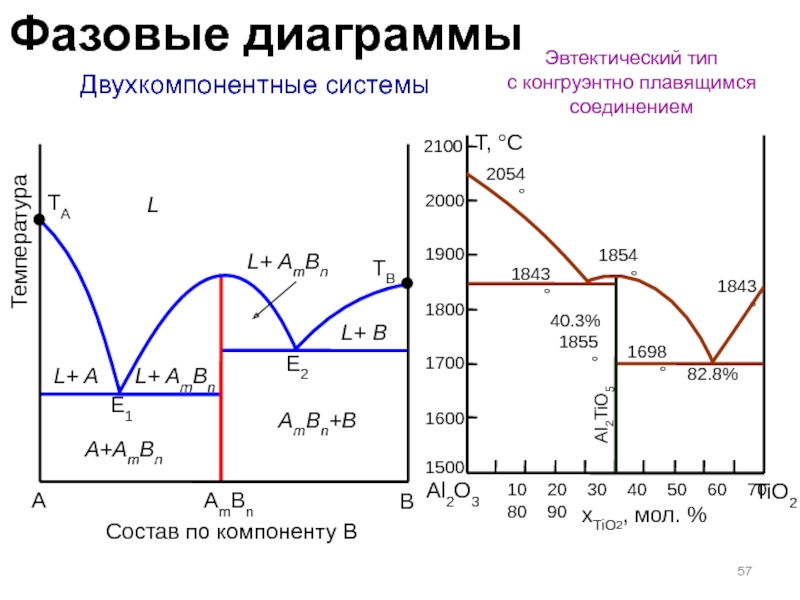
Слайд 57 Двухкомпонентные системы
Эвтектический тип
с конгруэнтно плавящимся соединением
A
B
Состав по компоненту B
Температура
TA
L
L+
A
TB
E1
E2
AmBn
L+ AmBn
L+ AmBn
L+ B
AmBn+B
A+AmBn
Фазовые диаграммы
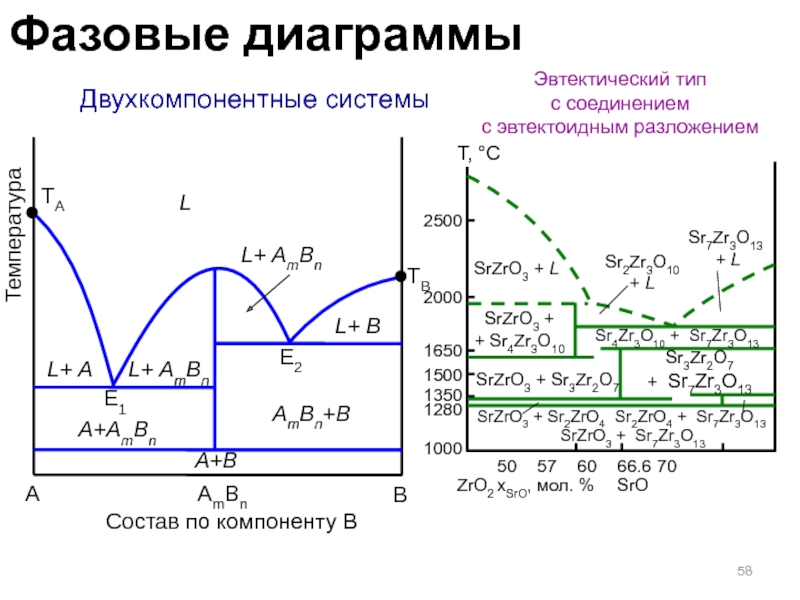
Слайд 58 Двухкомпонентные системы
Эвтектический тип
с соединением
с эвтектоидным разложением
A
B
Температура
TA
L
L+ A
TB
E1
E2
AmBn
L+ AmBn
L+ AmBn
L+ B
AmBn+B
A+AmBn
A+B
Sr2Zr3O10
+ L
SrZrO3 + L
Sr7Zr3O13 + L
SrZrO3 +
+ Sr4Zr3O10
SrZrO3 + Sr3Zr2O7
Sr4Zr3O10 +
Sr7Zr3O13
Sr3Zr2O7
+ Sr7Zr3O13
Sr2ZrO4 + Sr7Zr3O13
SrZrO3 + Sr2ZrO4
SrZrO3 + Sr7Zr3O13
50 57 60 66.6 70
ZrO2 xSrO, мол. % SrO
2500
2000
1650
1500
1350
1280
1000
Состав по компоненту B
Т, °С
Фазовые диаграммы
Слайд 59 Двухкомпонентные системы
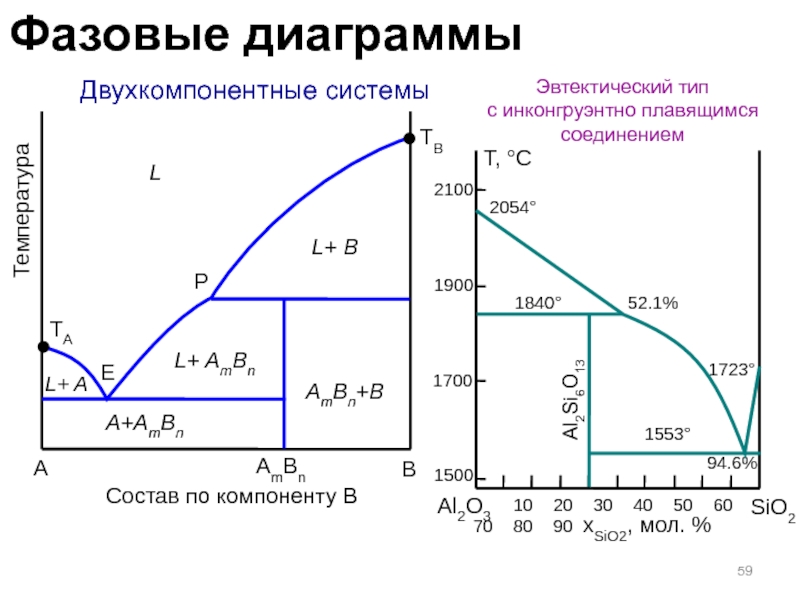
Эвтектический тип
с инконгруэнтно плавящимся соединением
A
B
Температура
TA
L
L+ A
TB
E
AmBn
L+ AmBn
L+ B
AmBn+B
A+AmBn
P
Состав по
компоненту B
Al2Si6O13
Фазовые диаграммы
Слайд 60 Двухкомпонентные системы
Эвтектический тип
с полиморфными переходами и ограниченной растворимостью компонентов
A
B
Температура
TA
TB
L
α1+B
L+B
α2+B
α2
α1
α2+L
А+B
Состав по
компоненту B
α1
+ α2
Фазовые диаграммы
Слайд 61 Двухкомпонентные системы
Типа «рыбка» с неограниченной растворимостью компонентов
A
B
Температура
L
M
TB
A1-xBx
L+A1-xBx
MgO
FeO
xFeO, мол. %
Т, °С
10 20 30 40 50 60 70 80 90
1200
1600
2000
2800
2400
2825°C
1371°C
Состав
по компоненту B
TA
Q
O
D
Фазовые диаграммы
Слайд 62 Двухкомпонентные системы
Типа «рыбка»
с расслаиванием в твердой фазе
A
B
Температура
TA
L
A1-xBx
L+A1-xBx
S1+S2
Состав по компоненту B
Q
O
D
TB
Фазовые
диаграммы
Слайд 63www.chemdm.ru
Двухкомпонентные системы
С экстремумом
на кривых
солидуса и ликвидуса
A
B
Температура
TA
L
TB
A1-xBx
S1+S2
A
B
Температура
TA
L
A1-xBx
Состав по компоненту B
Состав по
компоненту B
TB
V
Фазовые диаграммы
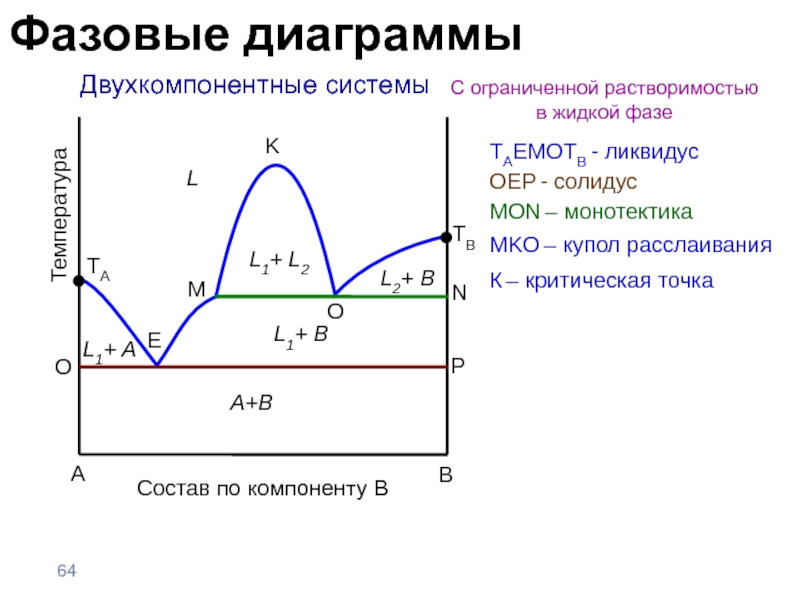
Слайд 64 Двухкомпонентные системы
С ограниченной растворимостью
в жидкой фазе
A
B
Температура
TA
L
L1+ A
TB
L1+ B
L1+ L2
L2+ B
A+B
Состав
по компоненту B
М
N
O
E
O
P
TAEMOTB - ликвидус
OEP - солидус
K
MON – монотектика
MKO
– купол расслаивания К – критическая точка
Фазовые диаграммы
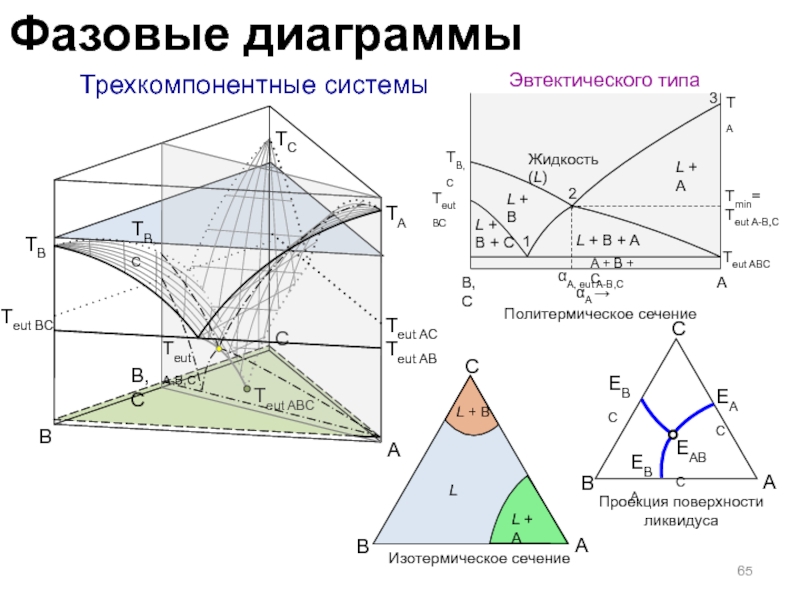
Слайд 65 Трехкомпонентные системы
Эвтектического типа
B
A
C
B,C
Teut ABC
Teut AB
Teut AC
Teut BC
TA
TC
TB
TB,С
Teut A-B,C
ТA
B,С
αA
A
ТB,С
Жидкость (L)
Teut
ABС
A + B + C
L + A
L + B
Teut BC
L
+ B + C
L + B + A
Tmin=
Teut A-B,С
αA, eut A-B,C
1
2
3
Политермическое сечение
B
A
C
Проекция поверхности ликвидуса
EABC
EBC
EAC
EBA
Фазовые диаграммы
Слайд 66 Системы высшего порядка
Ура! Я, наконец-то понял, как выглядит
диаграмма состояния четырехкомпонентной
системы в семимерном пространстве!!!
Не плоди лишних сущностей…
Фазовые диаграммы
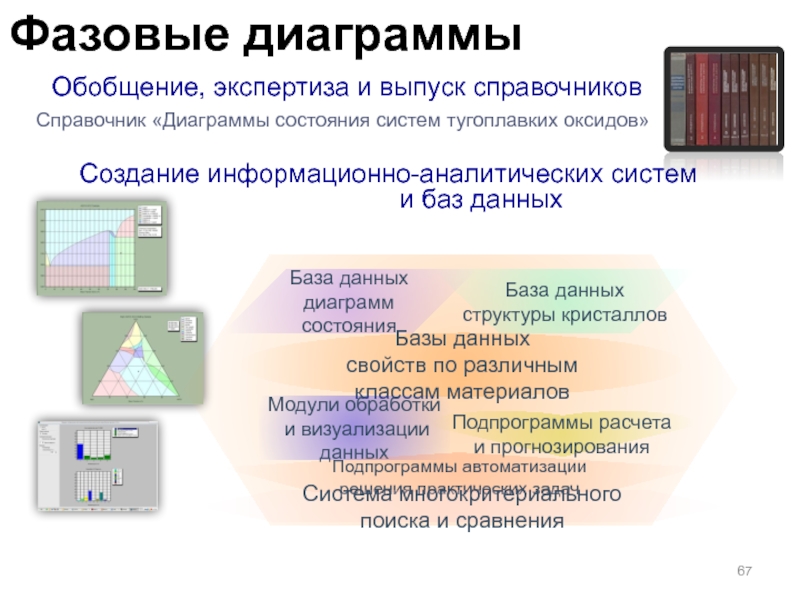
Слайд 67 Обобщение, экспертиза и выпуск справочников
Справочник «Диаграммы состояния систем тугоплавких
оксидов»
Создание информационно-аналитических систем
и баз данных
База данных
структуры кристаллов
База данных
диаграмм состояния
Базы
данныхсвойств по различным классам материалов
Модули обработки
и визуализации данных
Подпрограммы расчета
и прогнозирования
Подпрограммы автоматизации решения практических задач
Система многокритериального поиска и сравнения
Фазовые диаграммы
Слайд 68 Диаграмма плавкости железо-углерод
600
800
1000
1200
1400
1600
0.002
0.8
2.14
4.3
6.67
Температура
Аустенит
Аустенит
Жидкость
Жидкость
Первичный цементит
Первичный цементит
Ледебурит
Первичный цементит
Ледебурит
Аустенит
Ледебурит
Ледебурит
Ледебурит
Ледебурит
Вторичный цементит
Вторичный цементит
Перлит
Перлит
Перлит
Феррит
Электромагнит
Пружины
Шестерни
Инструмент
Валки
Для
литья
Переработка в сталь
α-Fe
β-Fe
γ-Fe
δ-Fe
+
Жидкость
Содержание углерода, %
Фазовые диаграммы
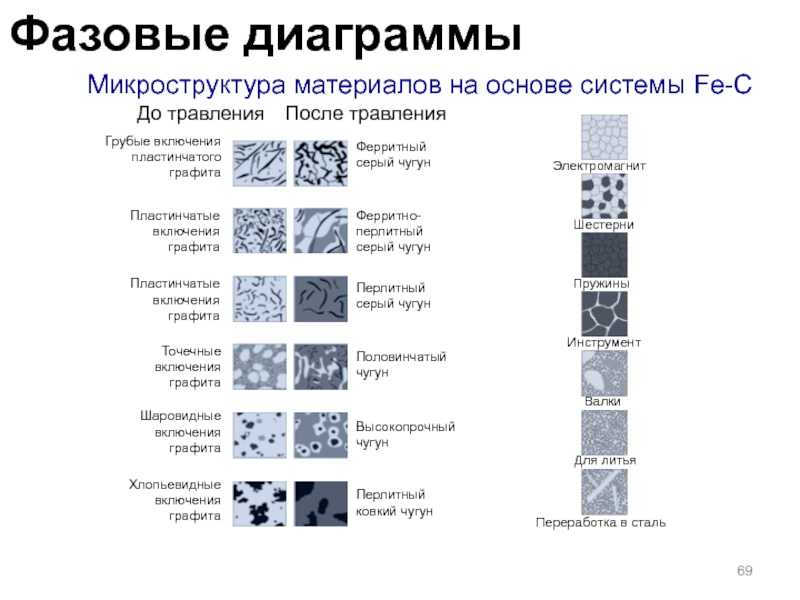
Слайд 69 Микроструктура материалов на основе системы Fe-C
Электромагнит
Пружины
Шестерни
Инструмент
Валки
Для литья
Переработка в сталь
До
травления
Ферритный серый чугун
Ферритно-перлитный серый чугун
Перлитный серый чугун
Половинчатый чугун
Грубые включения пластинчатого
графитаТочечные включения графита
Высокопрочный чугун
Перлитный ковкий чугун
Шаровидные включения графита
Хлопьевидные включения графита
Пластинчатые включения графита
Пластинчатые включения графита
После травления
Фазовые диаграммы