Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Кафедра химии и материаловедения
Содержание
- 1. Кафедра химии и материаловедения
- 2. Лекция
- 3. Учебные вопросы:1. Электронная структура атомов.2. Периодический закон и периодическая система элементов Д. И. Менделеева3. Химическая связь
- 4. Литература: 1. Ахметов Н.С. Общая и
- 5. Постулаты Бора1.Электрон может вращаться не по произвольным,
- 6. 2. При движении по стационарным орбитам электрон
- 7. Квантовая модель строения атома1. Электрон имеет двойственную
- 8. 2. Принцип неопределенности ГейзенбергаДля электрона невозможно одновременно
- 9. 3. Электрон в атоме не движется по
- 10. 4. Ядра атомов состоят из протонов и
- 11. Совокупность сложных движений электрона описывается 4-мя квантовыми
- 12. n – главное квантовое число определяет общую
- 13. m – магнитное квантовое число характеризует ориентацию
- 14. Состояние электронов в атоме можно описать с
- 15. Принцип Паули
- 16. Правило Гунда При данном значении l (в
- 17. 1s22s22p3N – имеет 7e – m=0l=0m=+1m=0m=-1l=1m=+2m=+1m=0m=-1m=-2m=+3m=+2m=+1m=0m=-1m=-2m=-3l=2l=3
- 18. Правило В.М. КлечковскогоВ первую очередь заполняются те
- 19. ЭЛЕКТРОННЫЕ СЛОИK, L, M, NЭНЕРГЕТИЧЕСКИЙ УРОВЕНЬ=ОБОЛОЧКА (n)подуровеньподуровеньs,
- 20. РАСПРЕДЕЛЕНИЕ ПО УРОВНЯМОболочкаКУровень nПод-уровень ОрбитальВсего орбитальn2LMN1234OSOS1pOS1p2dOS1p2d3f00-1 0
- 21. Периодический закон Д.И Менделеева (классическая формулировка)Свойства простых
- 22. Закон МозлиПри переходе от одного элемента периодической
- 23. Периодический закон (современная трактовка) Свойства простых веществ,
- 24. Номер периода соответствует номеру внешнего энергетического уровня
- 25. Периодичность изменения свойств элементов с увеличением порядкового
- 26. Потенциал ионизации (I) – энергия, необходимая
- 27. Сродство к электрону (Е)энергия, которая выделяется при
- 28. Электроотрицательность (ЭО) – способность атома притягивать
- 29. 3 уч.в. Правило образования химической
- 30. Химическая связь – взаимодействие атомов, обусловленное перекрыванием
- 31. Типы химической связи1. ковалентная;
- 32. Ковалентная связьДля объяснения природы ковалентной связи и
- 33. Метод ВС Существуют 2 принципиальных механизма образования
- 34. Если ЭО атомов одинаковы, то возникает неполярная
- 35. Основные характеристики связи Длина химической связи –
- 36. При донорно-акцепторном механизме образования связи один атом
- 37. В а л е н т н
- 38. Число неспаренных электронов атома, принимающих участие в
- 39. Насыщаемость – способность атомов участвовать в образовании
- 40. Ковалентная связь – это связь, осуществляемая за
- 41. При донорно-акцепторном механизме образования связи один атом
- 42. ВОЗНИКНОВЕНИЕ СВЯЗИn = 2n = 1SSSSPN3HN
- 43. Метод молекулярных орбиталей (МО) Согласно методу МО
- 44. В соответствии с ЛКАО, любая МО представляется
- 45. Условия образования МО из АОЧисло образующихся МО
- 46. Ионная хим. связь это предельный случай полярности
- 47. Ионная связьЭлектростатическое взаимодействиеДисперсионное - притяжениеОриентационное – диполь-дипольноеИндукционное
- 48. Ионная связь – это связь, которая образуется
- 49. Металлическая связь это связь между положительными ионами
- 50. Межмолекулярные взаимодействияВодородная связь – это связь между
- 51. Вандерваальсова связь – связь, возникающая между молекулами за счет индукционных сил притяженияпри «согласованном движении» электронов.
- 52. Скачать презентанцию
Слайды и текст этой презентации
Слайд 1Кафедра химии и материаловедения
Дисциплина «Химия»
Лектор: доцент, кандидат химических наук
Андреева Лариса
Николаевна
Слайд 2 Лекция № 1
Тема №
1. Строение атома и современные представления о химическом элементе. Периодическая система элементов Д. И. МенделееваСлайд 3Учебные вопросы:
1. Электронная структура атомов.
2. Периодический закон и периодическая система
элементов Д. И. Менделеева
3. Химическая связь
Слайд 4Литература:
1. Ахметов Н.С. Общая и неорганическая химия. М. 2009, с.6-111.
Инв. №1976у
2. Козловская Э.Б., Крюкова Л.Ю. Общая химия. Химки, 2009,
с.4-20Слайд 5Постулаты Бора
1.Электрон может вращаться не по произвольным, а только по
строго определенным (стационарным) круговым орбитам
Квантовое соотношение Бора:
mvr = nhm – масса электрона;n – номер орбиты;
h – постоянная Планка (h= 1,05.10-34 Дж.с);
r – радиус орбиты;v – скорость электрона.
Слайд 62. При движении по стационарным орбитам электрон не поглощает и
не излучает энергии.
Излучение или поглощение энергии (∆Е) определяется переходом электрона
с одной стационарной орбиты на другую:∆Е = Е2 - Е1 = hν
где ν – частота излучения
Слайд 7Квантовая модель строения атома
1. Электрон имеет двойственную корпускулярно-волновую природу. Длина
волны электрона (λ) и его скорость (v) связаны соотношением
де
Бройля: λ= h / mvСлайд 82. Принцип неопределенности Гейзенберга
Для электрона невозможно одновременно точно измерить координату
и скорость:
∆х
m ∆v > h/2∆х – неопределенность положения координаты
∆v – погрешность измерения скорости
Слайд 93. Электрон в атоме не движется по определенным траекториям, а
может находиться в любой точке околоядерного пространства. Пространство вокруг ядра,
в котором вероятность нахождения электрона достаточно велика, называют орбиталью.Слайд 104. Ядра атомов состоят из протонов и нейтронов (нуклонов). Число
протонов в ядре равно порядковому номеру элемента, а сумма чисел
протонов и нейтронов соответствует его массовому числу.А = Z + N
A – массовое число
Z – заряд ядра
N – число нейтронов в ядре
Слайд 11Совокупность сложных движений электрона описывается 4-мя квантовыми числами:
n,
l,
m, msглавное побочное магнитное спиновое
Слайд 12n – главное квантовое число определяет общую энергию электрона на
данной орбитали и равно № периода.
n = 1, 2, 3…l – побочное (орбитальное) квантовое число
l = 0, 1, 2…(n-1)
l = 0 1 2 3 4 определяет
s p d f g… форму орбитали
Слайд 13m – магнитное квантовое число характеризует ориентацию орбитали в пространстве
-l ≤ m ≤ +l всего (2l+1) значений
ms-
спиновое число, которое характеризует собственный момент количества движения электрона ms= ± ½
Слайд 14Состояние электронов в атоме можно описать с помощью 4-х квантовых
чисел и 3-х основных положений:
Принцип Паули
Правило Гунда
Принцип наименьшей энергии
(правило В.М. Клечковского)Слайд 15 Принцип Паули В атоме не может быть 2-х
электронов, обладающих одинаковым набором 4-х квантовых чисел. Максимальное число электронов с
одинаковым главным квантовым числом равно N=2n2Слайд 16Правило Гунда
При данном значении l
(в пределах одного подуровня) электроны
располагаются таким образом, чтобы суммарный спин был максимален.
Слайд 171s22s22p3
N – имеет 7e –
m=0
l=0
m=+1
m=0
m=-1
l=1
m=+2
m=+1
m=0
m=-1
m=-2
m=+3
m=+2
m=+1
m=0
m=-1
m=-2
m=-3
l=2
l=3
Слайд 18Правило В.М. Клечковского
В первую очередь заполняются те подуровни, для которых
сумма значений (n+l) является минимальной.
При равной сумме (n+l) заполнение в
порядке возрастания числа n4s n + l = 4 + 0 = 4
3d n + l = 3 + 2 = 5 4s 3d 4p
4p n + l = 4+ 1 = 5
Слайд 19ЭЛЕКТРОННЫЕ СЛОИ
K, L, M, N
ЭНЕРГЕТИЧЕСКИЙ
УРОВЕНЬ=ОБОЛОЧКА (n)
подуровень
подуровень
s, p, d, f
S
P
ПОСЛЕДОВАТЕЛЬНОСТЬ
ЗАПОЛНЕНИЯ УРОВНЕЙ
11N21s22s22p63s1
1sP1s22s22p63s23p3
3sKr1s22s22p63s23p64s23d104p6
max число
электронов
2
6
10
14
1
2
3
ПОСЛЕДОВАТЕЛЬНОСТЬ
4
5
6
7
8
9
2 p
3 p
4 p
5 p
6 p
7 p
1 s
2
s3 s
4 s
5 s
6 s
7 s
3 d
4 d
5 d
6 d
7 d
4 f
5 f
6 f
Слайд 20РАСПРЕДЕЛЕНИЕ ПО УРОВНЯМ
Оболочка
К
Уровень
n
Под-уровень
Орбиталь
Всего орбиталь
n2
L
M
N
1
2
3
4
OS
OS
1p
OS
1p
2d
OS
1p
2d
3f
0
0
-1 0 +1
0
-1 0 +1
-2
-1 0 +1 +2
0
-1 0 +1
-2 -1 0 +1 +2
-3
-2 -1 0 +1 +2 +31
1
3
1
3 9
9
1
3
5
7
2
2
6
2
6 18
10
2
6
10
14
2
8
18
32
Электрон на подуровне
Всего электронов
2n2
4
8
16
32
Слайд 21Периодический закон Д.И Менделеева
(классическая формулировка)
Свойства простых тел, а также формы
и свойства соединений элементов находятся в периодической зависимости от атомных
масс элементов (1869г).Слайд 22Закон Мозли
При переходе от одного элемента периодической системы к другому
величина заряда ядра атома меняется на 1.
Слайд 23Периодический закон
(современная трактовка)
Свойства простых веществ, а также формы и свойства
соединений элементов находятся в периодической зависимости от величины заряда ядра
атома (порядкового номера)Слайд 24Номер периода соответствует номеру внешнего энергетического уровня атома элемента.
Номер группы
– соответствует числу электронов на внешнем энергетическом уровне атома элемента.
Слайд 25Периодичность изменения свойств элементов с увеличением порядкового номера объясняется периодическим
изменением числа электронов на их внешнем энергетическом уровне.
Слайд 26Потенциал ионизации (I) –
энергия, необходимая для отрыва наиболее слабо
связанного электрона от атома:
Х → Х+ + е-Наименьшие значения I - у щелочных металлов.
Наибольшие значения I - у инертных газов.
Слайд 27Сродство к электрону (Е)
энергия, которая выделяется при присоединении электрона к
атому:
Х + е- → Х-
Наименьшие значения Е
– у галогеновНаибольшие значения Е – у металлов
Слайд 28Электроотрицательность (ЭО) –
способность атома притягивать к себе валентные электроны
других атомов.
Li Be B H C
N Cl O F1,0 1,6 2,0 2,1 2,5 3,0 3,2 3,5 4,0
Слайд 293 уч.в. Правило образования
химической связи:
при образовании молекулы атомы
стремятся приобрести устойчивую восьми электронную оболочку (октет) или двух электронную
оболочку (дублет).Слайд 30Химическая связь – взаимодействие атомов, обусловленное перекрыванием их электронных облаков
и сопровождающееся уменьшением полной энергии системы:
А + В→ АВОсновное условие образования химической связи:
ЕАВ < ЕА + ЕВ
Слайд 31Типы химической связи
1. ковалентная;
образование
2. ионная;
молекул 3. металлическая;
4. водородная; межмолекул.
5. вандерваальсова взаим-я
Слайд 32Ковалентная связь
Для объяснения природы ковалентной связи и механизма ее образования
используют 2 основные теории:
- метод валентных связей (ВС);
-
метод молекулярных орбиталей (МО).Слайд 33Метод ВС
Существуют 2 принципиальных механизма образования ковалентной связи:
обменный;
донорно-акцепторный
При обменном механизме
ковалентная связь возникает при обобщении электронов, принадлежащих двум атомам.Слайд 34Если ЭО атомов одинаковы, то возникает неполярная связь (1), если
ЭО атомов различны, то возникает полярная связь (2):
Х=ЭО при ХА
= ХВ → А : В (1)при ХА > ХВ → А :В (2)
Слайд 35Основные характеристики связи
Длина химической связи –
межъядерное расстояние между химически
связанными атомами.
Валентный угол – угол между воображаемыми прямыми, проходящими через
ядра химически связанных атомов.Энергия связи – энергия, затрачиваемая на разрыв связи
Есвязи = 464 кДж/моль
Слайд 36При донорно-акцепторном механизме образования связи один атом (донор) предоставляет электронную
пару для образования связи, другой атом (акцептор) – участвует в
обобществлении электронной пары за счет свободной орбитали.Слайд 37В а л е н т н о с т
ь – число ковалентных связей, образованных данным атомом, или число
орбиталей, используемых атомом для образования связей.Свойства 1. Направленность
ковалентной 2. Насыщенность
связи 3.Поляризуемость
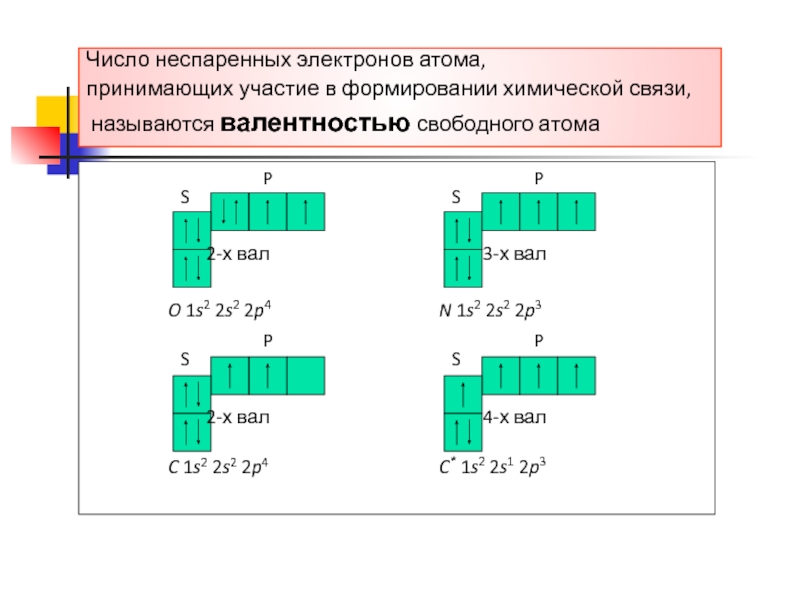
Слайд 38Число неспаренных электронов атома,
принимающих участие в формировании химической связи,
называются валентностью свободного атома
S
P
P
P
P
S
S
S
O 1s2 2s2 2p4
C 1s2 2s2 2p4
N
1s2 2s2 2p3C* 1s2 2s1 2p3
2-х вал
2-х вал
3-х вал
4-х вал
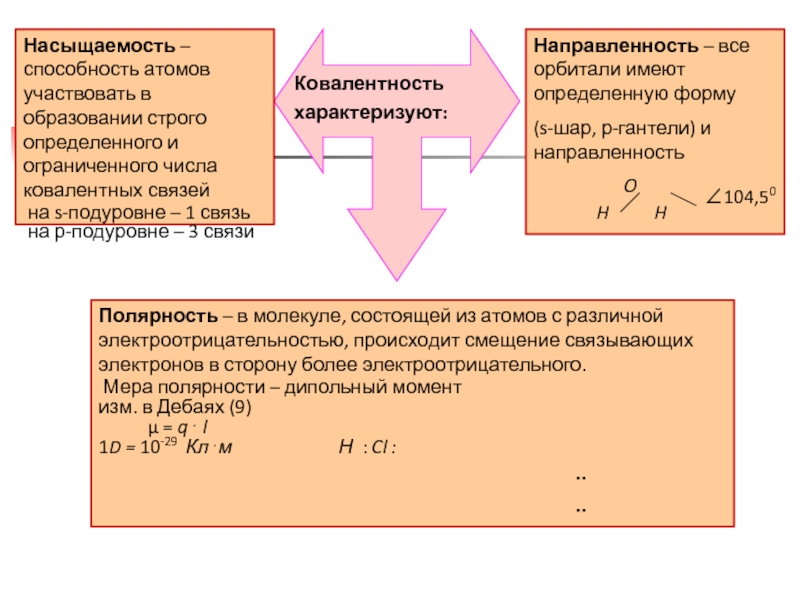
Слайд 39Насыщаемость – способность атомов участвовать в образовании строго определенного и
ограниченного числа ковалентных связей
на s-подуровне – 1 связь
на
р-подуровне – 3 связи Направленность – все орбитали имеют определенную форму
(s-шар, р-гантели) и направленность
O
H H
104,50
Полярность – в молекуле, состоящей из атомов с различной электроотрицательностью, происходит смещение связывающих электронов в сторону более электроотрицательного.
Мера полярности – дипольный момент
изм. в Дебаях (9)
= q l
1D = 10-29 Клм Н : Cl :
Ковалентность
характеризуют:
:
:
Слайд 40Ковалентная связь – это связь, осуществляемая за счет образования электронных
пар, в одинаковой мере принадлежащих обоим атомам.
Слайд 41При донорно-акцепторном механизме образования связи один атом (донор) предоставляет электронную
пару для образования связи, другой атом (акцептор) – участвует в
обобществлении электронной пары за счет свободной орбитали.Слайд 42ВОЗНИКНОВЕНИЕ СВЯЗИ
n = 2
n = 1
S
S
S
S
P
N
3H
N + 3
H N H
H
H
Образование
координационной
связи
(донорно-акцепторная)
H N + H+ H N H
H
H
H
H
+
H H F F N N Число пар = числу орбиталей
S
Р
Р
Слайд 43Метод молекулярных орбиталей (МО)
Согласно методу МО молекула рассматривается как совокупность
ядер и электронов, где каждый электрон движется в поле остальных
электронов и всех ядер.Один из методов описания МО – метод линейной комбинации атомных орбиталей (ЛКАО).
Слайд 44В соответствии с ЛКАО, любая МО представляется как результат сложения
и вычитания волновых функций ψ, характеризующих атомные орбитали (АО).
АВ
ψ+АВ= ψАС1+ ψВС2 связывающие МОψ-АВ= ψАС3- ψВС4 разрыхляющие МО
С1, С2, С3, С4 – пост. коэфф-ты, характеризующие участие АО в обр. МО
Слайд 45Условия образования МО из АО
Число образующихся МО д.б. равно числу
исходных АО.
АО д.б. достаточно протяженными в пространстве, чтобы перекрываться в
заметной степени.АО, образующие молекулярную орбиталь (МО), должны иметь близкие значения энергии.
Взаимодействие АО должно иметь одинаковую симметрию относительно линии связи в молекуле.
Слайд 46Ионная хим. связь
это предельный случай полярности ковалентной химической связи,
которому отвечает значительное смещение электронной пары к наиболее электроотрицательному элементу
(ΔЭО>1,7).Этот атом приобретает отрицательный заряд и превращается в анион. Другой атом, лишившийся своего электрона, превращается в катион.
Слайд 47Ионная
связь
Электростатическое взаимодействие
Дисперсионное - притяжение
Ориентационное – диполь-дипольное
Индукционное –поляризация (индукция)
Ван-Дер-Ваальсово взаимодействие
Без
передачи е־
Ослабевает пропорционально межцентровому расстоянию в 6 степени
Образуется щелочной металл
+ Hal ( Э 1,9)Валентность
Отдача е-
Принятие е-
+
–
Нет насыщенности
Нет направленности
¾ всех элементов – металлы
Электропроводны; теплопроводны; пластичны
Имеют вакантные орбитали
Электроны слабо связаны
На каждый действуют поля ионов и электронов электронный газ (1см3 1022 е–)
Слайд 48Ионная связь – это связь, которая образуется между катионом и
анионом в результате их электростатического взаимодействия.
Ионная связь не обладает:
а)
насыщаемостью;б) направленностью;
в) к ней не применимо понятие валентности.
Слайд 49Металлическая связь
это связь между положительными ионами в кристаллах металлов,
осуществляемая за счет притяжения электронов, свободно перемещающихся по кристаллу.
Металлическая связь
не имеет направленности в пространстве, так как валентные электроны распределены по кристаллу равномерно.Слайд 50Межмолекулярные взаимодействия
Водородная связь – это связь между положительно заряженным атомом
Н одной молекулы и отрицательно заряженным атомом другой молекулы (связь
имеет частично э/статический, частично дон.-акцепторный характер)Емет.< Еков. или ионн. св.