Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Карбапенемы
Содержание
- 1. Карбапенемы
- 2. В настоящее
- 3. Слайд 3
- 4. Учитывая тяжесть состояния больных
- 5. В течение длительного
- 6. В качестве альтернативы комбинациям цефалоспоринов
- 7. Первый из карбапенемных антибиотиков –
- 8. 20 лет назад в России
- 9. Итогом многих исследований по антибиотикорезистентности явились следующие
- 10. однако это не исключает необходимости микробиологической диагностики
- 11. Устойчивость клинически значимых микроорганизмов к
- 12. Основным критерием роста резистентности микрофлоры,
- 13. Идеальная доза антибиотика должна обеспечивать
- 14. МЕРОПЕНЕМ даже в высоких дозах
- 15. В исследованиях in vitro и
- 16. Рис. 1. %Т>МПК -
- 17. Таким образом, изменение режимов дозирования
- 18. Максимальное значение %Т>МПК может быть
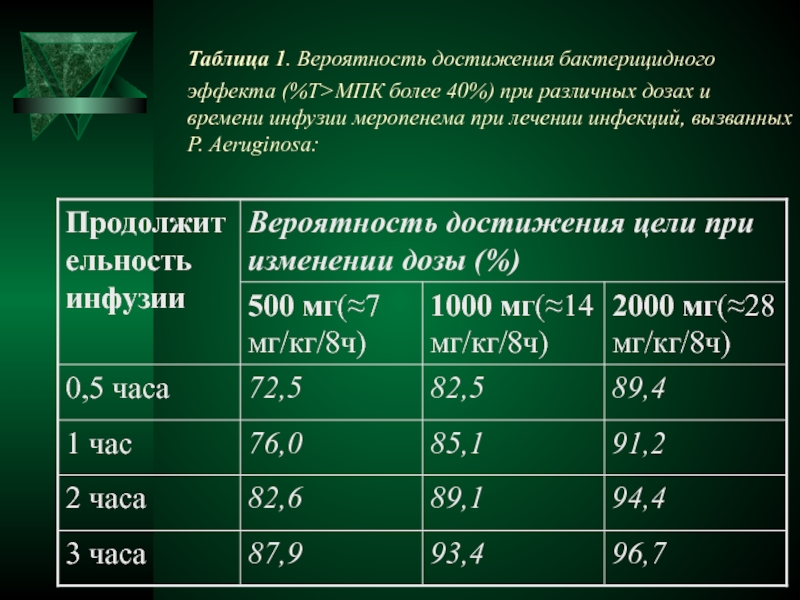
- 19. Таблица 1. Вероятность достижения бактерицидного эффекта (%Т>МПК
- 20. Рис. 2. Вероятность достижения бактерицидного эффекта в отношении P. Аeruginosa
- 21. Постоянная инфузия бета-лактамных антибиотиков применяется
- 22. Этот метод экономичен, быстро обеспечивает
- 23. При наличии наиболее резистентных возбудителей
- 24. Непременным условием успешного долговременного использования
- 25. МЕРОПЕНЕМ эффективен в режиме монотерапии
- 26. В большинстве случаев препарат используется
- 27. 1. При эмпирической терапии: инфекции у больных
- 28. 2. При этиотропной терапии: тяжелые инфекции, вызванные
- 29. Дозирование МЕРОПЕНЕМА: в большинстве случаев
- 30. В отделении недоношенных детей НИИ
- 31. Препарат вводился парентерально из расчета
- 32. Показаниями к назначению МЕРОПЕНЕМА были:
- 33. При проведении бактериологического мониторинга различных
- 34. Клинический эффект при использовании МЕРОПЕНЕМА
- 35. Ни в гемограмме, ни в
- 36. Помимо вышеуказанного, велся пролонгированный мониторинг
- 37. Ни в одном случае не
- 38. Таким образом, использование меропенема в
- 39. В настоящее время актуальным является
- 40. В одном из ретроспективных фармакоэкономических
- 41. Сравнение проводилось методом «затраты–эффективность». Показателем
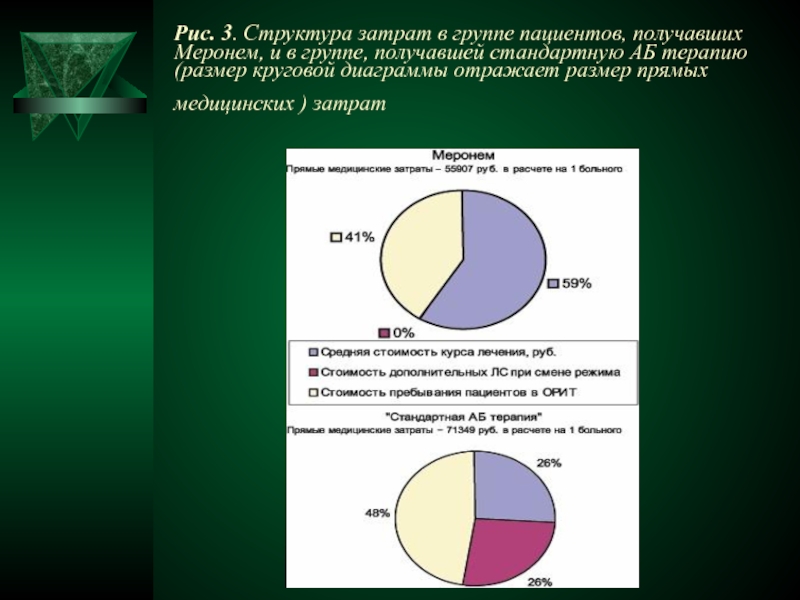
- 42. Общие затраты складывались из стоимости
- 43. Хотя стоимость курса основной АБТ
- 44. стоимость дополнительной АБТ в группе стандартной АБТ
- 45. превышение затрат на пребывание пациентов в ОРИТ
- 46. Таким образом, в группе, получавшей
- 47. Рис. 3. Структура затрат в группе пациентов,
- 48. Рис. 4. Соотношение «затраты–эффективность» при проведении стандартной терапии и с использованием Меронема
- 49. Антибиотикорезистентность — неизбежное
- 50. Растущая резистентность связана не только
- 51. Фармакоэпидемиологические исследования показали, что для
- 52. Это заключается в существенно более
- 53. Почему АМП используют
- 54. Возможным путём решения проблемы резистентности
- 55. Антимикробные препараты — невосстановимые ресурсы.
- 56. БЛАГОДАРЮ ЗА ВНИМАНИЕ!
- 57. Скачать презентанцию
В настоящее время в эпоху глобального роста резистентности госпитальной микрофлоры к АМП проблема нозокомиальной инфекции, особенно, в ОАРИТ, остро стоит перед клиницистами. Эффективное этиотропное лечение нозокомиальных
Слайды и текст этой презентации
Слайд 2 В настоящее время в эпоху
глобального роста резистентности госпитальной микрофлоры к АМП проблема нозокомиальной инфекции,
особенно, в ОАРИТ, остро стоит перед клиницистами. Эффективное этиотропное лечение нозокомиальных инфекций в этих отделениях, несмотря на наличие большого количества АМП с разными механизмами действия, является одной из трудно решаемых проблем современной медицины.Слайд 3 Несовершенство
современных медицинских технологий и практики АМТ стало причиной появления и
распространения АБ-устойчивых нозокомиальных инфекций. Одной из важнейших характеристик, определяющих неэффективность АБТ, является резистентность флоры.Слайд 4 Учитывая тяжесть состояния больных и невозможность на
практике достаточно быстро получать лабораторные данные по этиологии инфекционного процесса
и АБ-чувствительности, проведение эмпирической терапии антибактериальными препаратами максимально широкого спектра действия является вполне обоснованнымСлайд 5 В течение длительного времени основу такой
терапии составляли комбинации цефалоспоринов III поколения и аминогликозидов. Однако появление
среди грамотрицательных микроорганизмов продуцентов бета-лактамаз расширенного спектра (БЛРС), широкое распространение аминогликозидмодифицирующих ферментов существенным образом ограничивает эффективность указанной терапии.Слайд 6 В качестве альтернативы комбинациям цефалоспоринов III поколения и
аминогликозидов используют фторхинолоны и карбапенемы. Однако и эти препараты не
являются исключением из общего правила, т.к. к ним также формируется резистентность, хотя и гораздо реже. Как правило, ее распространение ограничивается отдельными видами микроорганизмов.Слайд 7 Первый из карбапенемных антибиотиков – ИМИПЕНЕМ используется в
медицинской практике уже более 30 лет, тем не менее, штаммы
с приобретенной к нему резистентностью обнаружены в основном среди Pseudomonas aeruginosa и крайне редко среди других микроорганизмов.Слайд 8 20 лет назад в России зарегистрирован карбапенемный антибиотик
МЕРОПЕНЕМ, обладающий некоторыми отличиями и преимуществами в сравнении с ИМИПЕНЕМОМ:
бóльший уровень активности в отношении Г (–) микрофлоры при меньшей активности к Г (+); бóльшая активность в отношении некоторых резистентных к ИМИПЕНЕМУ штаммов P.aeruginosa, меньшая нейротоксичность и устойчивость к почечной дегидропептидазе.Слайд 9 Итогом многих исследований по антибиотикорезистентности явились следующие выводы:
карбапенемные антибиотики, в
частности, МЕРОПЕНЕМ, по спектру действия и уровню антимикробной активности являются
на сегодня самыми мощными средствами как для эмпирической терапии, так и для лечения инфекций, вызванных полирезистентными возбудителями;Слайд 10однако это не исключает необходимости микробиологической диагностики инфекций, так как
существуют микроорганизмы, обладающие к ним природной резистентностью; известны также, хотя
и редкие, но случаи формирования приобретенной устойчивости.Слайд 11 Устойчивость клинически значимых микроорганизмов к антимикробным препаратам требует
проведения мониторинга внебольничной и нозокомиальной флоры. Чрезвычайно важны результаты изучения
локальной чувствительности флоры в отдельных ЛПУ, а потому получение точных и достоверных данных остается основной задачей клинической микробиологии и эпидемиологии.Слайд 12 Основным критерием роста резистентности микрофлоры, как это не
странно для клиницистов, считаются не клинические данные, а минимальная подавляющая
концентрация (МПК), которую определяют в микробиологическом исследовании in vitro, но что, к сожалению, ещё не доступно большинству ЛПУ, хотя к этому надо стремиться.Слайд 13 Идеальная доза антибиотика должна обеспечивать наиболее высокую вероятность
киллинга бактерий. Следовательно, положительный клинический и бактериологический эффект может быть
достигнут без создания необоснованно высоких концентраций препарата, способных вызывать токсические реакции.Слайд 14 МЕРОПЕНЕМ даже в высоких дозах (6 г/сут ≈
90 мг/кг) у больных с инфекциями нервной системы сравнительно редко
вызывает неврологические расстройства и нежелательные явления со стороны ЖКТ. Кроме того, эффективность МЕРОПЕНЕМА можно повысить путем увеличения дозы, кратности применения (3-4 раза в сутки) и/или продолжительности инфузии.Слайд 15 В исследованиях in vitro и in vivo показано,
что клиническая эффективность β-лактамных антибиотиков при концентрациях в крови, в
2-3 раза превышающих МПК для определенного возбудителя, зависит не только от максимальной концентрации антибиотика, но и от соотношения между периодом времени, когда концентрация препарата в среде превышает МПК, и с интервалом дозирования – %Т>МПК:Слайд 16 Рис. 1. %Т>МПК - отношение длительности периода
превышения МПК к интервалу дозирования (в %) при введении бета-лактамных
антибиотиков
Слайд 17 Таким образом, изменение режимов дозирования препаратов позволяет добиваться
максимального подавления флоры и снижения количества бактерий, способных к мутациям
и продолжению инфекционного процесса. Эти принципы применимы не только к карбапенемам, но и к другим β-лактамам, а также аминогликозидам и фторхинолонам.Слайд 18 Максимальное значение %Т>МПК может быть достигнуто путем уменьшения
интервала дозирования (более частое введение) или увеличения продолжительности внутривенной инфузии
без изменения суточной дозы препарата. Карбапенемы можно вводить в виде продленной инфузии (около 3 часов), в то время как для достижения максимального бактериального киллинга цефалоспорины следует применять в виде постоянной инфузииСлайд 19Таблица 1. Вероятность достижения бактерицидного эффекта (%Т>МПК более 40%) при
различных дозах и времени инфузии меропенема при лечении инфекций, вызванных
P. Aeruginosa:Слайд 21 Постоянная инфузия бета-лактамных антибиотиков применяется в сложных клинических
ситуациях, например, у больных ОАРИТ, у пациентов с нейтропенией и
муковисцидозом. Она позволяет поддерживать %Т>МПК на уровне 100% в течение всего периода введения препарата, что важно для пациентов с серьезными нарушениями функции иммунной системы и у крайне тяжелых больных.Слайд 22 Этот метод экономичен, быстро обеспечивает терапевтические уровни препарата
в крови. Однако могут возникать проблемы со стабильностью препарата. При
комнатной температуре МЕРОПЕНЕМ стабилен 8 часов, при температуре ниже 4°С – 48 часов. Следовательно, постоянная инфузия возможна, если часто производить смену инфузионных упаковок препарата или применять систему с поддержанием низкой температуры раствора.Слайд 23 При наличии наиболее резистентных возбудителей может потребоваться комбинированное
применение карбапенемов с аминогликозидами, по крайней мере, в течение короткого
периода времени для профилактики развития резистентности. Показано, что комбинированная терапия с низкими дозами ТОБРАМИЦИНА способствует подавлению резистентности при экспериментальных инфекциях, вызванных P. АeruginosaСлайд 24 Непременным условием успешного долговременного использования АБТ
является разумное его применение. С этой целью важным является правильное
позиционирование МЕРОПЕНЕМА, т.е. определение его места при лечении серьезных инфекций. МЕРОПЕНЕМ следует применять только при тяжелых инфекциях, в основном госпитальных (исключение – менингит).Слайд 25 МЕРОПЕНЕМ эффективен в режиме монотерапии при лечении госпитальных
инфекций различной локализации: пневмония, осложненные инфекции мочевыводящих путей, послеоперационная раневая
инфекция, интраабдоминальная инфекция, воспалительные заболевания малого таза, сепсис, инфекции у больных с нейтропенией, легочные инфекции у больных с муковисцидозом, гнойный менингит.Слайд 26 В большинстве случаев препарат используется как резервное средство
в случае неэффективности начальной терапии. Однако необходимо особо выделить состояния,
при которых МЕРОПЕНЕМ должен рассматриваться как препарат 1-го выбора. Это прежде всего – жизнеугрожающие инфекции:Слайд 271. При эмпирической терапии:
инфекции у больных в критическом состоянии
поздняя (свыше 5 сут) ВАП
инфекционные осложнения при панкреонекрозе.
посттравматический
или послеоперационный гнойный менингит. легочные инфекции у больных муковисцидозом.
документированная инфекция у больных с нейтропенией.
легочные нагноения (абсцесс, эмпиема) у больных с иммунодефицитом.