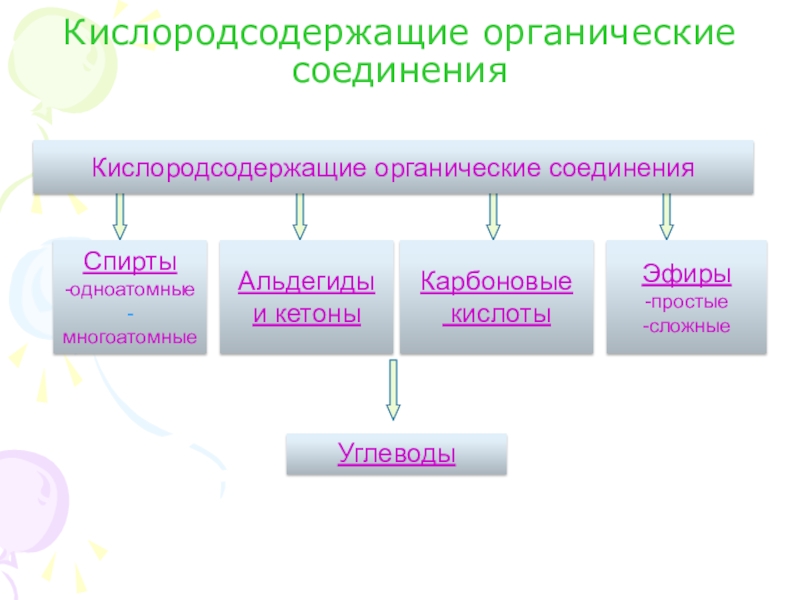
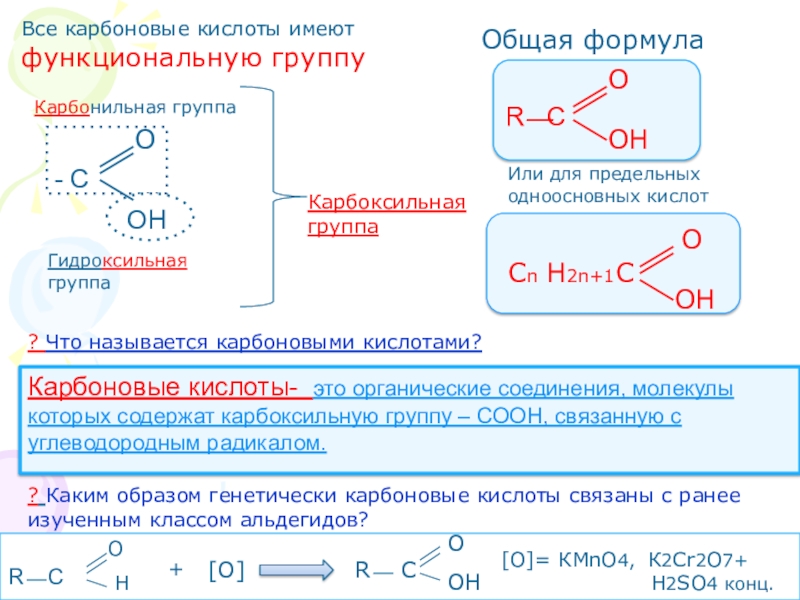
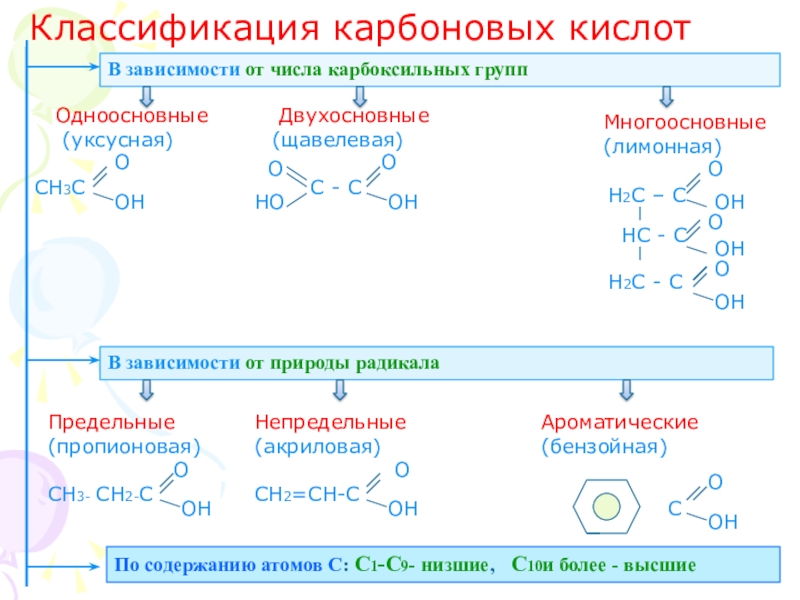
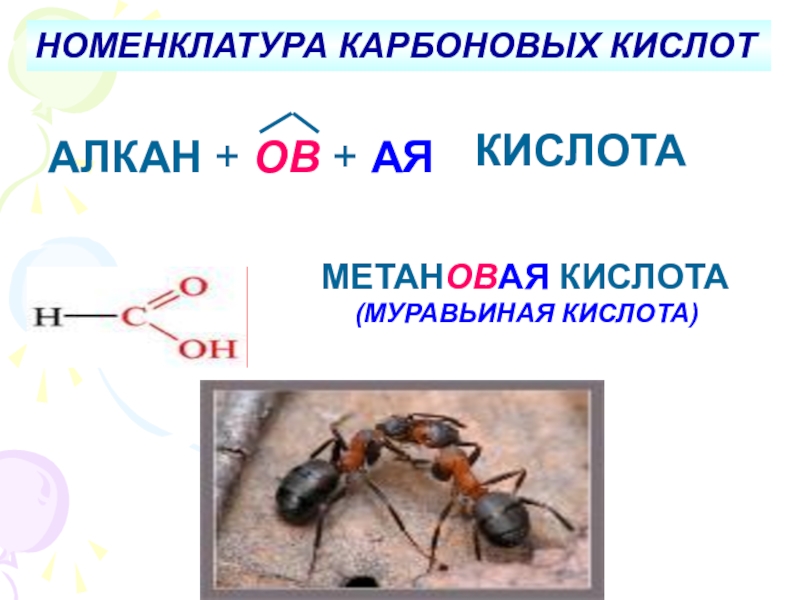
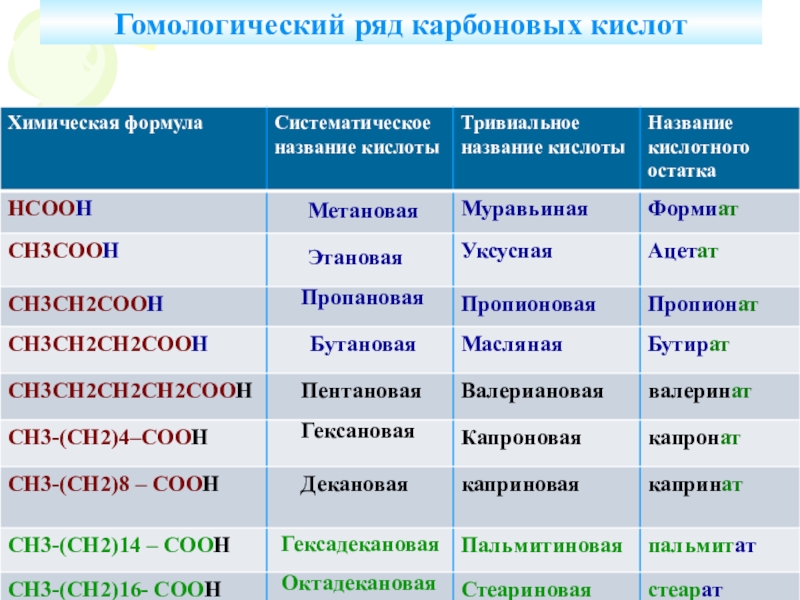
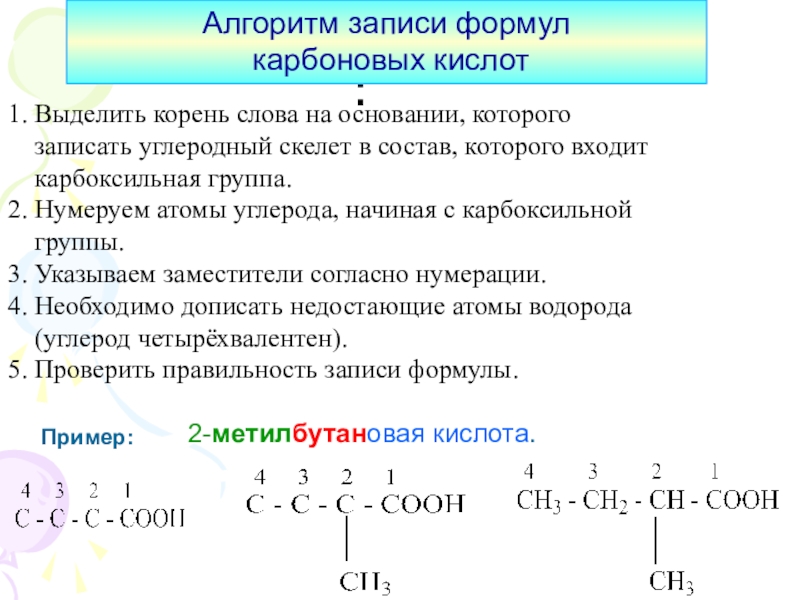
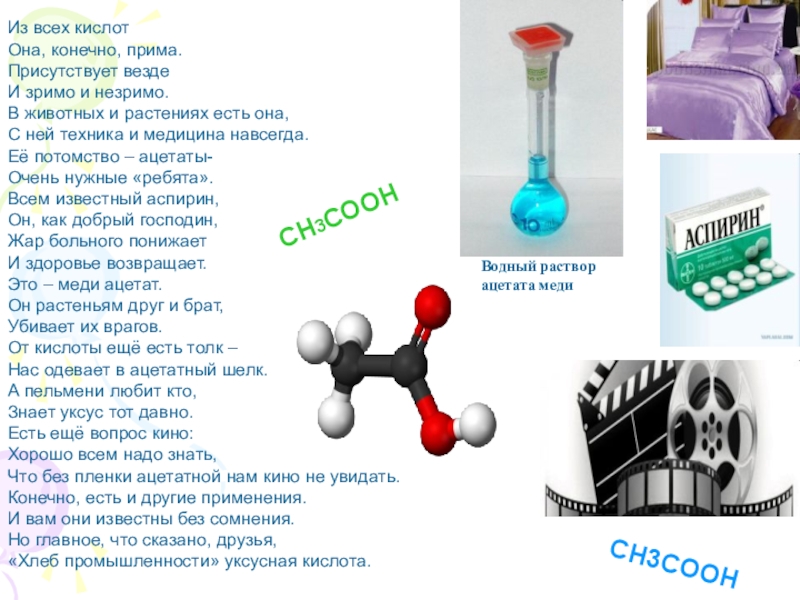
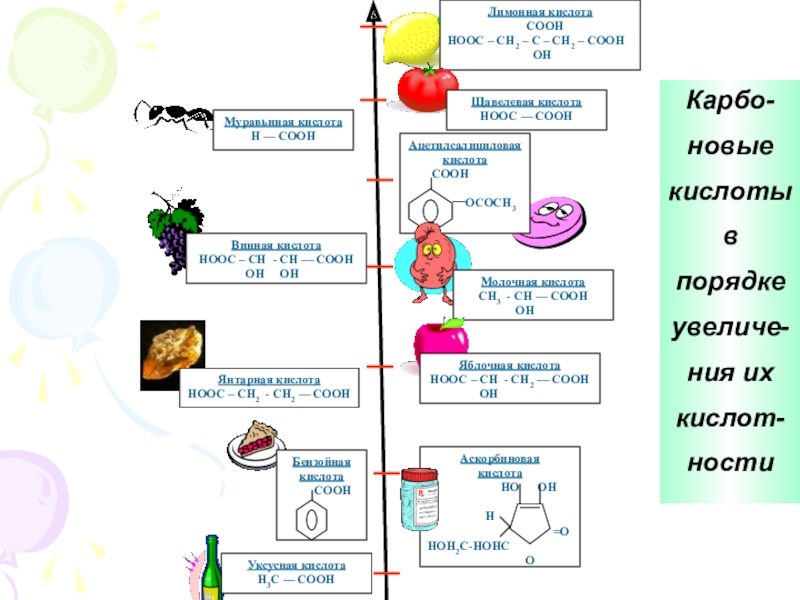
3. Изучить классификацию карбоновых кислот.
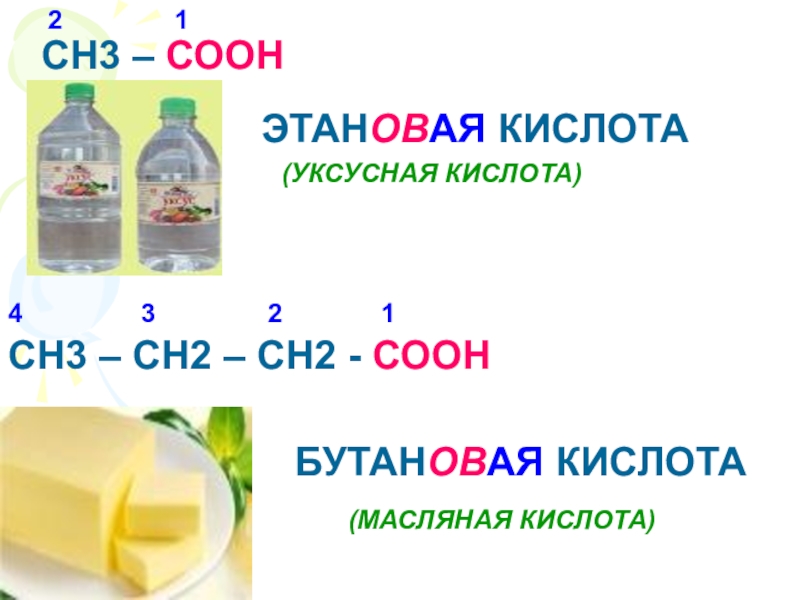
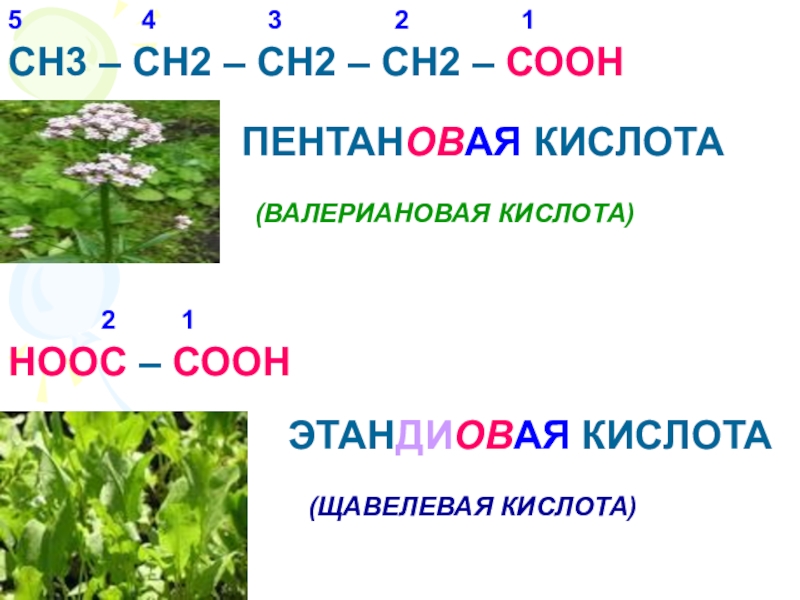
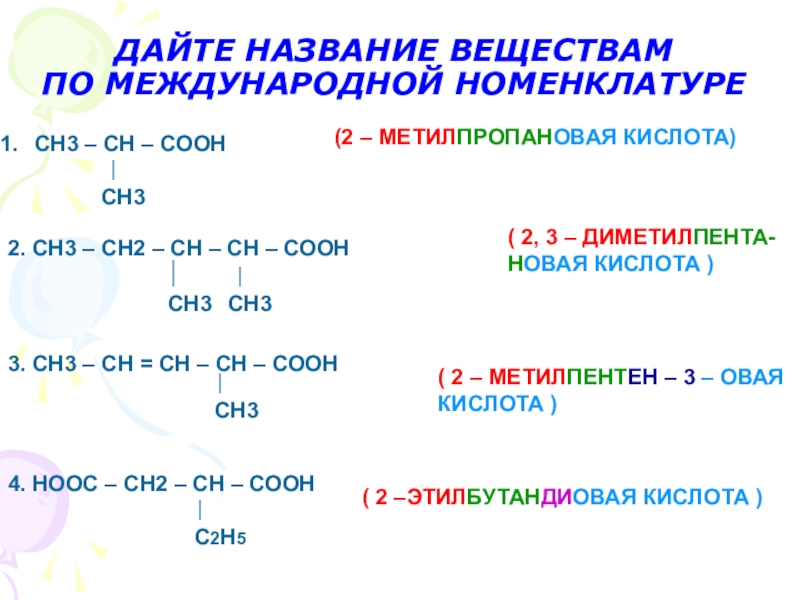
4. Овладеть навыками номенклатуры.
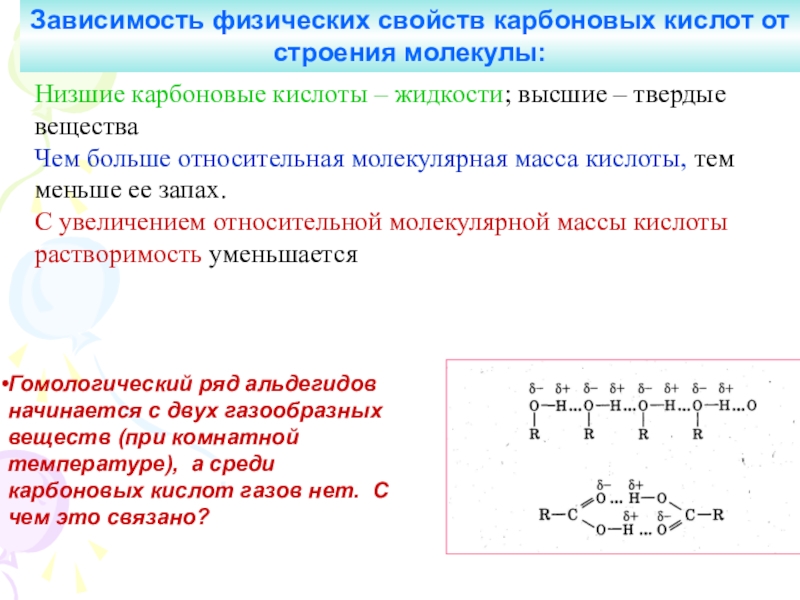
5. Рассмотреть физические
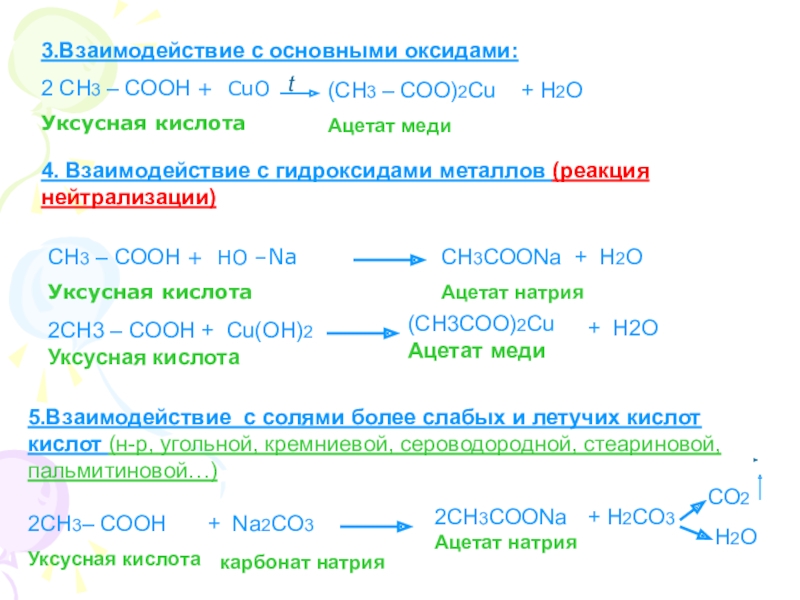
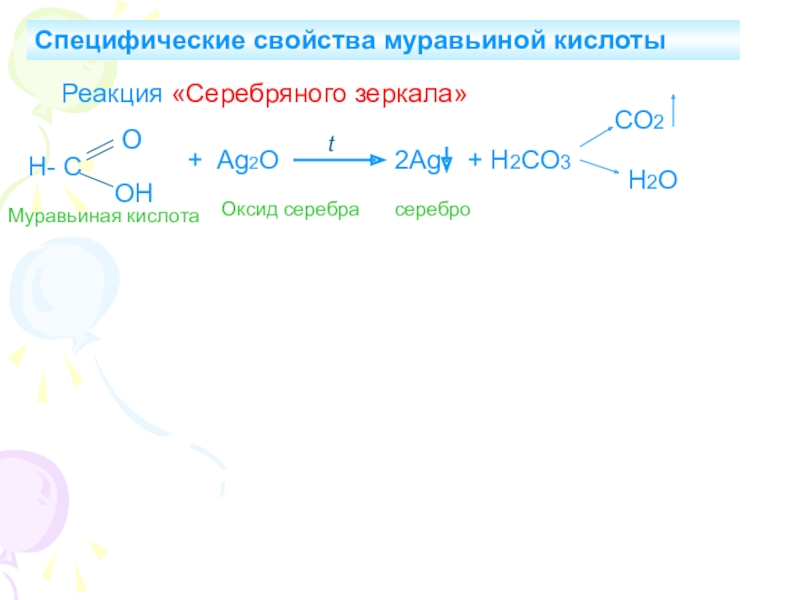
и химические свойства наиболее важных карбоновых кислот.6. Выяснить области применения некоторых карбоновых кислот.