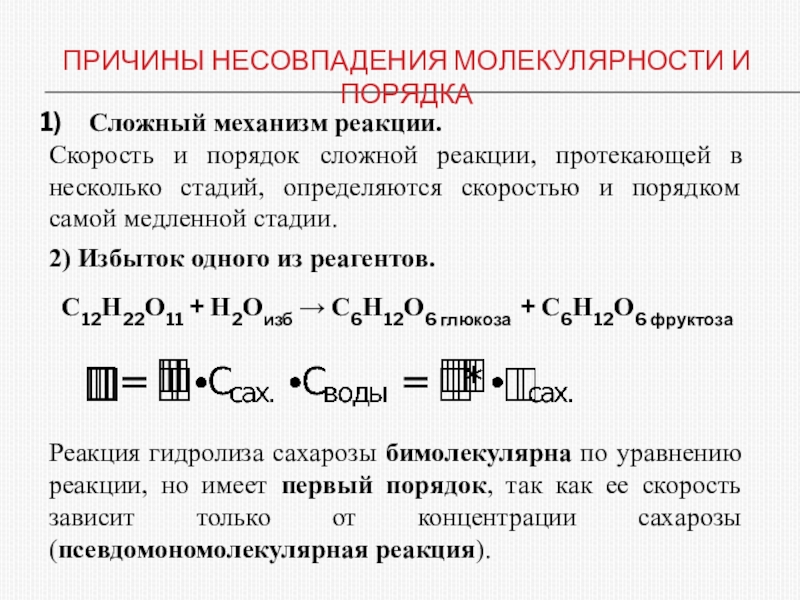
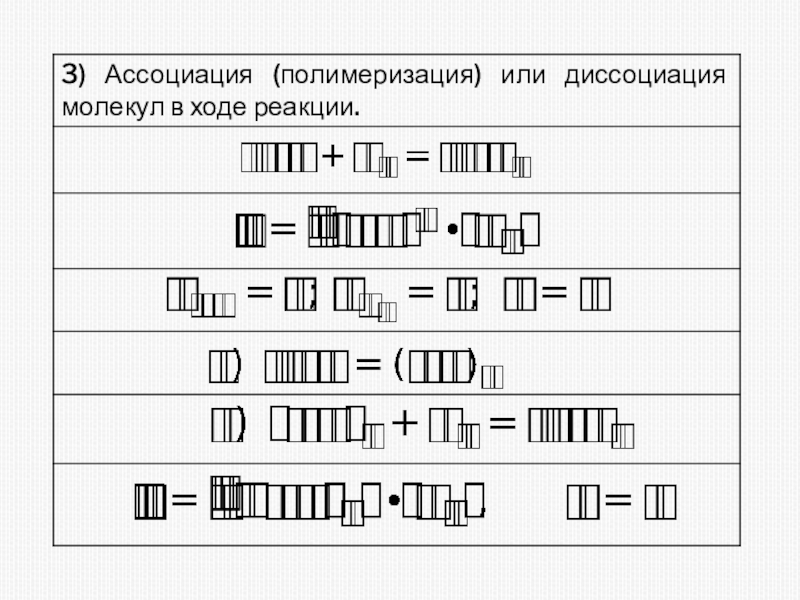
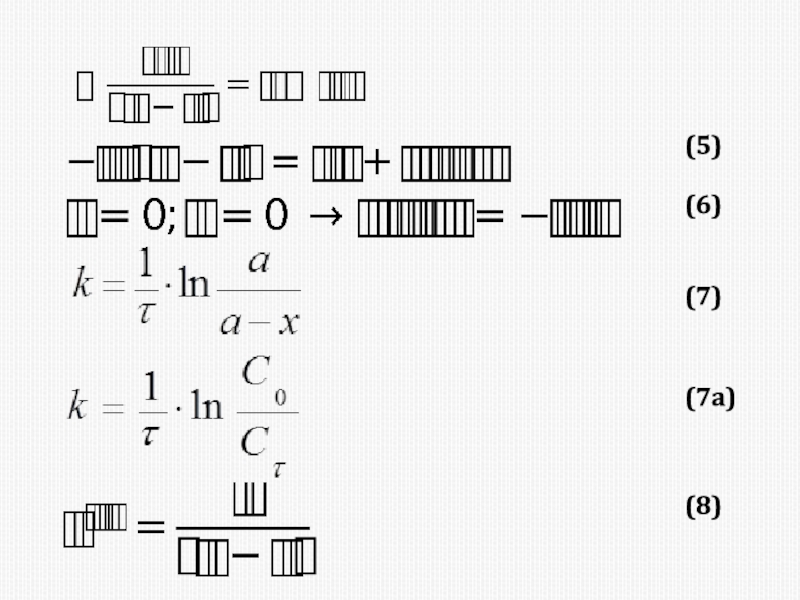
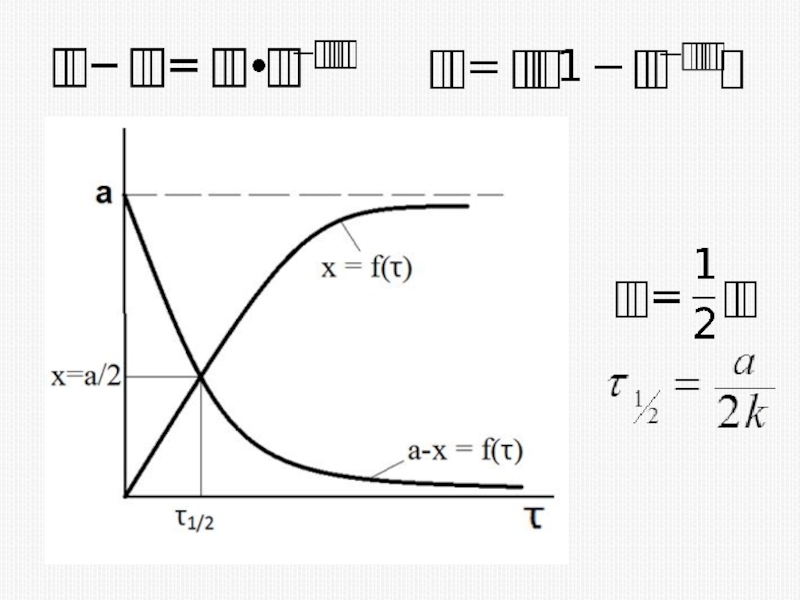
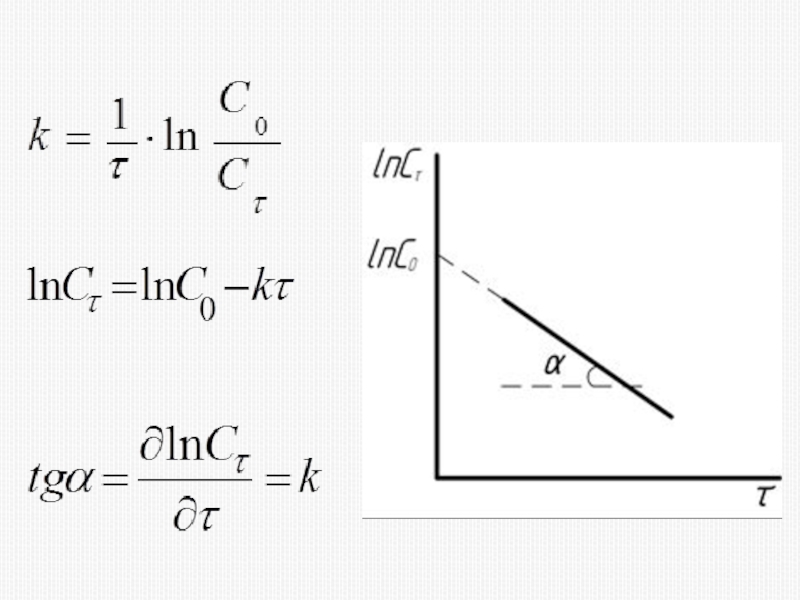
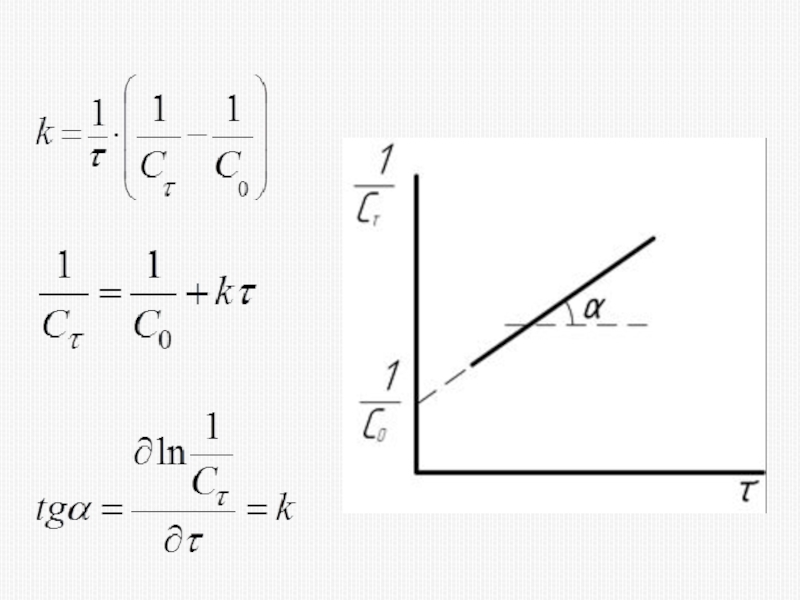
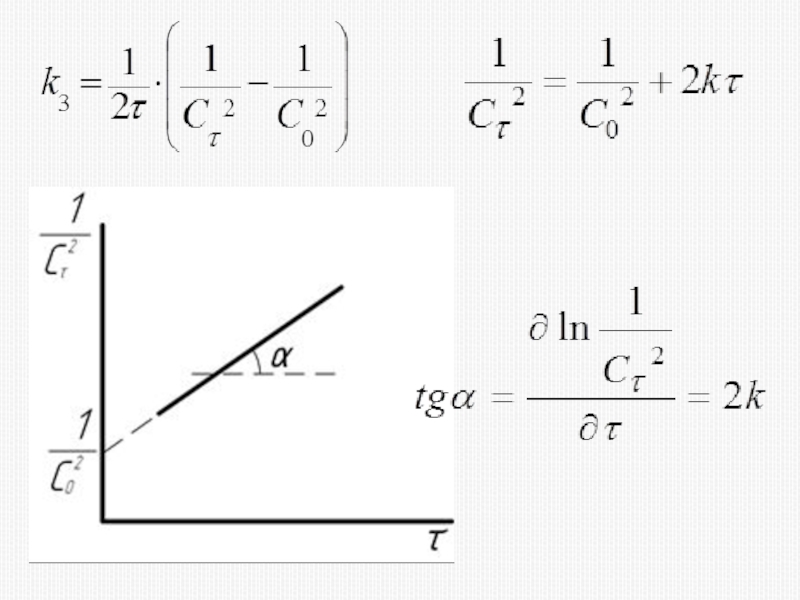
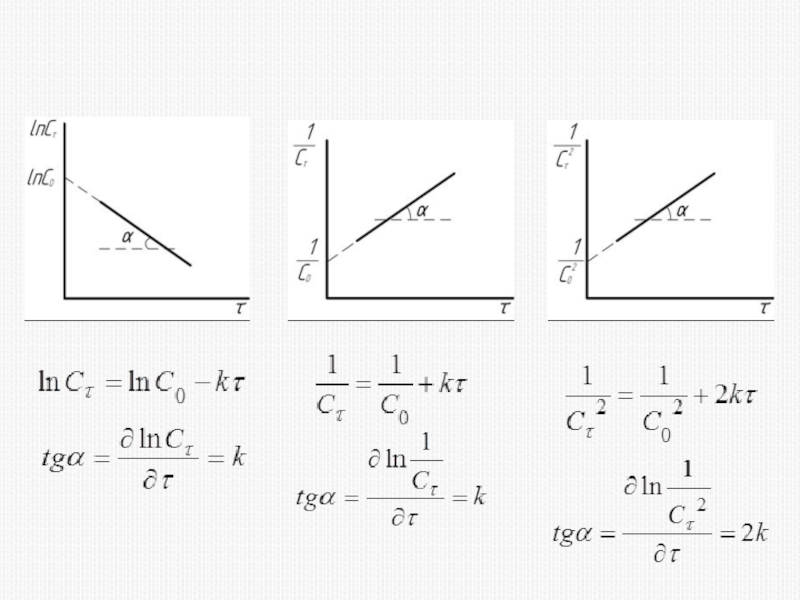
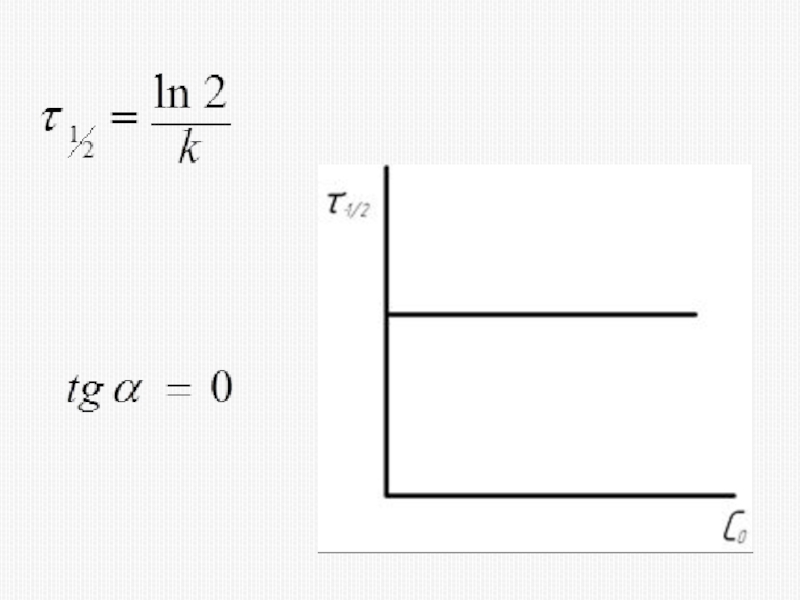
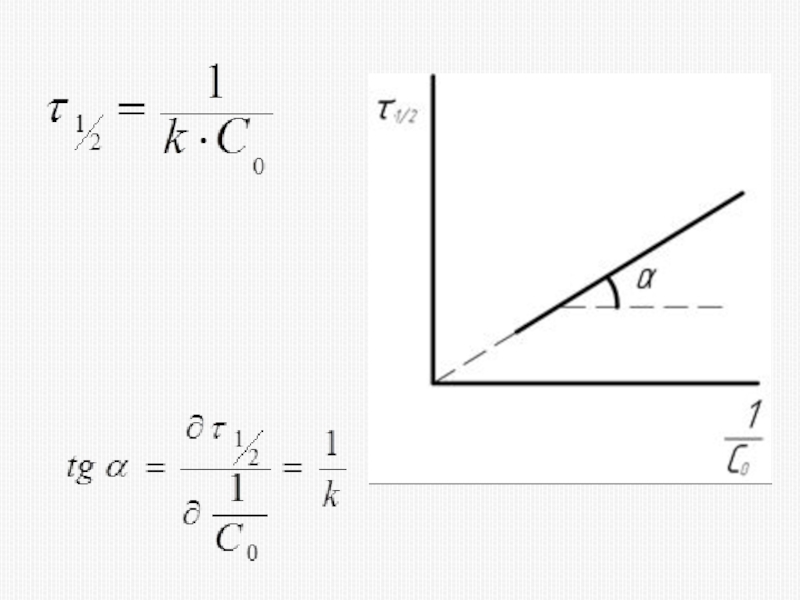
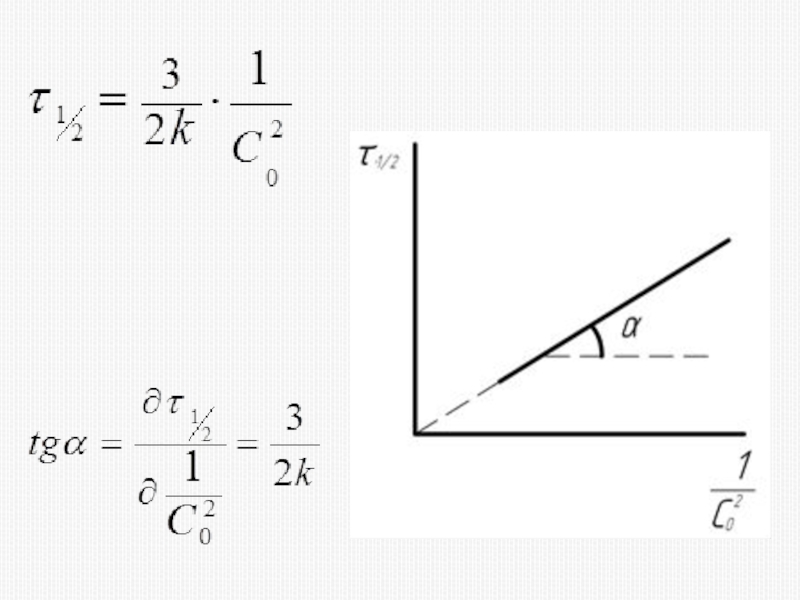
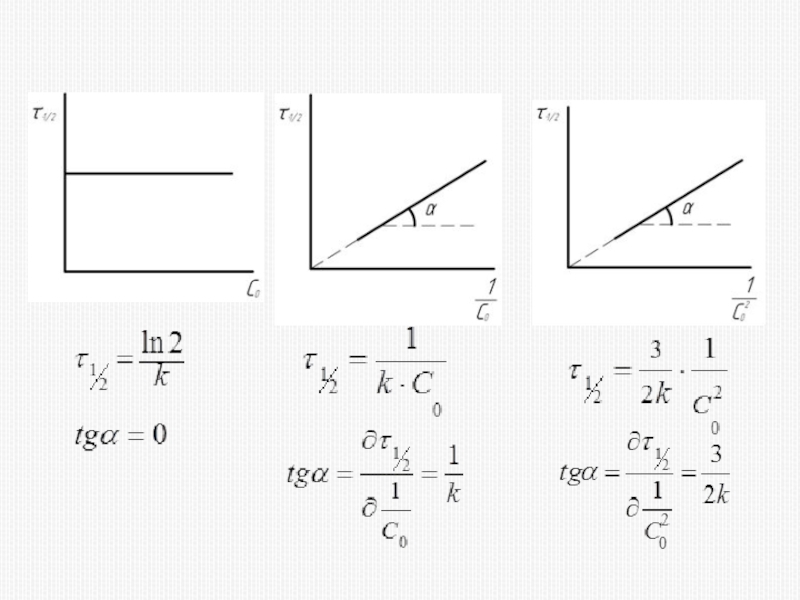
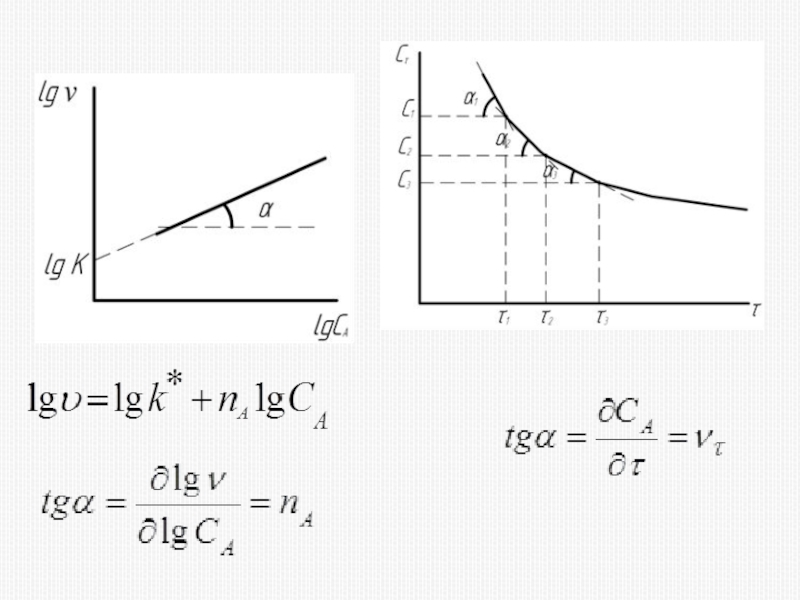
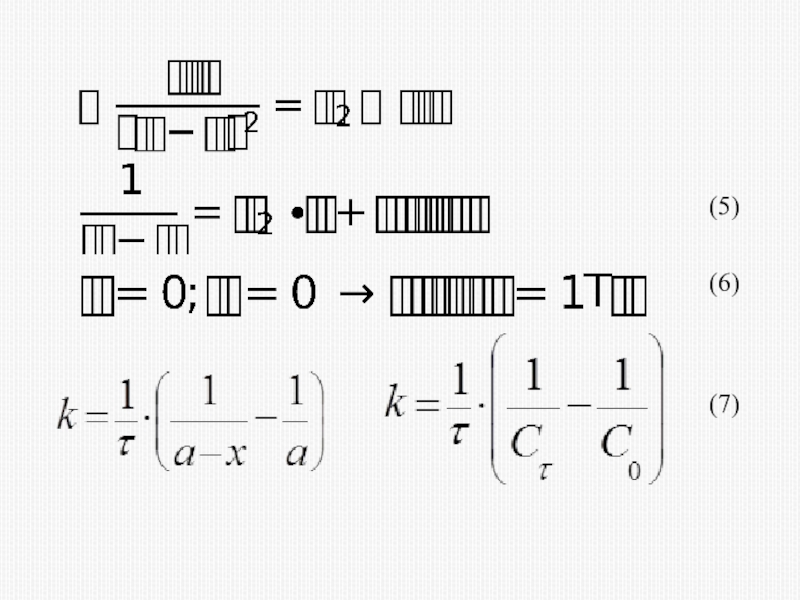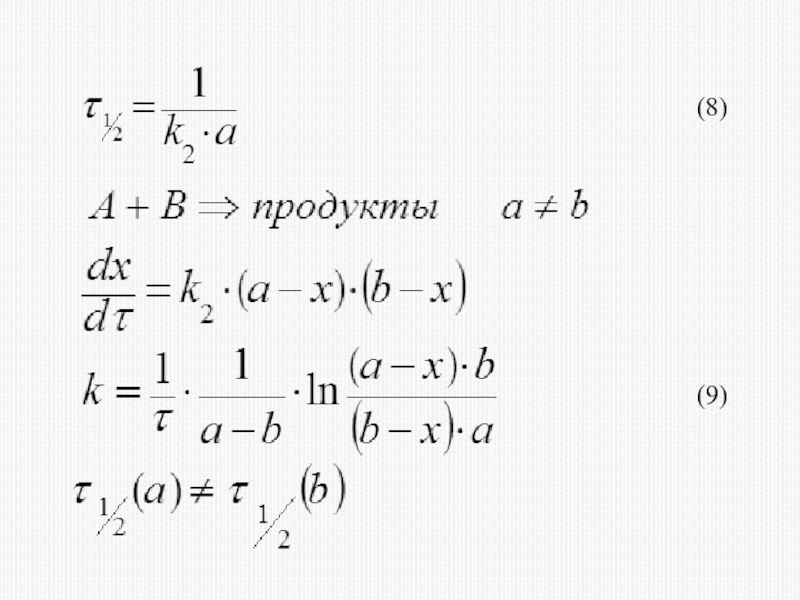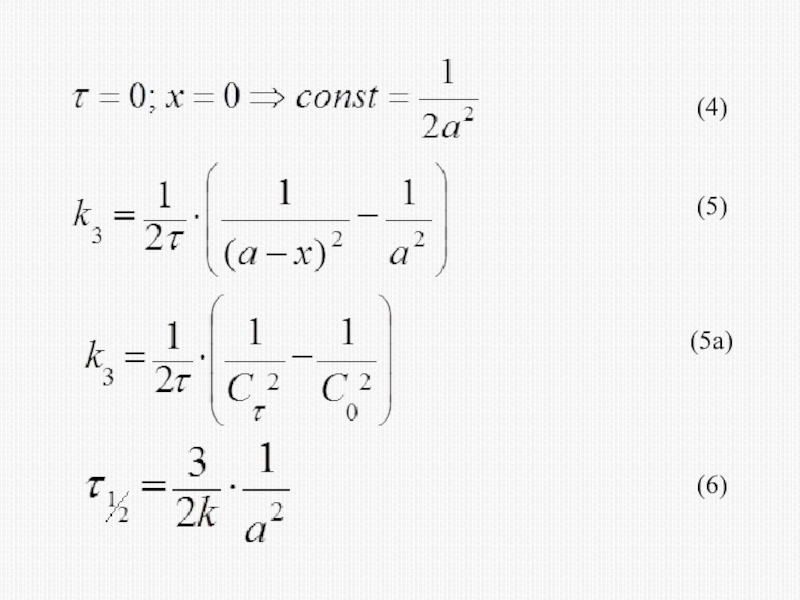различных факторов на скорость.
Задачи химической кинетики:
1) расчет скоростей реакций и построение кинетических кривых, т.е. зависимости концентраций реагирующих веществ от времени; 2) определение механизмов реакций по кинетическим кривым.