Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Классификация органических реакций. Сопряжение
Содержание
- 1. Классификация органических реакций. Сопряжение
- 2. Классификация реакций
- 3. По направлению и конечному результатуРеакции присоединения –
- 4. По механизмуреакции радикальные - участвуют радикалы (R.),
- 5. Основные понятияРАДИКАЛЫ – свободные атомы или частицы
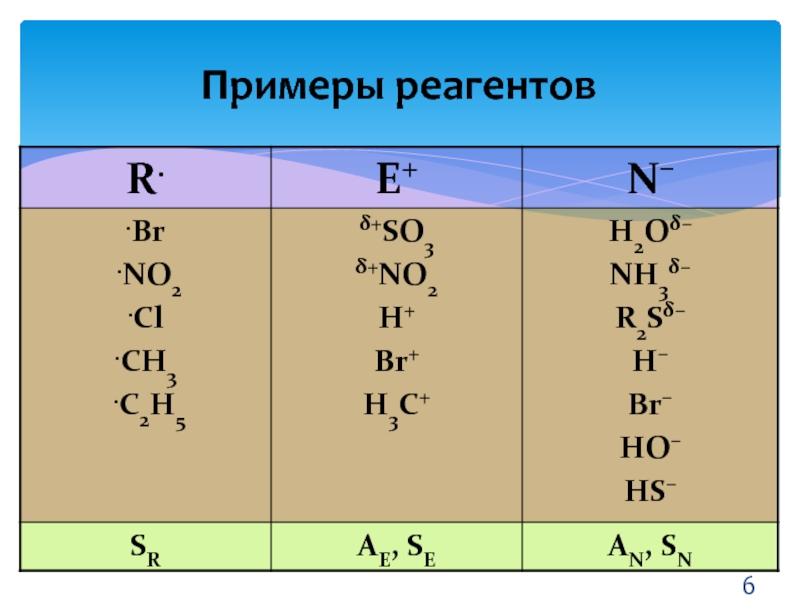
- 6. Примеры реагентов
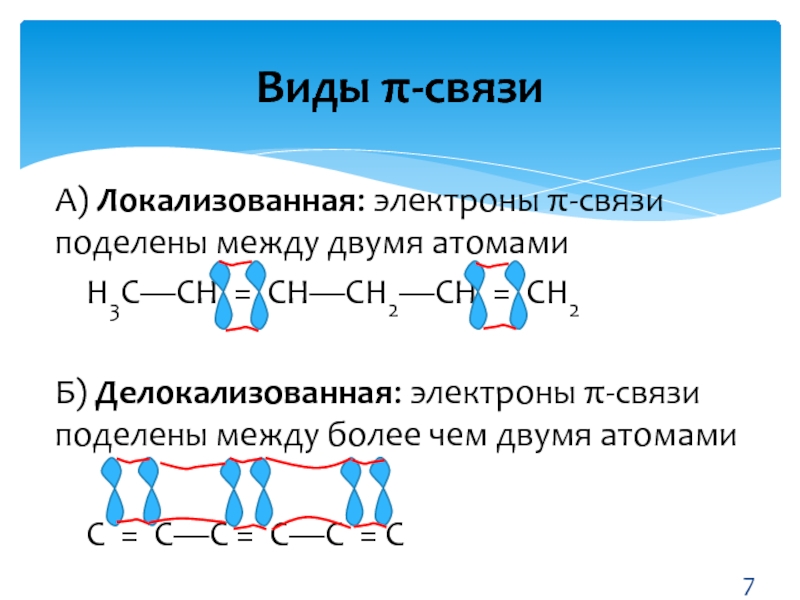
- 7. Виды π-связиА) Локализованная: электроны π-связи поделены между
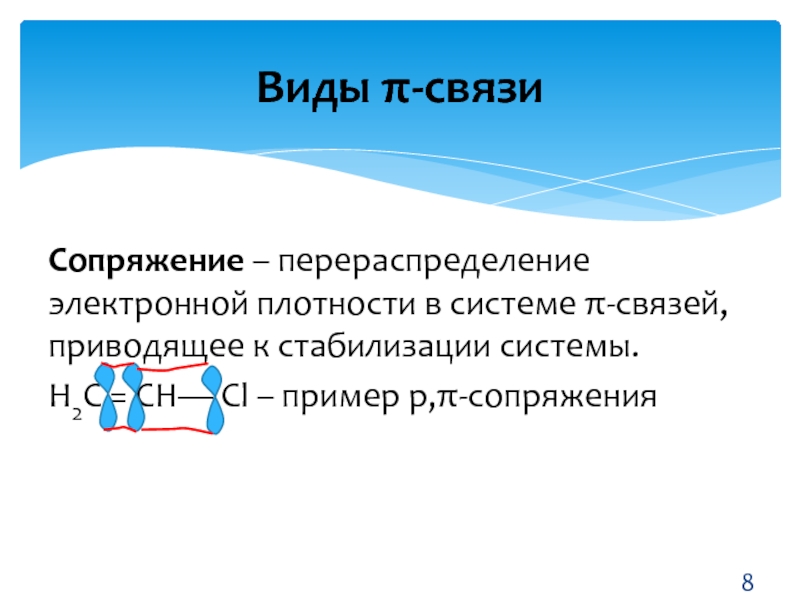
- 8. Сопряжение – перераспределение электронной плотности в системе
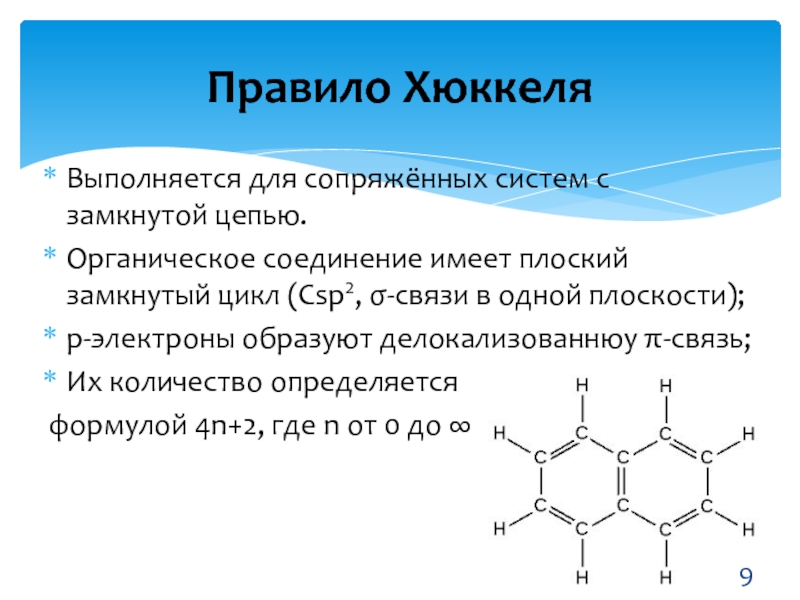
- 9. Выполняется для сопряжённых систем с замкнутой цепью.Органическое
- 10. приводят к неравномерному распределению электронной плотности в
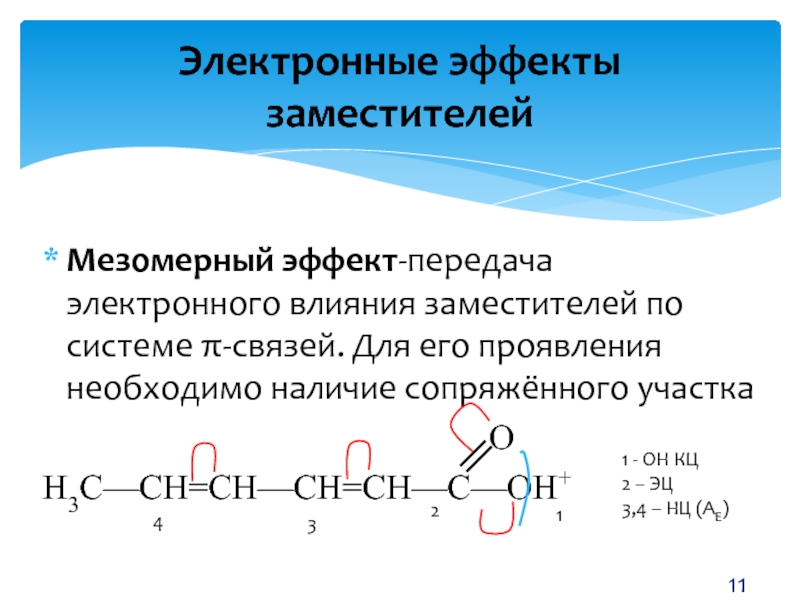
- 11. Мезомерный эффект-передача электронного влияния заместителей по системе
- 12. Заместители 1 рода (Э.Д.): СН3, NН2, ОН,
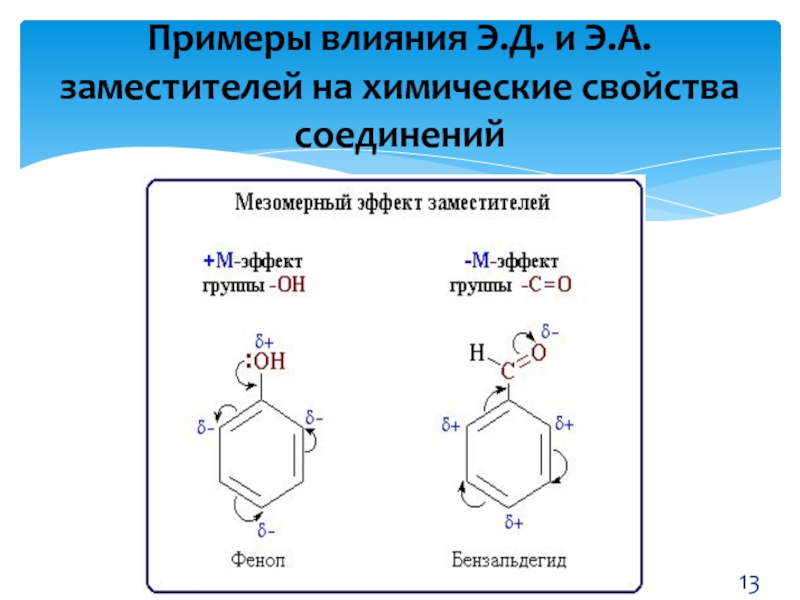
- 13. Примеры влияния Э.Д. и Э.А. заместителей на химические свойства соединений
- 14. Спасибо за внимание!
- 15. Скачать презентанцию
Классификация реакций
Слайды и текст этой презентации
Слайд 1Классификация органических реакций. Сопряжение. Взаимное влияние атомов в молекуле на
реакционную способность соединения.
Слайд 3По направлению и конечному результату
Реакции присоединения – А;
Реакции замещения –
S;
Реакции отщепления – Е (элиминирования);
Реакции перегруппировки;
Окислительно-восстановительные реакции.
Слайд 4По механизму
реакции радикальные - участвуют радикалы (R.), образующиеся за счёт
гомолитического типа разрыва связей
Х : У ? Х. + У.
реакции ионные - участвуют электрофильные и нуклеофильные реагенты, образующиеся за счёт гетеролитического типа разрыва связей
E : N ? E + + :N–
Слайд 5Основные понятия
РАДИКАЛЫ – свободные атомы или частицы с неспаренным электроном.
ЭЛЕКТРОФИЛЫ
– частицы или фрагменты молекул, содержащие свободную, доступную орбиталь.
НУКЛЕОФИЛЫ –
частицы или фрагменты молекул, содержащие подвижную электронную пару на внешнем электронном уровне.Слайд 7Виды π-связи
А) Локализованная: электроны π-связи поделены между двумя атомами
Н3С—СН =
СН—СН2—СН = СН2
Б) Делокализованная: электроны π-связи поделены между более чем
двумя атомамиС = С—С = С—С = С
Слайд 8Сопряжение – перераспределение электронной плотности в системе π-связей, приводящее к
стабилизации системы.
Н2С = СН— Сl – пример р,π-сопряжения
Виды π-связи
Слайд 9Выполняется для сопряжённых систем с замкнутой цепью.
Органическое соединение имеет плоский
замкнутый цикл (Сsp2, σ-связи в одной плоскости);
р-электроны образуют делокализованнюу π-связь;
Их
количество определяетсяформулой 4n+2, где n от 0 до ∞
Правило Хюккеля
Слайд 10приводят к неравномерному распределению электронной плотности в ОС и возникновению
реакционных центров.
Индуктивный эффект – передача электронного влияния заместителей по цепи
σ-связей:СН3→СН2→СН←СН2←СН3
NH2
Электронные эффекты заместителей
Слайд 11Мезомерный эффект-передача электронного влияния заместителей по системе π-связей. Для его
проявления необходимо наличие сопряжённого участка
О
Н3С—СН=СН—СН=СН—С—ОН+
Электронные эффекты заместителей
4
3
2
1
1 - ОН КЦ
2
– ЭЦ3,4 – НЦ (АЕ)
Слайд 12Заместители 1 рода (Э.Д.): СН3, NН2, ОН, Нal ориентируют последующие
заместители в орто- и пара- (2, 4, 6) положения.
Заместители 2
рода (Э.А.): NО2, SО3, СООН ориентируют все последующие заместители в мета- (3, 5) положения.Э.Д. и Э.А. заместители