Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Классификация химических реакций в неорганической и органической химии
Содержание
- 1. Классификация химических реакций в неорганической и органической химии
- 2. — это превращение одного или нескольких исходных
- 3. Классификация химических реакций в неорганической химии Химические
- 4. По характеру процесса.Реакции разложения
- 5. По типу разрыва связиГомолитические (равный разрыв, каждый
- 6. По тепловому эффекту экзотермические (выделение тепла) СН4+ 2О2
- 7. Катализатор – это вещество, которое увеличивает скорость
- 8. По изменению степени окисления Окислительно-восстановительные - идут с
- 9. По направлениюОбратимые способные протекать как в прямом,
- 10. По агрегатному состоянию фазГомогенные реакция проходит в одной
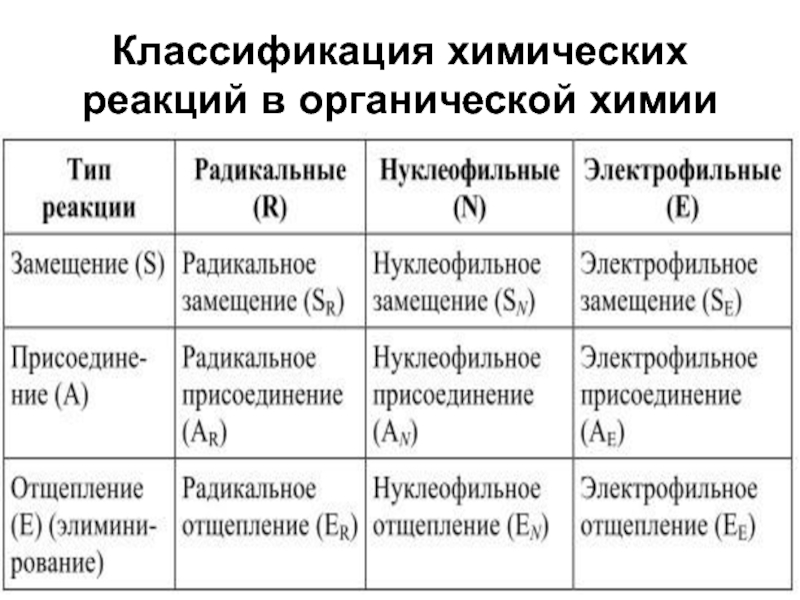
- 11. Классификация химических реакций в органической химии
- 12. Реакция нуклеофильного замещения (SN) СН-ОН-
- 13. Реакции электрофильного присоединения (АЕ) Н2С =
- 14. Реакции отщепления(элиминирования) - это реакции, которые приводят
- 15. Скачать презентанцию
Слайды и текст этой презентации
Слайд 2— это превращение одного или нескольких исходных веществ (реагентов) в
продукты реакции, которые отличаются по химическому составу или строению.
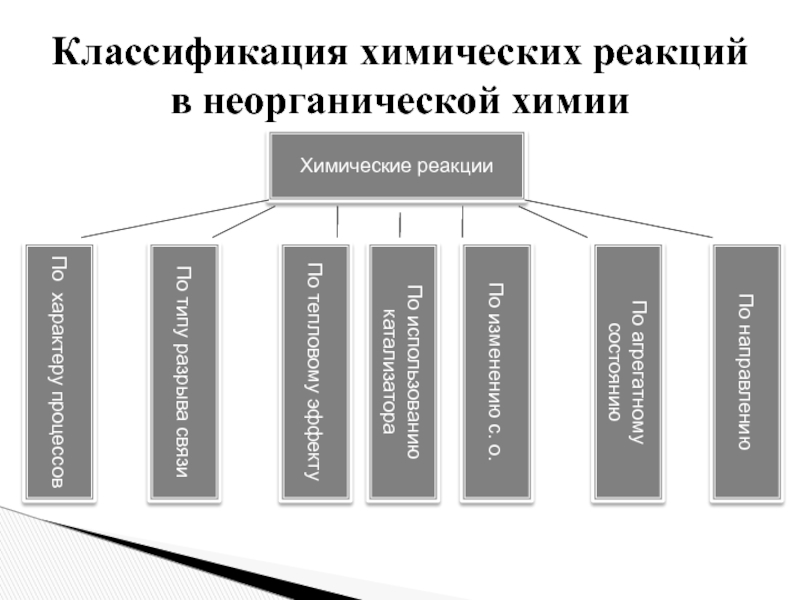
Слайд 3Классификация химических реакций в неорганической химии
Химические реакции
По направлению
По
агрегатному состоянию
По изменению с. о.
По использованию катализатора
По
тепловому эффекту По типу разрыва связи
По характеру процессов
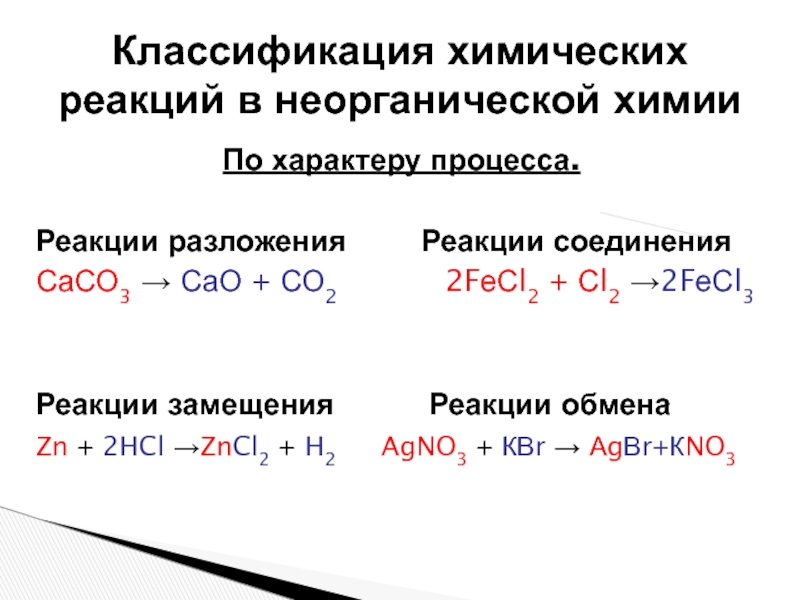
Слайд 4По характеру процесса.
Реакции разложения Реакции соединения
СаСО3 →
СаО + СО2
2FеСl2 + Сl2 →2FеСl3Реакции замещения Реакции обмена
Zn + 2HCl →ZnCl2 + H2 AgNO3 + КВr → АgВr+КNO3
Классификация химических реакций в неорганической химии
Слайд 5
По типу разрыва связи
Гомолитические (равный разрыв, каждый атом получает по
одному электрону).
CH4 свет→ CH3∙ + ∙H
Гетеролитические (неравный разрыв
– одному достается пара электронов).CH3Сl → CH3+ + :Cl-
Классификация химических реакций в неорганической химии
Слайд 6По тепловому эффекту
экзотермические (выделение тепла)
СН4+ 2О2 → СО2 +
2Н2О + Q
эндотермические (поглощение тепла)
CaCO3→ CaO +CO2 – Q
Классификация химических реакций
в неорганической химии Слайд 7Катализатор – это вещество, которое увеличивает скорость химической реакции.
По
использованию катализатора
Каталитические.
2KClO3→t, MnO2 2KCl+3O2↑
Некаталитические.
2Al+6HCl→t 2AlCl3+3H2↑
Классификация химических реакций в
неорганической химииСлайд 8По изменению степени окисления
Окислительно-восстановительные - идут с изменением степени окисления
элементов:
2KN+5O3 +C0 →2KN+3O2 + С+4O2
Кислотно-основные - идут без изменения
степени окисления элементов.KOH + HBr → KBr+H2O
Классификация химических реакций в неорганической химии
Слайд 9По направлению
Обратимые способные протекать как в прямом, так и в
обратном направлении
3H2 + N2 ⇆ 2NH3
Необратимыми реакции,
при протекании которых:1) продукты выпадают в виде осадка, выделяются в виде газа.
ВаСl2 + Н 2SО 4 →ВаSО4↓ + 2НСl
2) образуется малодиссоциированное соединение.
НСl + NаОН → Н2О + NаСl
3) образуется комплексная соль:
СuSO4 + 4NНз = [Сu(NНз)4]SO4
Классификация химических реакций в неорганической химии
Слайд 10По агрегатному состоянию фаз
Гомогенные реакция проходит в одной фазе, без границ
раздела; реакции в газах или в растворах.
NaOH(p-p)+HCl(p-p)→NaCl+H2O
Гетерогенные реакции содержат разные фазы
и проходят на границе раздела фаз.Zn(тв)+2HCl(р-р)→ZnCl2+H2↑
Классификация химических реакций в неорганической химии
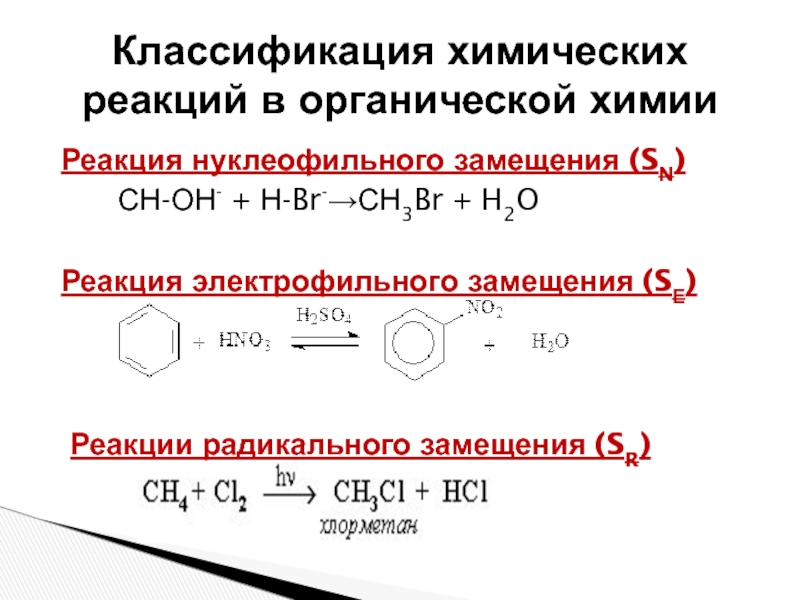
Слайд 12Реакция нуклеофильного замещения (SN)
СН-ОН- + Н-Br-→СН3Br +
H2O
Реакция электрофильного замещения (SЕ)
Реакции радикального замещения (SR)
Классификация химических реакций
в органической химииСлайд 13
Реакции электрофильного присоединения (АЕ)
Н2С = СН2 + Н+Сl–
→ СН3 – СН2Сl
Реакции нуклеофильного присоединения(АN)
Реакция радикального присоединения (AR)
Классификация химических
реакций в органической химииСлайд 14Реакции отщепления(элиминирования) - это реакции, которые приводят к образованию кратных
связей.
CH3-CH(Cl)-CH2-CH3 + KOH →CH3-CH=CH-CH3 + HCl
Элиминирование при
действии нуклеофилов (оснований)Элиминирование при действии электрофилов (кислот)
Классификация химических реакций в органической химии