Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Коллоидная химия
Содержание
- 1. Коллоидная химия
- 2. Понятие о дисперсности, дисперсных системах и поверхностных
- 3. Классификация дисперсных систем по дисперсности
- 4. Классификация дисперсных систем по агрегатному состоянию фаз
- 5. Классификация по характеру межфазного взаимодействия По
- 6. Коллоидные растворы Коллоидное состояние характерно для многих
- 7. Мицелла – сложное структурное образование, состоящее из агрегата, потенциалопределяющих
- 8. Рассмотрим строение мицеллы при образовании коллоидного раствора
- 9. Слайд 9
- 10. Свойства коллоидных растворов элементарная структурная единица
- 11. Устойчивость коллоидных растворов Различают кинетическую и агрегатную
- 12. Слайд 12
- 13. Применение в промышленности и жизни Коллоидными растворами
- 14. Скачать презентанцию
Слайды и текст этой презентации
Слайд 1Коллоидная химия
Коллоидная химия - это физическая химия поверхностных явлений и
дисперсных систем.
Слайд 2Понятие о дисперсности, дисперсных системах и поверхностных явлениях
Дисперсность D (раздробленность)
вещества - это величина обратная линейному размеру частиц :
где
- длина ребра куба или диаметр частицы.Дисперсные системы - это двух- или в общем случае многофазные гетерогенные системы, в которых хотя бы одна из фаз представлена очень малыми частицами, размеры которых, однако, превосходят молекулярные.
Дисперсная система состоит из дисперсной фазы и дисперсионной среды.
Дисперсная фаза - это та фаза дисперсной системы, которая раздроблена до мельчайших частиц.
Дисперсионная среда - это фаза, в которой распределено раздробленное вещество.
Дисперсные системы являются телами с высокоразвитой поверхностью. Такими дисперсными системами являются большинство окружающих нас реальных тел. Сыпучие и пористые материалы, почва, растительный и животный мир, суспензии, пасты, пены, эмульсии, кожа, ткани, бумага, продукты питания, космические тела - все это дисперсные системы, которые являются объектами изучения данной науки.
Поверхностные явления - это явления, происходящие на поверхности, в межфазном поверхностном слое.
Слайд 5Классификация по характеру межфазного взаимодействия
По данному признаку все системы
делятся на два вида - лиофильные (ЛФЛ) и лиофобные (ЛФБ).
Для
ЛФЛ (или ГФЛ - гидрофильных, в случае, когда дисперсионной средой является вода) характерно сильное межмолекулярное взаимодействие дисперсной фазы и дисперсионной среды. Это приводит к образованию сольватных оболочек вокруг частиц дисперсной фазы. Они термодинамически устойчивы как относительно дальнейшего растворения, так и против агрегирования частиц.В ЛФБ (ГФБ - гидрофобных, в случае воды) наблюдается слабое взаимодействие дисперсной фазы и дисперсионной среды. В них на границе раздела не скомпенсированы силы взаимодействия и имеется избыток свободной поверхностной энергии. Такие системы термодинамически неустойчивы и требуют дополнительной стабилизации. Именно такой тип систем является наиболее распространенным.
Кроме этих крайних состояний существует широкий спектр промежуточных состояний.
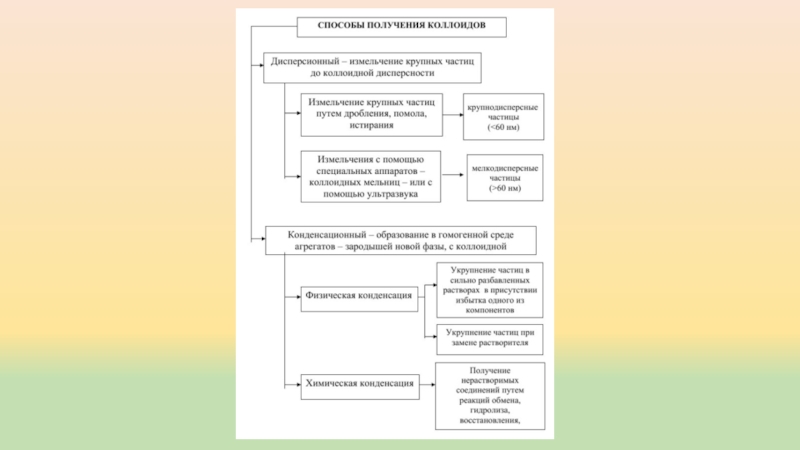
Слайд 6Коллоидные растворы
Коллоидное состояние характерно для многих веществ, если их частицы
имеют размер от 10ˉ7 до 10ˉ5 см.
Суммарная их поверхность огромна, и
она обладает поверхностной энергией, за счет которой может адсорбировать частицы из раствора. Образующаяся коллоидная частица называется мицеллой.
Слайд 7Мицелла – сложное структурное образование, состоящее из агрегата, потенциалопределяющих ионов и противоионов.
Внутреннюю
часть мицеллы составляет агрегат основного вещества:
Как правило, агрегат состоит из большого числа
молекул или атомов кристаллического или аморфного строения. Агрегат электронейтрален, но обладает большой адсорбционной способностью и способен адсорбировать на своей поверхности ионы из раствора – потенциалопределяющие ионы (ПОИ).
При выборе потенциалопределяющих ионов пользуются эмпирическим правилом Фаянса – Панета – Пескова: «На твердой поверхности агрегата в первую очередь адсорбируются ионы, которые:
- входят в состав агрегата;
- способны достраивать кристаллическую решетку агрегата;
- образуют малорастворимое соединение с ионами агрегата;
- изоморфны с ионами агрегата».
Агрегат вместе с потенциалопределяющими ионами составляет ядро мицеллы. Ядро мицеллы, обладающее большим зарядом, притягивает ионы противоположного заряда – противоионы (ПИ) из раствора.
Часть противоионов находится в непосредственной близости от ядра, прочно связана с ним за счет адсорбционных и электростатических сил, и образует плотную часть двойного электрического слоя (адсорбционный слой).
Ядро с противоионами плотной части двойного электрического слоя образуют гранулу или коллоидную частицу. Знак заряда коллоидной частицы определяется знаком заряда потенциалопределяющих ионов.
Коллоидную частицу (гранулу) окружают противоионы диффузного слоя – остальная часть противоионов, подвергающихся броуновскому движению и менее прочно связанная с ядром. В целом образуется мицелла. Мицелла в отличие от коллоидной частицы электронейтральна.
Слайд 8 Рассмотрим строение мицеллы при образовании коллоидного раствора – золя иодида
серебра методом химической конденсации при небольшом избытке нитрата серебра
Схематическое строение
мицеллы золя иодида серебраФормула мицеллы запишется:
где m – количество молекул или атомов, образующих агрегат;
n – число потенциалопределяющих ионов, адсорбированных на поверхности агрегата;
(n – x) – число противоионов в плотной части двойного электрического слоя (адсорбционный слой);
x – число противоионов в диффузной части двойного электрического слоя;
x + – заряд коллоидной частицы (гранулы).
При образовании золя иодида серебра при небольшом избытке иодида калия образуется мицелла следующего состава:
Заряд коллоидной частицы в этом случае будет отрицательным.
Слайд 10 Свойства коллоидных растворов
элементарная структурная единица – мицелла;
малая диффузионная способность;
низкое
осмотическое давление;
малая способность к диализу;
способность рассеивать свет во все
стороны при рассматривании растворов в отраженном свете (образуется характерный конус Тиндаля);
мицеллы в коллоидном растворе находятся в хаотическом движении, для них характерно броуновское движение;
седиментационно устойчивые системы;
агрегативно и термодинамически существующие благодаря стабилизации за счет возникновения двойного электрического слоя.
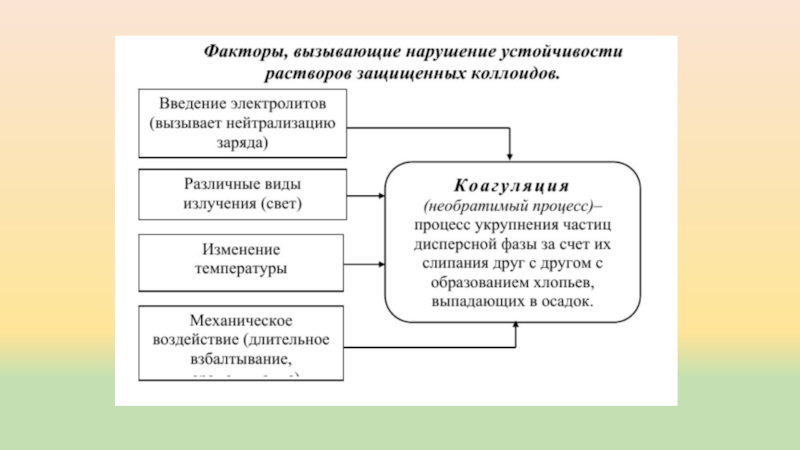
Слайд 11Устойчивость коллоидных растворов
Различают кинетическую и агрегатную устойчивость коллоидных систем.
Кинетическая устойчивость связана
со способностью частиц дисперсной фазы к самопроизвольному тепловому движению в
растворе, которое известно под названием броуновского движения. Такое хаотичное движение частиц препятствует их соединению. Обычно коллоидные растворы кинетически устойчивы, и разрушение их наступает только после того, как нарушается агрегатная устойчивость раствора.Агрегатная устойчивость обусловлена тем, что на поверхности коллоидных частиц имеет место адсорбции ионов (молекул) из окружающей среды.
Вещество, адсорбирующееся на ядрах частиц и повышающее устойчивость коллоидных растворов, называется стабилизатором.
Слайд 13Применение в промышленности и жизни
Коллоидными растворами являются клеи и краски
Всевозможные
коллоидные системы, преимущественно аэрозоли, нашли применение в промышленности
В таких отраслях,
как мыловаренная, маргариновая, фармацевтическая, парфюмерная, производство пластмасс, искусственного волокна и многих других применяются коллоидные растворыКоллоиды - это сырьё для резиново-бумажной, кондитерской, текстильной промышленности