Слайд 1Коллоквиум 1
Аминокислоты
Пептиды
Белки
Липиды
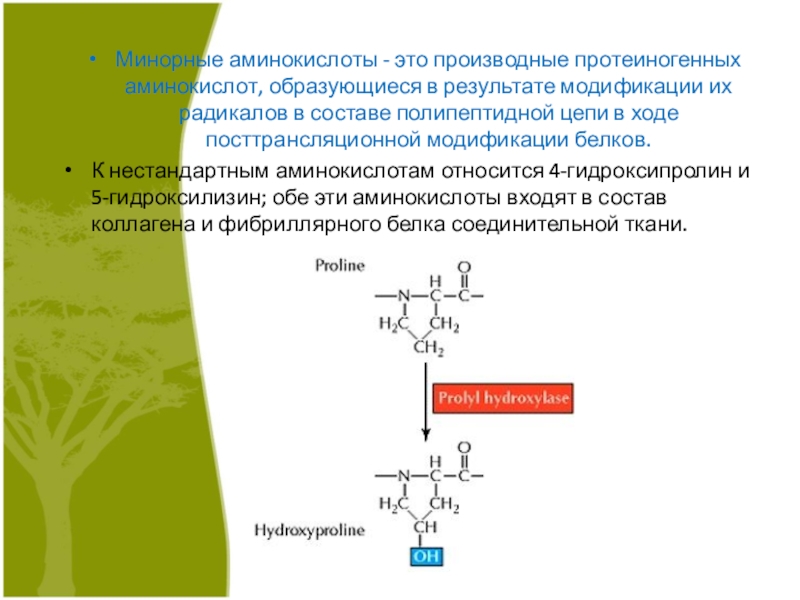
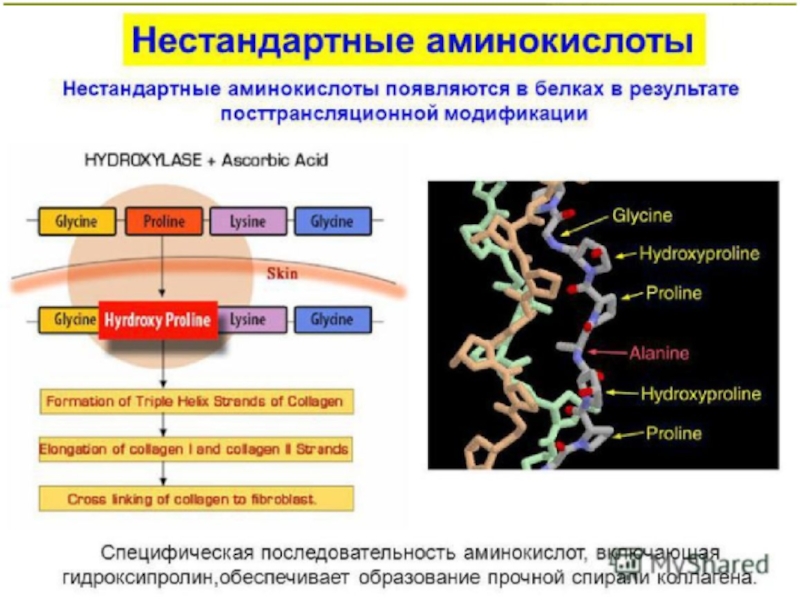
Слайд 2Минорные аминокислоты - это производные протеиногенных аминокислот, образующиеся в результате
модификации их радикалов в составе полипептидной цепи в ходе посттрансляционной
модификации белков.
К нестандартным аминокислотам относится 4-гидроксипролин и 5-гидроксилизин; обе эти аминокислоты входят в состав коллагена и фибриллярного белка соединительной ткани.
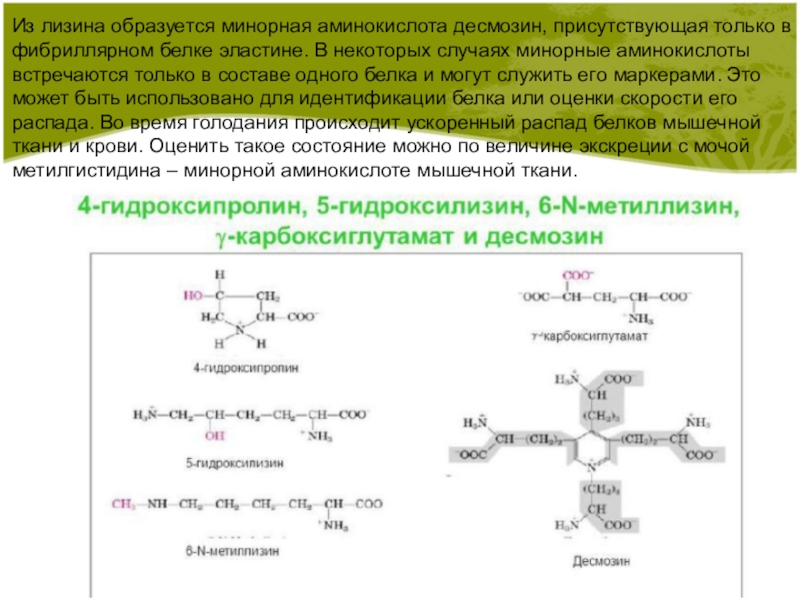
Слайд 4Из лизина образуется минорная аминокислота десмозин, присутствующая только в фибриллярном
белке эластине. В некоторых случаях минорные аминокислоты встречаются только в
составе одного белка и могут служить его маркерами. Это может быть использовано для идентификации белка или оценки скорости его распада. Во время голодания происходит ускоренный распад белков мышечной ткани и крови. Оценить такое состояние можно по величине экскреции с мочой метилгистидина – минорной аминокислоте мышечной ткани.
Слайд 5Многие непротеиногенные аминокислоты заслуживают внимания, потому что они есть;
- промежуточные
продукты в биосинтезе,
- посттрансляционно образуется в белках,
- обладают физиологической ролью
(например, компоненты стенок бактериальных клеток , нейротрансмиттеры и токсины ),
- натуральные или искусственные фармакологические соединения,
- присутствует в метеоритах и в экспериментах с пребиотиками (например, в эксперименте Миллера – Юри).
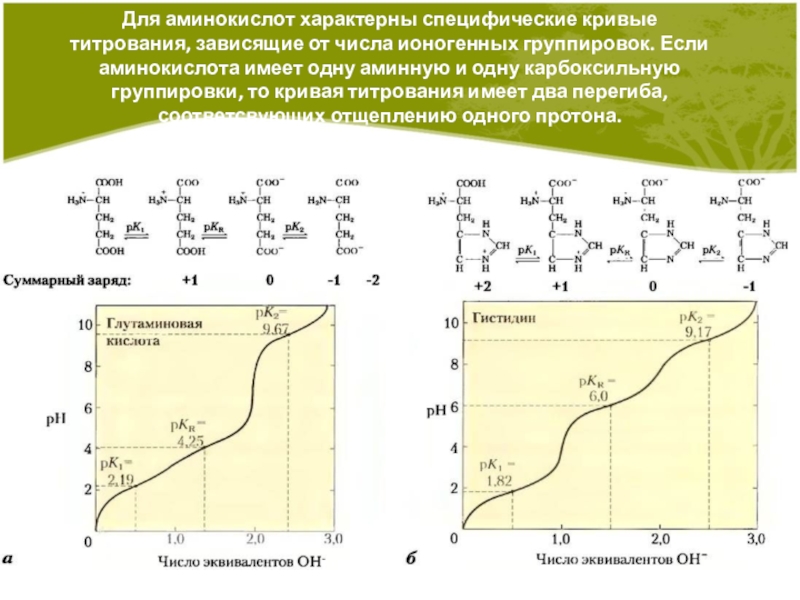
Слайд 6Для аминокислот характерны специфические кривые титрования, зависящие от числа ионогенных
группировок. Если аминокислота имеет одну аминную и одну карбоксильную группировки,
то кривая титрования имеет два перегиба, соответсвующих отщеплению одного протона.
Слайд 7Сло́жные белки́ (протеиды, холопротеины) — двухкомпонентные белки, в которых помимо
пептидных цепей (простого белка) содержится компонент неаминокислотной природы — простетическая
группа. При гидролизе сложных белков, кроме аминокислот, освобождается небелковая часть или продукты её распада.
В качестве простетической группы могут выступать различные органические (липиды, углеводы) и неорганические (металлы) вещества.
В зависимости от химической природы простетических групп среди сложных белков выделяют следующие классы:
Гликопротеиды, содержащие в качестве простетической группы ковалентно связанные углеводные остатки и их подкласс — протеогликаны, с мукополисахаридными простетическими группами. В образовании связи с углеводными остатками обычно участвуют гидроксильные группы серина или треонина. Большая часть внеклеточных белков, в частности, иммуноглобулины — гликопротеиды. В протеогликанах углеводная часть составляет ~95 %, они являются основным компонентом межклеточного матрикса.
Липопротеиды, содержащие в качестве простетической части нековалентно связанные липиды. Липопротеиды, образованные белками-аполипопротеинами связывающимися с ними липидами и выполняют функцию транспорта липидов.
Металлопротеины, содержащие негемовые координационно связанные ионы металлов. Среди металлопротеидов есть белки, выполняющие депонирующие и транспортные функции (например, железосодержащие ферритин и трансферрин) и ферменты (например, цинксодержащая карбоангидраза и различные супероксиддисмутазы, содержащие в качестве активных центров ионы меди, марганца, железа и других металлов)
Нуклеопротеины, содержащие нековалентно связанные ДНК или РНК, в частности, хроматин, из которого состоят хромосомы, является нуклеопротеидом[2].
Фосфопротеиды, содержащие в качестве простетической группы ковалентно связанные остатки фосфорной кислоты. В образовании сложноэфирной связи с фосфатом участвуют гидроксильные группы серина или треонина, фосфопротеинами являются, в частности, казеин молока[3]:
Хромопротеиды — собирательное название сложных белков с окрашенными простетическими группами различной химической природы. К ним относится множество белков с металлосодержащей порфириновой простетической группой, выполняющие разнообразные функции — гемопротеины (белки, содержащие в качестве простетической группы гем — гемоглобин, цитохромы и др.), хлорофиллы; флавопротеиды с флавиновой группой, и др.

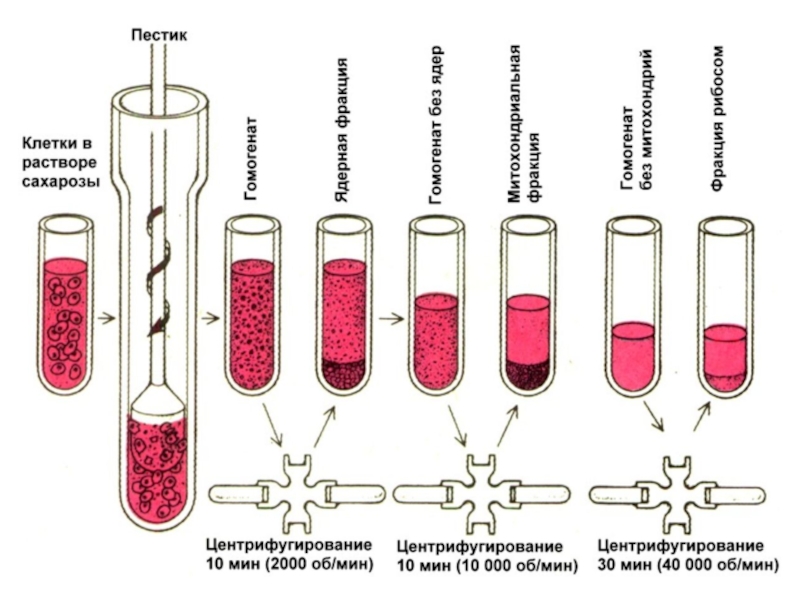
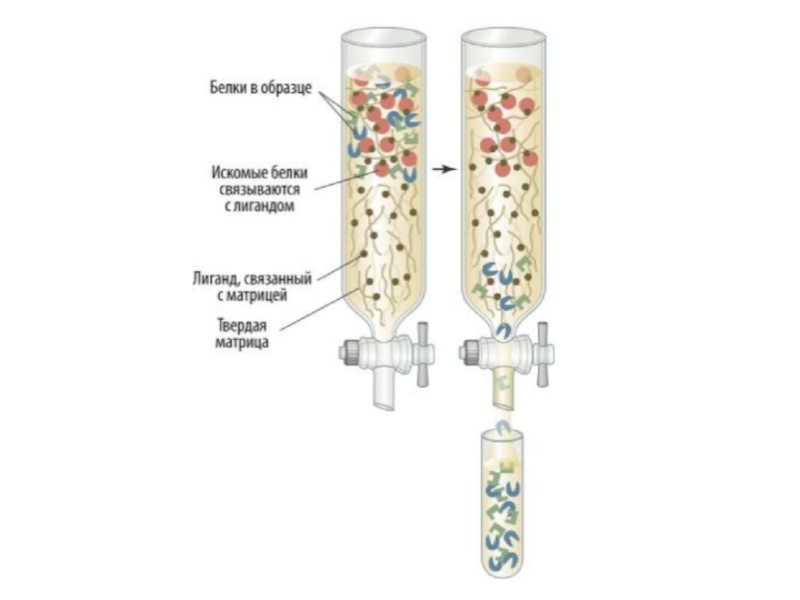
Слайд 21Коло́ночная хроматография часто используется для разделения смеси белков (фракционирования). В
цилиндрическую колонку, наполненную нерастворимым материалом или синтетическими гранулами («стационарная» фаза),
наливают растворитель, затем раствор белка и вымывают его с помощью элюе́нта («мобильная фаза»). Элюент может быть тем же растворителем, однако его можно и заменить более полярным раствором для ускорения процесса. При этом элюент будет конкурировать с белками за матрицу, связываясь с ней прочнее, а белки — двигаться вниз. По мере продвижения всего раствора белков через колонку внизу собирают элюат́ (жидкость, выделяющаяся из колонки). Скорость, с которой белки продвигаются через твёрдую матрицу (стационарную фазу) зависит от тех взаимодействий, в которые они вступают с ней. Различные белки элюируют с разной скоростью. Как правило, более полярные белки дольше задерживаются в колонке, поскольку между ними и матрицей образуются нековалентные химические связи. Концентрация белка в каждой фракции может быть измерена с помощью пропускания через раствор УФ-света с длиной волны 280 нм (фотометри́я). Чтобы понять, в какой именно фракции находится очищаемый белок, фракции проверяют на биологическую активность (особенно актуально для ферментов, т.е. к ним добавляют их субстрат, и определяют, появился ли в среде продукт, так делают вывод о наличии фермента во фракции).

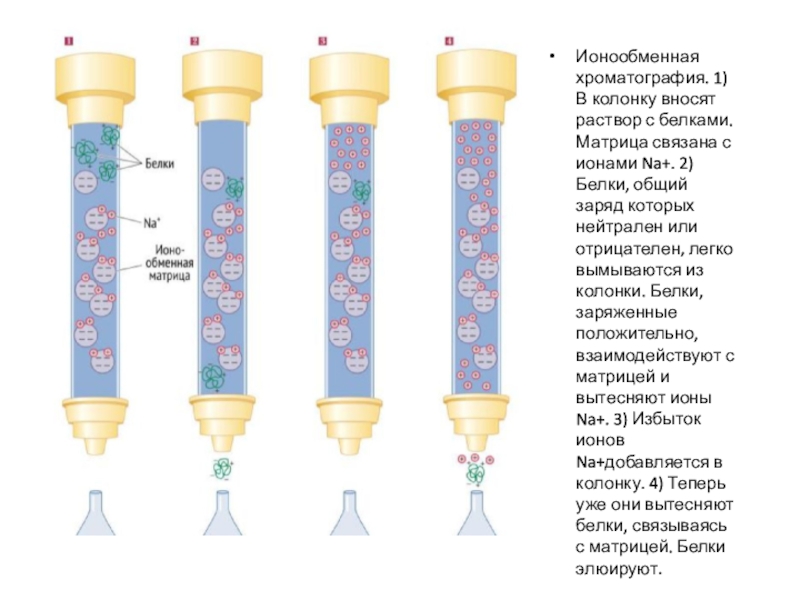
Слайд 24В ионообменной хроматографии матрица заряжена положительно (анионообменная) или отрицательно (катионообменная).
Анионообменная
матрица связывает отрицательно заряженные белки и задерживает их в колонке
для последующего элюирования. Схожим образом, катионообменная матрица взаимодействует с положительно заряженными белками. Связанные с матрицей белки могут быть элюированы (вымыты из колонки) постепенным повышением концентрации соли в растворе. Когда концентрация солей достигнет нужной отметки, соли будут прочнее и быстрее связываться с матрицей (соли тоже имеют заряд), тем самым взаимодействие белков с твердой фазой будет нарушено, и они будут элюированы из колонки.
Слайд 25Ионообменная хроматография. 1) В колонку вносят раствор с белками. Матрица
связана с ионами Na+. 2) Белки, общий заряд которых нейтрален
или отрицателен, легко вымываются из колонки. Белки, заряженные положительно, взаимодействуют с матрицей и вытесняют ионы Na+. 3) Избыток ионов Na+добавляется в колонку. 4) Теперь уже они вытесняют белки, связываясь с матрицей. Белки элюируют.
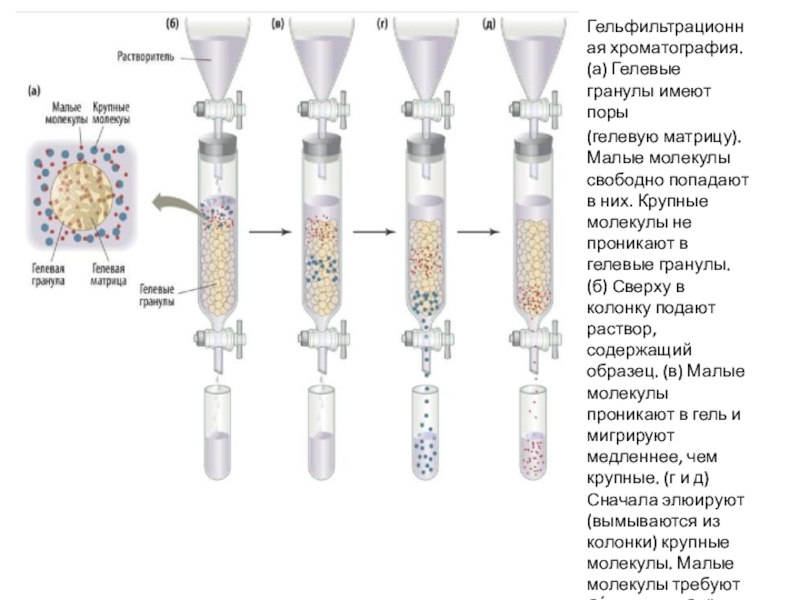
Слайд 26Гельфильтрационная (или эксклюзионная) хроматография разделяет белки на основании их размера.
Матрицей служит особый пористый гель. Малые белки проникают в поры
геля и задерживаются там. Большие белки в поры не попадают и потому быстро минуют стационарную фазу, слабо контактируя с ней. Чем меньше размер белка, тем позднее он вымывается из колонки. Большие белки элюируются быстрее.
Слайд 27Гельфильтрационная хроматография. (а) Гелевые гранулы имеют поры
(гелевую матрицу). Малые молекулы
свободно попадают в них. Крупные молекулы не проникают в гелевые
гранулы. (б) Сверху в колонку подают раствор, содержащий образец. (в) Малые молекулы проникают в гель и мигрируют медленнее, чем крупные. (г и д) Сначала элюируют (вымываются из колонки) крупные молекулы. Малые молекулы требуют бо́ льшего объёма растворителя.