Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
КОМПЛЕКСНЫЕ СОЕДИНЕНИЯ ЛЕКЦИЯ
Содержание
- 1. КОМПЛЕКСНЫЕ СОЕДИНЕНИЯ ЛЕКЦИЯ
- 2. Комплексными соединениями называют соединения, имеющие в своем составе комплексные ионы.
- 3. Состав и строение комплексных соединений
- 4. Координационная теория А.ВернераВ 1893 г. швейцарским химиком-
- 5. Основные положения координационной теории1. Внутренняя сфера комплексного
- 6. Основные положения координационной теории2. Комплексообразователь (центральный ион)
- 7. Основные положения координационной теории3. Лиганды – частицы
- 8. Основные положения координационной теории4. Общее число лигандов,
- 9. Основные положения координационной теорииВыделяют:Монодентатные лиганды - координационная
- 10. Основные положения координационной теории5. Внешняя сфера комплексного
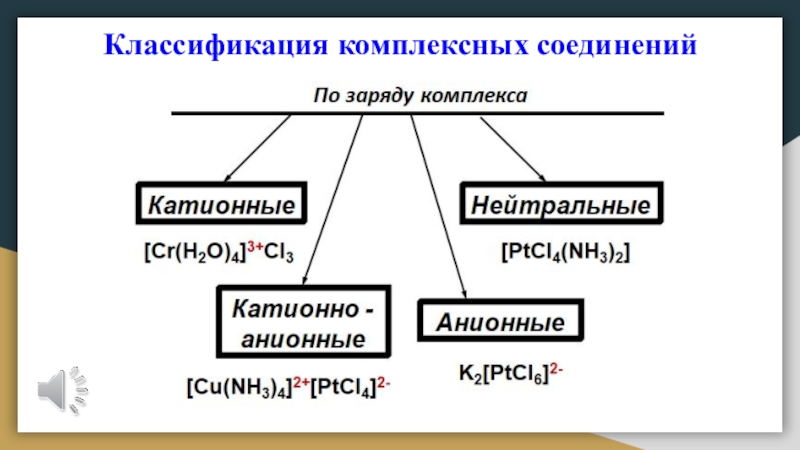
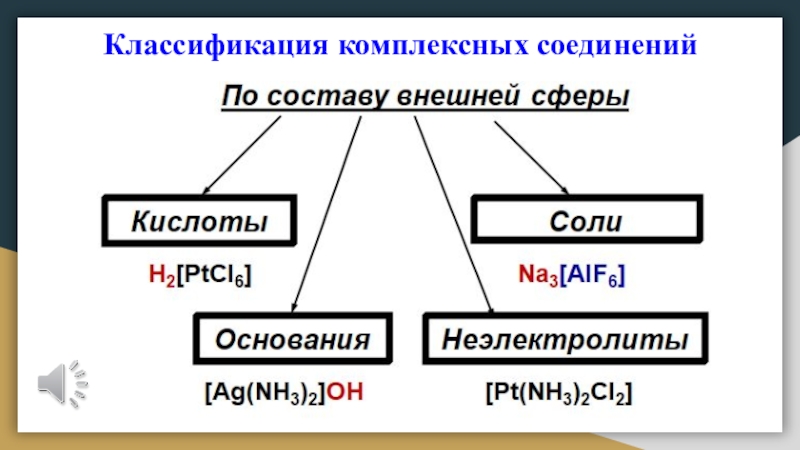
- 11. Классификация комплексных соединений
- 12. Классификация комплексных соединений
- 13. Классификация комплексных соединений
- 14. Классификация комплексных соединений
- 15. Классификация комплексных соединений
- 16. Номенклатура комплексных соединений
- 17. Номенклатура комплексных соединений1. Первым называют катион, затем
- 18. Номенклатура комплексных соединений3.1. Нейтральные лиганды называют без
- 19. 3.2. К названиям отрицательно заряженных лигандов прибавляют
- 20. Номенклатура комплексных соединений4. Если одинаковых лигандов в
- 21. Номенклатура комплексных соединений5. Название комплексообразователя зависит от
- 22. Номенклатура комплексных соединений6. В катионных и анионных
- 23. Например:катионный комплекс[Pt4+(Br)2(H2O)4]2+ - тетрааквадибромоплатина (IV)анионный комплекс[Fe3+(Cl)5(NH3)]2– -
- 24. Устойчивость комплексных соединений
- 25. Устойчивость комплексных соединенийВ растворах комплексные соединения диссоциируют.
- 26. Устойчивость комплексных соединенийб) Вторичная диссоциация – это
- 27. Устойчивость комплексных соединенийУстойчивость комплексных ионов характеризуется константой
- 28. Устойчивость комплексных соединенийКонстанта нестойкости характеризует термодинамическую устойчивость
- 29. СПАСИБО ЗА ВНИМАНИЕ!
- 30. Скачать презентанцию
Комплексными соединениями называют соединения, имеющие в своем составе комплексные ионы.
Слайды и текст этой презентации
Слайд 4Координационная теория А.Вернера
В 1893 г. швейцарским химиком- неоргаником Альфредом Вернером
была сформулирована теория, позволившая понять строение и некоторые свойства комплексных
соединений и названная координационной теорией.
Альфред Вернер
(1866 - 1919)
Слайд 5Основные положения координационной теории
1. Внутренняя сфера комплексного соединения включает центральный
атом или ион-комплексообразователя, вокруг которого находятся связанные с ним лиганды
– молекулы или ионы.[Co(NH3)6]3+
Слайд 6Основные положения координационной теории
2. Комплексообразователь (центральный ион) - катион металла,
который обладает вакантными орбиталями.
Типичными комплексообразователями являются:
атомы или ионы d-элементов,
имеющие свободные орбитали (Со3+, Cu2+, Cu+, Fe3+, Pt2+ и др.);реже р-элементы (Al+3);
иногда неметаллы (В+3, Si+4).
Слайд 7Основные положения координационной теории
3. Лиганды – частицы (молекулы и ионы),
координируемые комплексообразователем и имеющие с ним непосредственно химические связи.
Лигандами могут
быть: кислотные остатки (Cl–, Br–, J–, NO2–, CN–, SO42– и др.);
нейтральные, полярные молекулы (Н2О, NH3, CO);
гидроксо-группы (ОН–).
Слайд 8Основные положения координационной теории
4. Общее число лигандов, связанных с комплексообразователем
определяется его координационным числом (координационной ёмкостью).
Величина координационного числа зависит
от:природы комплексообразователя и лигандов;
от условий комплексообразования (концентрации, температуры и др.).
Слайд 9Основные положения координационной теории
Выделяют:
Монодентатные лиганды - координационная ёмкость = 1
Cl–,
Br–, J–, NO2–, CN–,NH3 и др.
Бидентатные лиганды - координационная ёмкость
= 2SO42–, СO32–, С2O42–, En и др.
Полидентатные лиганды - координационная ёмкость = 3, 4, 6
Слайд 10Основные положения координационной теории
5. Внешняя сфера комплексного соединения – это
совокупность ионов, непосредственно не связанных с центральным атомом и удерживаемых
около внутренней сферы электростатическими силами.Слайд 17Номенклатура комплексных соединений
1. Первым называют катион, затем анион. Название комплекса
пишут в одно слово.
2. В названии комплекса сначала перечисляют лиганды,
затем центральный ион.1.
Слайд 18Номенклатура комплексных соединений
3.1. Нейтральные лиганды называют без изменения:
Н2О –
аква
NH3 – аммин
СО – карбонил
NO – нитрозил
Н2N-CH2-CH2-NH2 – этилендиаммин (En)
Слайд 193.2. К названиям отрицательно заряженных лигандов прибавляют окончание “О”:
ОН– -
гидроксо
NO2– - нитро
NO3– - нитрато
Cl– - хлоро
Вr– - бромо
J– -
иодоCN– - циано
SCN– - родано
Слайд 20Номенклатура комплексных соединений
4. Если одинаковых лигандов в комплексе несколько, то
перед их названием употребляют соответствующее греческое числительное.
1-моно, 2-ди, 3-три,
4-тетра, 5-пента, 6-гекса…1.
Слайд 21Номенклатура комплексных соединений
5. Название комплексообразователя зависит от заряда комплекса:
в нейтральном
и катионном комплексах комплексообразователь называют на русском языке в именительном
падеже;в анионном комплексе - на латинском языке с суффиксом “-ат”.
1.
Слайд 22Номенклатура комплексных соединений
6. В катионных и анионных комплексах римской цифрой
в скобках в названии указывают степень окисления комплексообразователя.
В нейтральных
комплексах НЕ указывают степень окисления комплексообразователя.1.
Слайд 23Например:
катионный комплекс
[Pt4+(Br)2(H2O)4]2+ - тетрааквадибромоплатина (IV)
анионный комплекс
[Fe3+(Cl)5(NH3)]2– - амминпентахлороферрат (III)
нейтральный комплекс
[Co3+(Br)3(CO)3]0
– трикарбонилтрибромокобальт
Слайд 25Устойчивость комплексных соединений
В растворах комплексные соединения диссоциируют.
Различают первичную и
вторичную диссоциацию.
а) Первичная диссоциация – это диссоциация комплексной соли на
внутреннюю сферу и ионы внешней сферы.Например:
диамминсеребро(I) хлорид
1.
Слайд 26Устойчивость комплексных соединений
б) Вторичная диссоциация – это диссоциация внутренней сферы
на ионы.
Она протекает незначительно.
Например:
1.
Слайд 27Устойчивость комплексных соединений
Устойчивость комплексных ионов характеризуется константой нестойкости (Кнест), которая
равна отношению произведения концентраций продуктов вторичной диссоциации к концентрации комплексных
ионов, например:1.
Слайд 28Устойчивость комплексных соединений
Константа нестойкости характеризует термодинамическую устойчивость комплекса, которая зависит
от прочности связей между центральным атомом и лигандами.
Мерой прочности комплексного
соединения является энергия разрыва связей, характеризующаяся изменением энергии Гиббса (∆G) в результате вторичной диссоциации. Эта зависимость выражается уравнением изотермы:
∆G0 = –RT∙ln Kнест или ∆G0 = –2,303RT∙lg Kнест
1.




















![КОМПЛЕКСНЫЕ СОЕДИНЕНИЯ
ЛЕКЦИЯ Например:катионный комплекс[Pt4+(Br)2(H2O)4]2+ - тетрааквадибромоплатина (IV)анионный комплекс[Fe3+(Cl)5(NH3)]2– - амминпентахлороферрат (III)нейтральный комплекс[Co3+(Br)3(CO)3]0 – Например:катионный комплекс[Pt4+(Br)2(H2O)4]2+ - тетрааквадибромоплатина (IV)анионный комплекс[Fe3+(Cl)5(NH3)]2– - амминпентахлороферрат (III)нейтральный комплекс[Co3+(Br)3(CO)3]0 – трикарбонилтрибромокобальт](/img/tmb/7/654377/056ce29339bf0da7e22a5f8e4ab9dfd2-800x.jpg)

























