Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
КОРРОЗИЯ МЕТАЛЛОВ И СПОСОБЫ ЗАЩИТЫ ОТ НЕЕ
Содержание
- 1. КОРРОЗИЯ МЕТАЛЛОВ И СПОСОБЫ ЗАЩИТЫ ОТ НЕЕ
- 2. Слайд 2
- 3. Химический энциклопедический словарьКОРРОЗИЯ МЕТАЛЛОВ – физико-химическое
- 4. Слайд 4
- 5. Слайд 5
- 6. Коррозия от лат. «corrodo» – «грызу» (позднелатинское
- 7. Слайд 7
- 8. Слайд 8
- 9. Слайд 9
- 10. Слайд 10
- 11. Слайд 11
- 12. Слайд 12
- 13. Слайд 13
- 14. Многие металлы (например, алюминий) при коррозии покрываются
- 15. Слайд 15
- 16. Коррозия происходит в токопроводящей среде (в электролите)
- 17. Разрушение железного образца в присутствии примеси олова.
- 18. В щелочной или нейтральной среде:Fe 0 –
- 19. Слайд 19
- 20. Слайд 20
- 21. Катионы водорода и растворенный кислород- важнейшие
- 22. Слайд 22
- 23. Слайд 23
- 24. Слайд 24
- 25. Слайд 25
- 26. Слайд 26
- 27. Слайд 27
- 28. Слайд 28
- 29. Слайд 29
- 30. Слайд 30
- 31. Скачать презентанцию
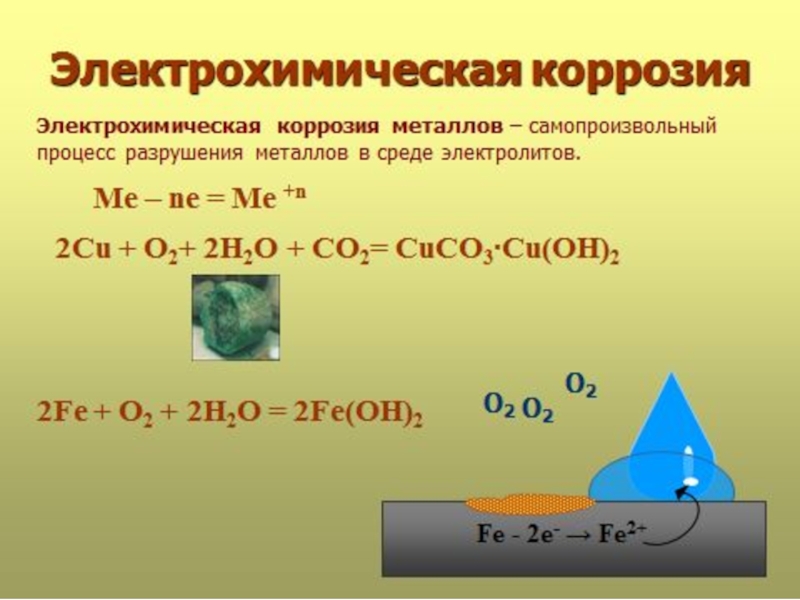
Химический энциклопедический словарьКОРРОЗИЯ МЕТАЛЛОВ – физико-химическое или химическое взаимодействие между металлом (сплавом) и средой, приводящее к ухудшению функциональных свойств металла (сплава), среды или включающей их технической системы.
Слайды и текст этой презентации
Слайд 3Химический
энциклопедический словарь
КОРРОЗИЯ МЕТАЛЛОВ – физико-химическое или химическое взаимодействие между
Слайд 6Коррозия от лат. «corrodo» – «грызу» (позднелатинское «corrosio» означает «разъедание»).
Вызывается химической реакцией металла с веществами окружающей среды, протекающей на
границе металла и среды. Чаще всего это окисление металла, например, кислородом воздуха или кислотами, содержащимися в растворах, с которыми контактирует металл. Особенно подвержены этому металлы, расположенные в ряду напряжений (ряду активности) левее водорода, в том числе железо.Слайд 14Многие металлы (например, алюминий) при коррозии покрываются плотной, оксидной пленкой,
которая не позволяет окислителям проникнуть в более глубокие слои и
потому предохраняет металл от коррозии. При удалении этой пленки металл начинает взаимодействовать с влагой и кислородом воздуха.Слайд 16Коррозия происходит в токопроводящей среде (в электролите) с возникновением внутри
системы электрического тока.
Металлы не однородны и содержат различные примеси.
При контакте их с электролитами одни участки поверхности выполняют роль- анодов, другие- катодов.Слайд 17Разрушение железного образца в присутствии примеси олова.
В кислой среде:
На железе, как более активном металле, при соприкосновении с электролитом
происходят процессы окисления (растворения) металла и перехода его катионов в электролит:Fe0 – 2 e = Fe 2+ (анод)
На катоде (олово) происходит восстановление катионов водорода:
2H+ + 2e → H20
Ржавчина не образуется, т.к. ионы железа (Fe 2+) переходят в раствор
Слайд 18В щелочной или нейтральной среде:
Fe 0 – 2e →Fe 2+
(на аноде)
O20 + 2H2O + 4e →4OH – (на
катоде)Fe 2+ + 2 OH - →Fe(OH)2
4 Fe (OH)2 + O2 + 2H2O = 4 Fe (OH)3
( ржавчина)