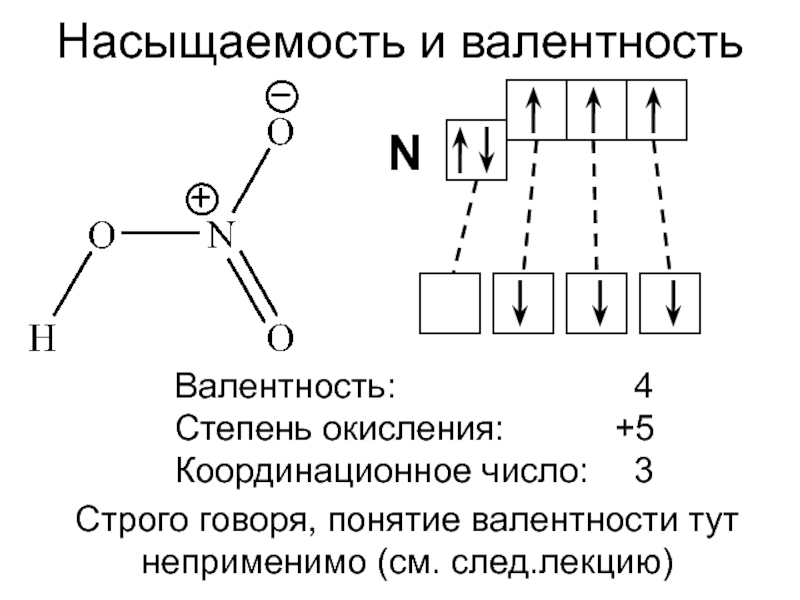
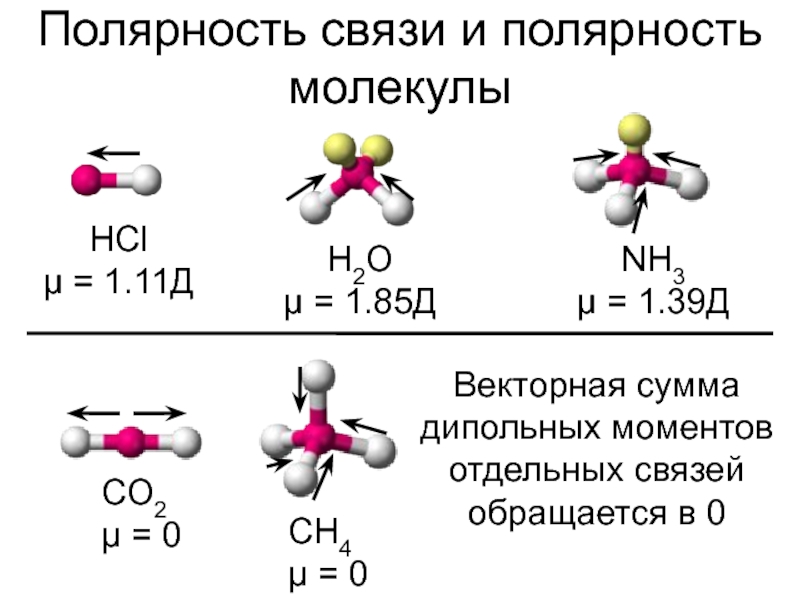
полярная и неполярная
Полярность связи определяется ЭО атомов, образующих ее! (подробнее
см. предыдущую лекцию)Откуда берутся электроны – неважно!
H+–Cl– – обозначение полярности


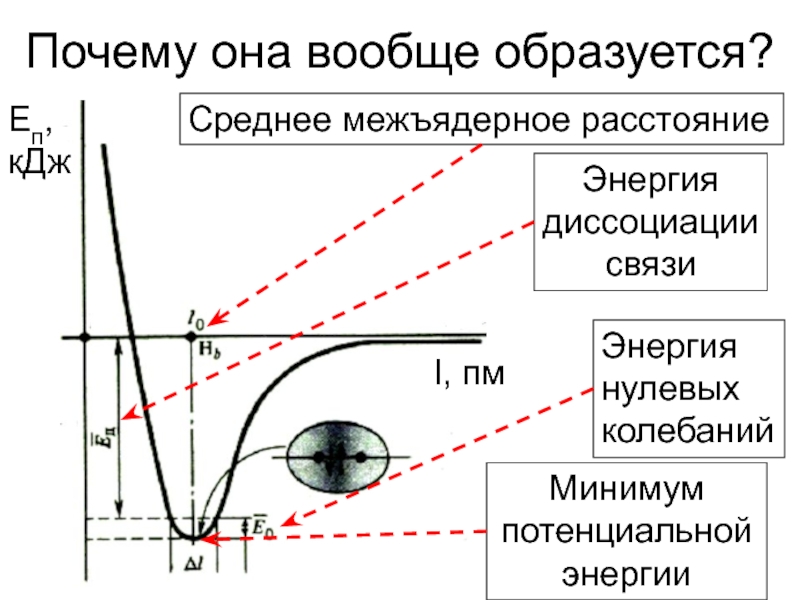
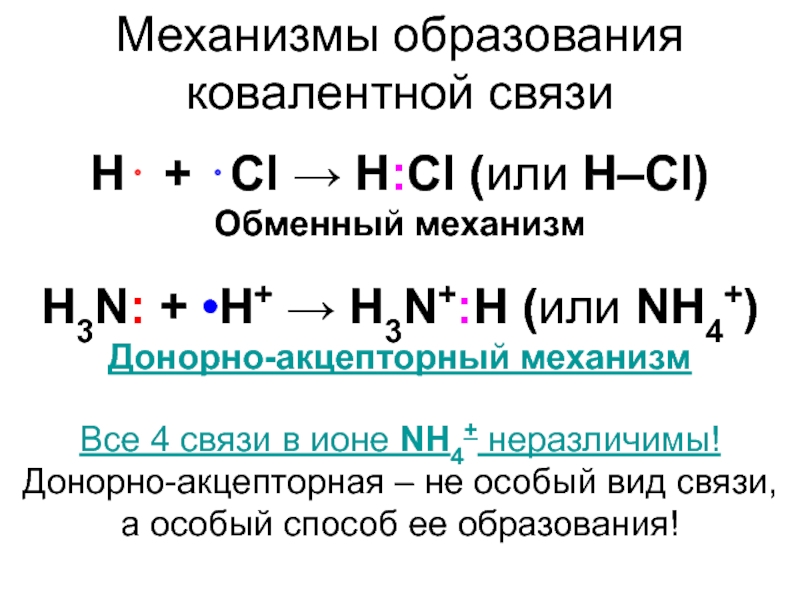


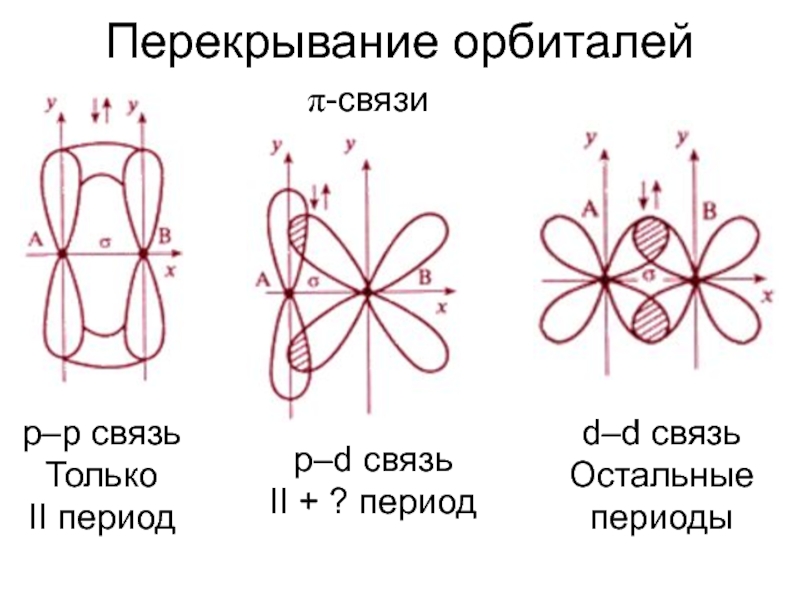
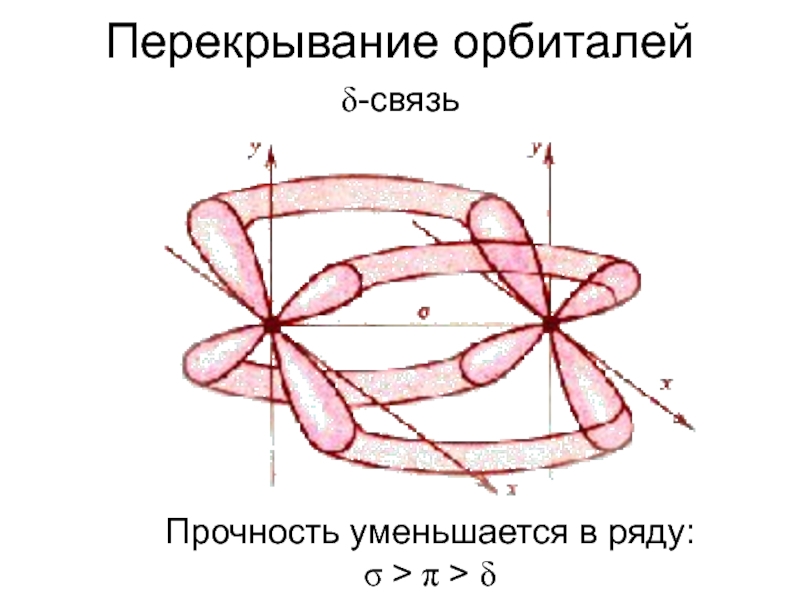
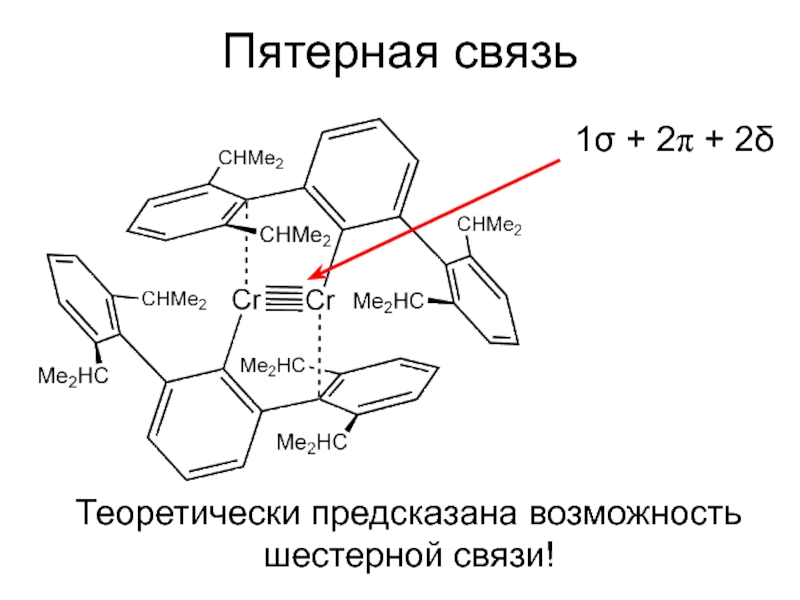
![Ковалентная связь Кратность связи и способ перекрывания орбиталейВ ионе [Re2Cl8]2– между атомами Re Кратность связи и способ перекрывания орбиталейВ ионе [Re2Cl8]2– между атомами Re четверная связь (σ + 2 π](/img/thumbs/90f61367abb3a8f3a3c2e62cd56e8ed7-800x.jpg)