Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Кружок Основы молекулярной генетики
Содержание
- 1. Кружок Основы молекулярной генетики
- 2. Слайд 2
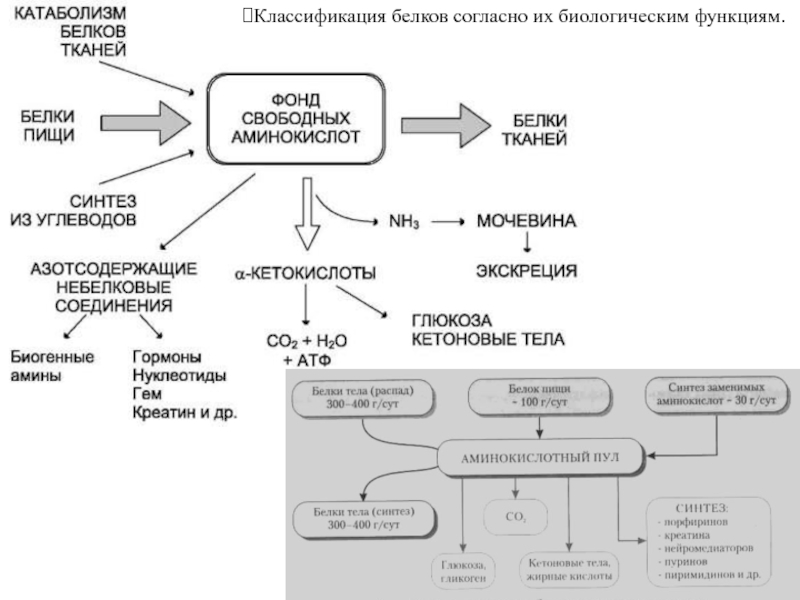
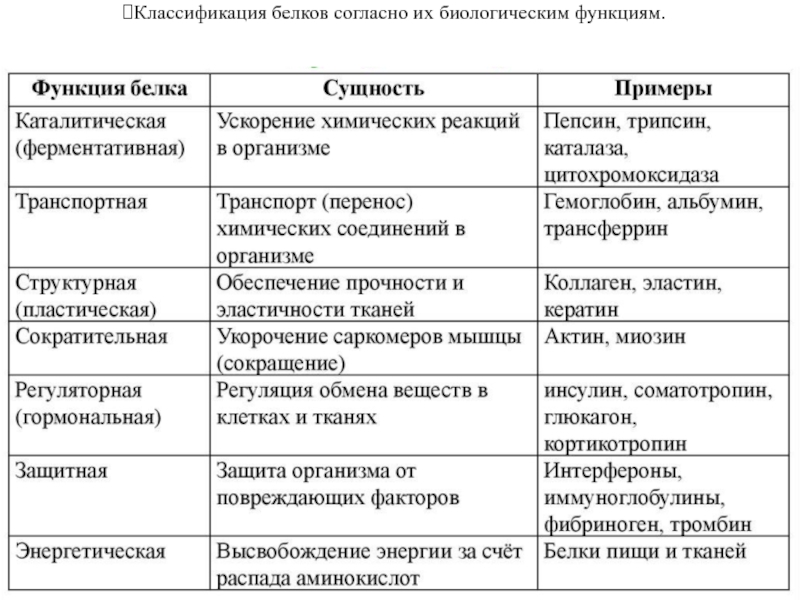
- 3. Классификация белков согласно их биологическим функциям.
- 4. Классификация белков согласно их биологическим функциям.
- 5. Классификация белков согласно их биологическим функциям. Состав
- 6. Классификация белков согласно их биологическим функциям. Важнейшие транспортные белки плазмы крови
- 7. Понятие о ферментах Ферменты – белковые катализаторы
- 8. Высокая эффективность ферментативного катализа2Н2О2 → 2Н2О +
- 9. Структура фермента: активный центр Активный центр фермента
- 10. Схема строения активного центраСубстрат (S) – вещество,
- 11. Связывание субстрата в активном центре фермента
- 12. Итак, высокая каталитическая эффективность ферментов обусловленаВысокой специфичностью
- 13. Специфичность ферментовКаталитическая (реакционная) специфичность – способность фермента
- 14. Специфичность ферментовСубстратная специфичность – способность фермента взаимодействовать
- 15. Сложные ферментыБелок (апофермент) + кофактор (кофермент) →
- 16. КофакторыПо химической природе:неорганические вещества (ионы металлов)органические вещества
- 17. Кофакторы – ионы металлов: способы участия в
- 18. Cu, Zn-супероксиддисмутаза (СОД)Zn необходим для стабилизации молекулыCu
- 19. Коферменты, обратимо связанные с апоферментомNAD+ , NADP+
- 20. Кинетика ферментативного катализа: условия протекания ферментативных реакцийАктивность
- 21. Факторы, определяющие активность фермента (скорость реакции)Количество ферментаКоличество
- 22. Скорость реакции и температураВлияние температуры обусловлено броуновским
- 23. Скорость реакции и рНВлияние рН обусловлено изменением
- 24. Скорость реакции и концентрация субстратаКонстанта Михаэлиса (концентрация
- 25. Скорость реакции и концентрация субстратаЗависимость скорости реакции
- 26. Активаторы ферментовАктиваторы – вещества, повышающие каталитическую активность
- 27. Ингибиторы ферментовИнгибиторы – вещества, снижающие каталитическую активность
- 28. Неконкурентное ингибированиеИнгибитор связывается не с активным центромОбразуется
- 29. Регуляция активности ферментов – основа регуляции метаболических
- 30. Изменение количества ферментаРегуляция на уровне транскрипции: индукция
- 31. Конститутивные ферменты – ферменты, которые синтезируются постоянно,
- 32. Механизмы регуляция каталитической активности ферментовВзаимодействие с белком-активаторомАссоциация и диссоциация протомеровФосфорилирование и дефосфорилированиеЧастичный протеолизАллостерическая регуляция
- 33. Взаимодействие с белком-активаторомФермент переваривания пищевого жира в
- 34. Ассоциация-диссоциация протомеров
- 35. Фосфорилирование -дефосфорилирование
- 36. Частичный протеолизИзменение первичной структуры белкаИзменение конформации молекулы, формирование активного центраНеобратимая регуляция
- 37. Аллостерическая регуляция
- 38. Аллостерические ферментыОлигомерные белки (2 и более субъединиц)Имеют
- 39. ЗаключениеОснова физиологических процессов – биохимические реакцииСкорость биохимических
- 40. Классификация белков согласно их биологическим функциям.
- 41. Понятие о прионных заболеваниях. Процессы нейродегенерации, вызванной прионами. Сверху: накопление
- 42. Слайд 42
- 43. Слайд 43
- 44. Протео́мика (англ. Proteomics) — область молекулярной биологии, посвящённая
- 45. Скачать презентанцию
Слайды и текст этой презентации
Слайд 1Кружок «Основы молекулярной генетики»
Классификация белков согласно их биологическим функциям.
Белки-переносчики,
сигнальные, защитные, структурные, рецепторные, регуляторные, ферменты.
о протеомике.Слайд 5Классификация белков согласно их биологическим функциям.
Состав плазмы
ЛПОНП — липопротеиды
очень низкой плотности; ЛППП — липопротеиды промежуточной плотности; ЛПНП —
липопротеиды низкой плотности;ЛПВП — липопротеиды высокой плотности.
Слайд 6Классификация белков согласно их биологическим функциям.
Важнейшие транспортные белки плазмы
крови
Слайд 7Понятие о ферментах
Ферменты – белковые катализаторы химических реакций в
живом организме
состоят из L-α-аминокислот, соединенных пептидными связями
имеют 4 уровня организации
молекулхарактерна конформационная лабильность
при денатурации теряют активность
синтезируются как белковые молекулы
И.П. Павлов: переваривающая способность желудочного сока зависит от количества белка в нем (отсюда следует, что пепсин – белок)
Классификация белков согласно их биологическим функциям.
Ферментативная (каталитическая) функция
Слайд 8Высокая эффективность ферментативного катализа
2Н2О2 → 2Н2О + О2
самопроизвольно (Еа =
70 кДж/моль)
при участии железа (Еа = 42 кДж/моль), скорость реакции
увеличивается в 103 разв присутствии каталазы (Еа = 7 кДж/моль), скорость реакции увеличивается в 1010 раз
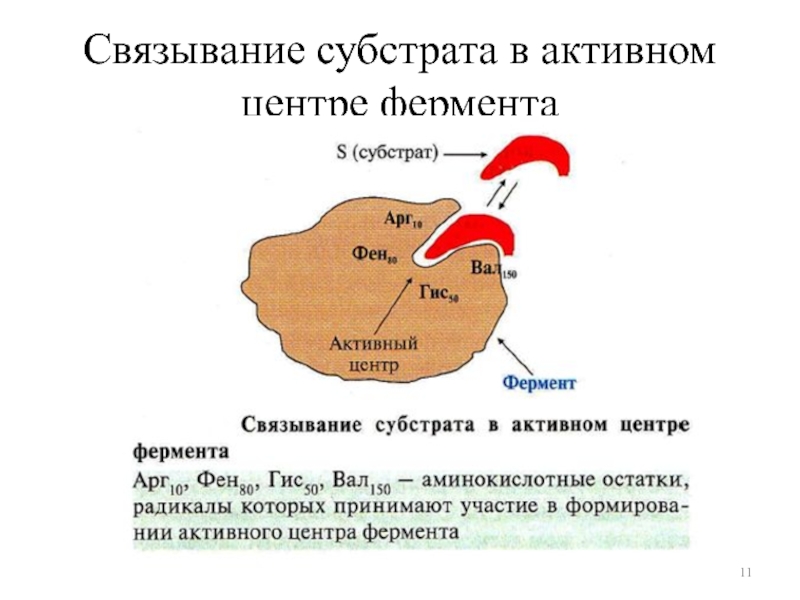
Слайд 9Структура фермента: активный центр
Активный центр фермента (АЦ) – это
участок молекулы фермента, способный комплементарно (специфически) связываться с субстратом и
обеспечивать его каталитическое превращениеФормируется на уровне III структуры белка
У простых ферментов состоит только из аминокислотных остатков
У сложных ферментов имеет кофактор (кофермент)
Участок связывания активного центра обеспечивает сродство к субстрату и формирование фермент-субстратного комплекса (ES), например, за счет ионных взаимодействий
Каталитический участок активного центра осуществляет химическую реакцию
Слайд 10Схема строения активного центра
Субстрат (S) – вещество, вступающее в ферментативную
реакцию
Субстрат комплементарен АЦ фермента («ключ-замок»)
Продукт (Р) – вещество, которое образуется
в процессе реакцииПродукт не имеет сродства к активному центру фермента
Слайд 12Итак, высокая каталитическая эффективность ферментов обусловлена
Высокой специфичностью связывания АЦ фермента
и субстрата и образованием ES-комплекса
Конформационной лабильностью ферментов, которая является основой
их высокой специфичностиСлайд 13Специфичность ферментов
Каталитическая (реакционная) специфичность – способность фермента катализировать одну химическую
реакцию или один тип реакций
Исключение: лиазы, в одном направлении, катализируют
негидролитическое расщепление субстрата, а в другом – присоединение простой молекулы по кратной связиСлайд 14Специфичность ферментов
Субстратная специфичность – способность фермента взаимодействовать с одним (абсолютная)
или несколькими субстратами со сходным строением и типом связей (относительная,
групповая)абсолютная субстратная специфичность
уреаза: гидролиз мочевины
аргиназа: гидролиз аргинина
относительная субстратная специфичность
пищеварительные ферменты
стереоспецифичность
лактатдегидрогеназа: окисление только L-лактата
Слайд 15Сложные ферменты
Белок (апофермент) + кофактор (кофермент) → активный фермент (холофермент)
апофермент
– не активен
большинство природных ферментов – сложные белки-протеиды
кофактор – небелковая
часть сложного фермента (лат. «вместе делающий»)Слайд 16Кофакторы
По химической природе:
неорганические вещества (ионы металлов)
органические вещества (производные витаминов) -
коферменты
По виду химической связи:
слабые взаимодействия (присутствуют в активом центре фермента
только в момент реакции, являясь косубстратом)ковалентная связь (простетическая группа)
Роль кофактора:
изменение конформации фермента, субстрата
непосредственное участие в реакции
Слайд 17Кофакторы – ионы металлов: способы участия в ферментативном катализе
Изменяют конформацию
субстрата (Mg2+-АТФ)
Стабилизируют конформацию апофермента (Zn2+ стабилизирует IV структуру алкогольдегидрогеназы)
Участвует в
катализе (ионы железа, меди участвуют в переносе электронов)Слайд 18Cu, Zn-супероксиддисмутаза (СОД)
Zn необходим для стабилизации молекулы
Cu – активный участник
в реакции дисмутации супероксид-аниона:
О2 - + О2 - + 2Н+ = Н2О2 + О21) О2 - + Cu2+ + Н+ = Cu1+ + О2
2) О2 - + Cu1+ + Н+ = Cu2+ + Н2О2
Слайд 19Коферменты, обратимо связанные с апоферментом
NAD+ , NADP+ – кофермент оксидоредуктаз
(анаэробных дегидрогеназ), источник синтеза – никотиновая кислота (vit РР, или
В3)HS-CoA (кофермент А) - кофермент ацетил-, ацилтрансфераз, некоторых лигаз, источник синтеза – пантотеновая кислота (vit B5)
тетрагидрофолат (Н4 –фолат) - кофермент трансфераз - переносчиков С1-фрагментов, источник синтеза – фолиевая кислота (vit B9)
Слайд 20Кинетика ферментативного катализа:
условия протекания ферментативных реакций
Активность фермента, или скорость ферментативной
реакции определяется уменьшением количества молекул субстрата или увеличением количества молекул
продукта за единицу времениактивность фермента (1МЕ) = мкмоль (S или P) / мин
1 кат = 6 х 107 МЕ
уд. активность фермента = мкмоль (S или P) / (мин • мг белка)
Слайд 21Факторы, определяющие активность фермента (скорость реакции)
Количество фермента
Количество субстрата
Количество продукта (для
аллостерических ферментов)
Концентрация кофактора (для сложных ферментов)
Присутствие активаторов или ингибиторов
Температура
рН среды
Слайд 22Скорость реакции и температура
Влияние температуры обусловлено броуновским движением молекул (от
нуля до 40 ° С) и денатурацией белка (выше 40°
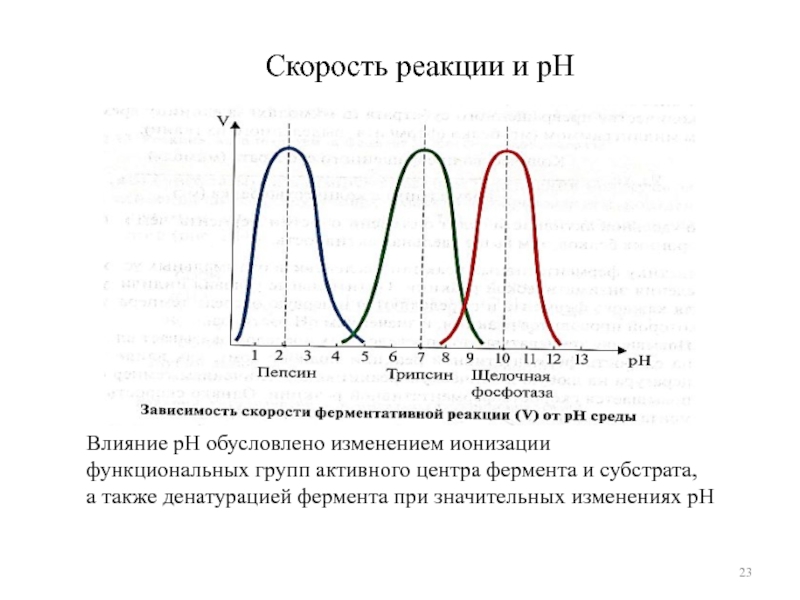
С)Слайд 23Скорость реакции и рН
Влияние рН обусловлено изменением ионизации
функциональных групп активного
центра фермента и субстрата,
а также денатурацией фермента при значительных изменениях
рНСлайд 24Скорость реакции и концентрация субстрата
Константа Михаэлиса (концентрация субстрата, при которой
скорость реакции равна 1/2 от максимальной). Характеризует сродство фермента к
субстрату (чем меньше значение, тем выше сродство). Является величиной постоянной.Слайд 25Скорость реакции и концентрация субстрата
Зависимость скорости реакции от концентрации субстрата
описывает уравнение Михаэлиса и Ментен:
V = V max · [
S] / [ S] + KmОтсюда,
[ S] = Km · V / V max - V
Слайд 26Активаторы ферментов
Активаторы – вещества, повышающие каталитическую активность ферментов
Часто активаторами являются
микро-, макроэлементы
Активаторы не являются кофакторами
Известно, что в присутствии хлорид-ионов активность
амилазы слюны значительно возрастает, а в отсутствии катионов кальция не проявляется. Какую роль в проявлении активности фермента играют кальций и хлор?Слайд 27Ингибиторы ферментов
Ингибиторы – вещества, снижающие каталитическую активность фермента
По типу химической
связи:
обратимые (слабые связи)
необратимые (ковалентная связь)
По механизму действия:
конкурентные
неконкурентные
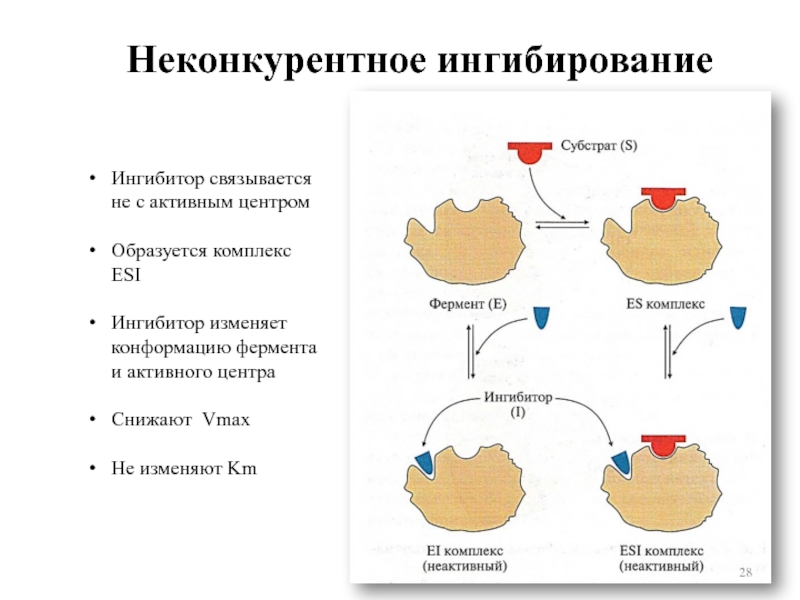
Слайд 28Неконкурентное ингибирование
Ингибитор связывается не с активным центром
Образуется комплекс ESI
Ингибитор изменяет
конформацию фермента и активного центра
Снижают Vmax
Не изменяют Km
Слайд 29Регуляция активности ферментов – основа регуляции метаболических путей
Способы регуляции активности
ферментов:
Изменение количества фермента (индукция или репрессия синтеза)
Изменение каталитической активности фермента
вследствие изменения его конформацииФерменты, активность которых регулируется при участии гормонов или каких-либо метаболитов, называются регуляторными, или ключевыми. С помощью ключевых ферментов регулируется скорость метаболических процессов.
Слайд 30Изменение количества фермента
Регуляция на уровне транскрипции: индукция синтеза
Инсулин индуцирует синтез
ключевых ферментов гликолиза (окисления глюкозы).
Активация гликолиза в клетках приводит к
снижению уровня глюкозы в крови.Слайд 31Конститутивные ферменты – ферменты, которые синтезируются постоянно, независимо от наличия
субстрата
Индуцибельные (адаптивные) ферменты – ферменты, которые синтезируются только при наличии
субстратаПРИМЕР: алкогольдегидрогеназа
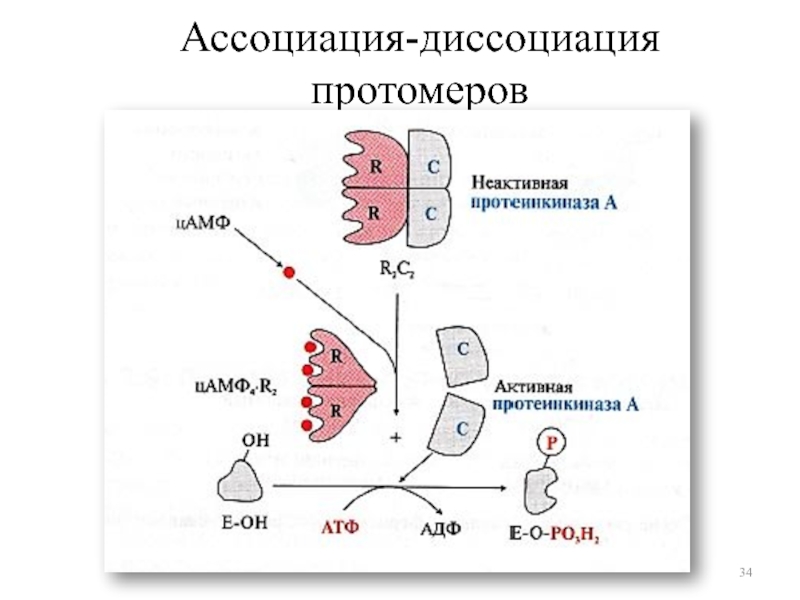
Слайд 32Механизмы регуляция каталитической активности ферментов
Взаимодействие с белком-активатором
Ассоциация и диссоциация протомеров
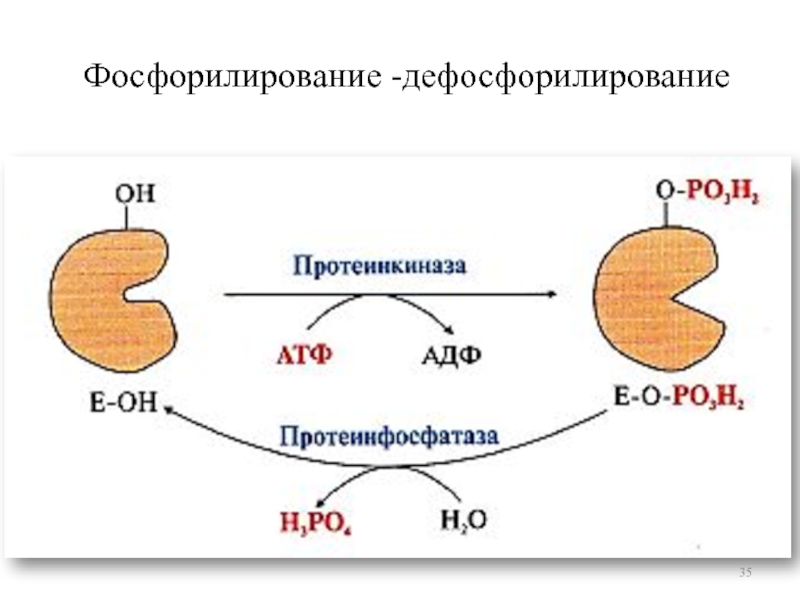
Фосфорилирование
и дефосфорилирование
Частичный протеолиз
Аллостерическая регуляция
Слайд 33Взаимодействие с белком-активатором
Фермент переваривания пищевого жира в тонком кишечнике –
панкреатическая липаза – активируется путем присоединения белка-фермента колипазы
Мембранный фермент аденилатциклаза,
участвующий в передаче сигнала гормонов в клетку, активируется путем взаимодействия с альфа-субъединицей G-белкаСлайд 36Частичный протеолиз
Изменение первичной структуры белка
Изменение конформации молекулы, формирование активного центра
Необратимая
регуляция
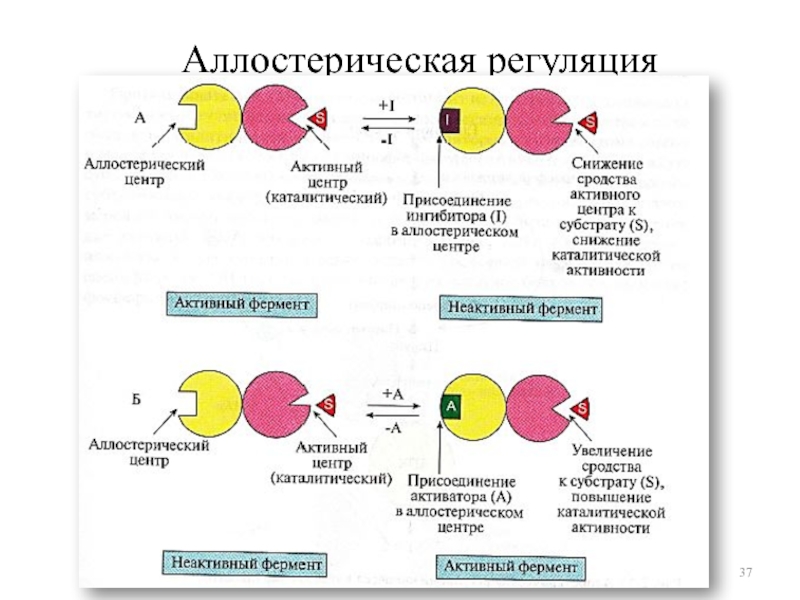
Слайд 38Аллостерические ферменты
Олигомерные белки (2 и более субъединиц)
Имеют аллостерический центр (один
или несколько)
Активный и аллостерический центры находятся в разных протомерах
Регуляторы активности
- эффекторы (активаторы, ингибиторы)Изменение конформации регуляторного протомера приводит к изменению конформации молекулы в целом, а значит и активного центра
Катализируют ключевые реакции
Аллостерическая регуляция обратима
ПРИМЕРЫ эффекторов:
продукты реакции (ингибиторы)
ATP – ингибитор, ADP – активатор ключевых ферментов энергетического обмена
Слайд 39Заключение
Основа физиологических процессов – биохимические реакции
Скорость биохимических реакций в организме
катализируют белки-ферменты, многие из которых нуждаются в кофакторах – микроэлементах
и производных витаминовФерментам свойственна высокая каталитическая эффективность, специфичность действия, конформационная лабильность, способность осуществлять катализ в «мягких» условиях внутренней среды организма
Активность ферментов регулируется. Это свойство ферментов является основой регуляции метаболических процессов в организме
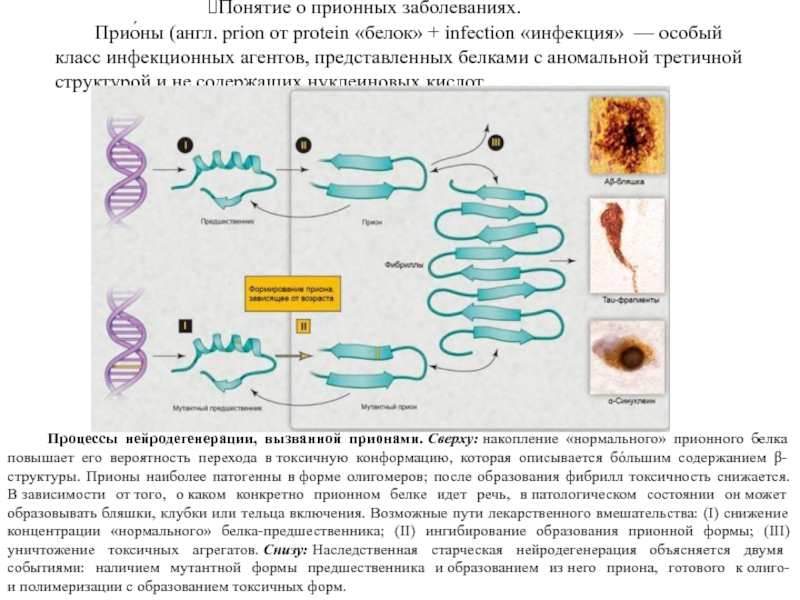
Слайд 41Понятие о прионных заболеваниях.
Процессы нейродегенерации, вызванной прионами. Сверху: накопление «нормального» прионного белка
повышает его вероятность перехода в токсичную конформацию, которая описывается бóльшим содержанием
β-структуры. Прионы наиболее патогенны в форме олигомеров; после образования фибрилл токсичность снижается. В зависимости от того, о каком конкретно прионном белке идет речь, в патологическом состоянии он может образовывать бляшки, клубки или тельца включения. Возможные пути лекарственного вмешательства: (I) снижение концентрации «нормального» белка-предшественника; (II) ингибирование образования прионной формы; (III) уничтожение токсичных агрегатов. Снизу: Наследственная старческая нейродегенерация объясняется двумя событиями: наличием мутантной формы предшественника и образованием из него приона, готового к олиго- и полимеризации с образованием токсичных форм. Прио́ны (англ. prion от protein «белок» + infection «инфекция» — особый класс инфекционных агентов, представленных белками с аномальной третичной структурой и не содержащих нуклеиновых кислот.