Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Курс Биология опухолевой клетки (201 9 г. ) Лекция 4 Подавление
Содержание
- 1. Курс Биология опухолевой клетки (201 9 г. ) Лекция 4 Подавление
- 2. Нестабильность генома(мутации и эпигенетические изменения)Нечувствительность крост-ингибирующим сигналам(приобретение
- 3. ‘Accidental cell death’ (ACD) – «смерть от
- 4. Способы программируемой гибели клеток:Классификация Номенклатурного Комитета (2012)Nomenclature
- 5. Для неопластических клеток характерноподавление большинства типов программируемой гибели клеток:Апоптоз Митотическая катастрофа3. Аутофагия4. Некроптоз5. Энтоз
- 6. Апоптоз - важнейший физиологический механизм элиминации из
- 7. Погибающие клетки дают сигналы «Найди меня» (лизофосфатидилхолин
- 8. Существенные отличия апоптоза от некроза: а)
- 9. Апоптоз - важнейший физиологический механизм элиминации из
- 10. Активныйтетрамер каспазыСaйт расщепления Asp-XРасщеплениеАктивный caйтp20p10p20p10p10p20 Ключевую роль
- 11. Эффекторные каспазы 3, 6, 7«Инструктивный» (extrinsic) апоптоз
- 12. Прокаспаза-8FADDFas
- 13. 2 варианта запуска инструктивного пути –рецепторы смерти
- 14. Эффекторные каспазы 3,6,7Киллерный лиганд(Fas-L, TNFα, TRAIL и
- 15. Слайд 15
- 16. Nomenclature Committee on Cell Death 2012. Cell Death and Differentiation (2012) 19, 107–120Intrinsic (mitochondrial) apoptosis
- 17. нечувствительность к апоптогенному действию Fas-L (потеря экспрессии
- 18. Онкогены и опухолевые супрессоры регулируют:a) проницаемость митохондриальной
- 19. Онкогены и опухолевые супрессоры регулируют:a) проницаемость митохондриальной
- 20. Онкогены и опухолевые супрессоры регулируют:a) проницаемость митохондриальной мембраныЧлены семейства Bcl2выход из митохондрийцитохрома С и др.
- 21. t(14;18) IgH/Bcl2 гиперэкспрессия Bcl2 (защитник) - В-клеточные
- 22. Ряд онкогенов и опухолевых супрессоров
- 23. нечувствительность к апоптогенному действию Fas-L (потеря экспрессии
- 24. сурвивинcaspase 8б) активность каспаз (онкогены HER2, Ras,
- 25. t(14;18) IgH/Bcl2 гиперэкспрессия Bcl2 - В-клеточные лимфомы
- 26. Dying tumor cells can use the apoptotic
- 27. Митотическая катастрофа - смерть клетки во время митоза или вследствие его неправильного завершения
- 28. Морфологические признаки митотической катастрофыКлетки хронического миелоидного лейкоза
- 29. Механизмы индукции митотической катастрофыMc Gee MM. Mediators Inflamm. 2015:146282SAC - spindle assembly checkpoint
- 30. Гибель клетки при митотической катастрофе, как правило,
- 31. Отличия некроза от апоптоза
- 32. НекроптозАпоптоз+ АТФ- АТФАпоптогенныестимулы(TRAIL, TNFα и др.) этил-пируватПереключения апоптоз некроптозцерамидНекроптоз – программируемый некроз
- 33. W. Wu et al. Critical Reviews in
- 34. Tait et al., J Cell Sci. 2014;127(Pt
- 35. Аутофагия – программа лизосомальной деградации белков
- 36. АутофагияУмеренная(очищение клетки)СильнаяФакторвыживания клеткиСмерть клетки;выживание организма(?)В.Levine, Nature, 2007, 446:745-747
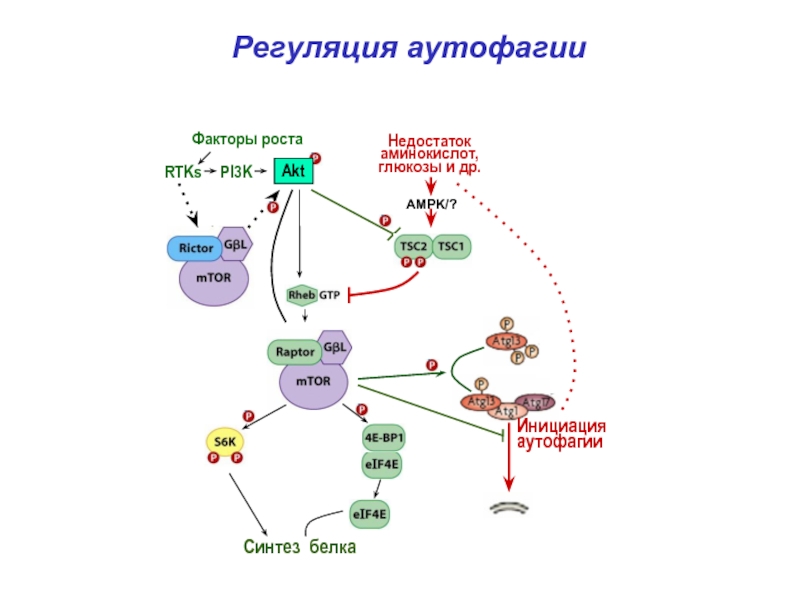
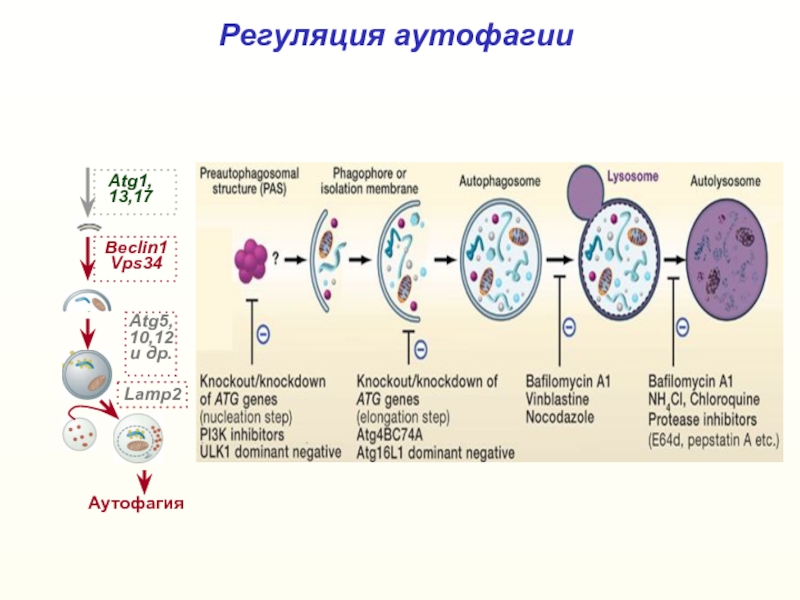
- 37. Регуляция аутофагииСинтез белкаИнициацияаутофагии
- 38. Регуляция аутофагииАутофагияBeclin1Vps34Atg1,13,17Atg5,10,12и др.Lamp2
- 39. Белки семейства Bcl2 регулируют не только апоптоз,
- 40. В.Levine, Nature, 2007, 446:745-747 У
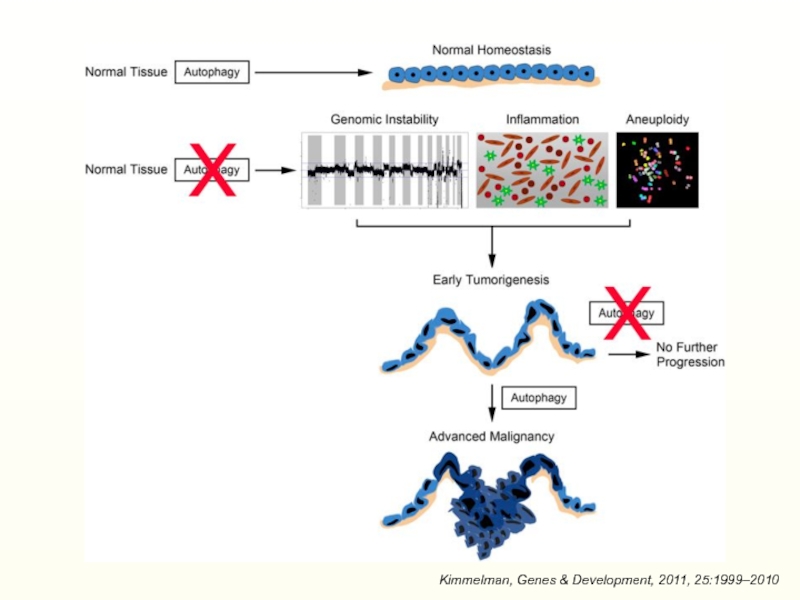
- 41. Kimmelman, Genes & Development, 2011, 25:1999–2010
- 42. Взаимосвязь разных путей клеточной гибелиRadogna et al., 2015. http://dx.doi.org/10.1016/j.bcp.2014.12.018
- 43. Лизозомная деградацияв поглощенной клеткеПоглощенная клеткане погибает и
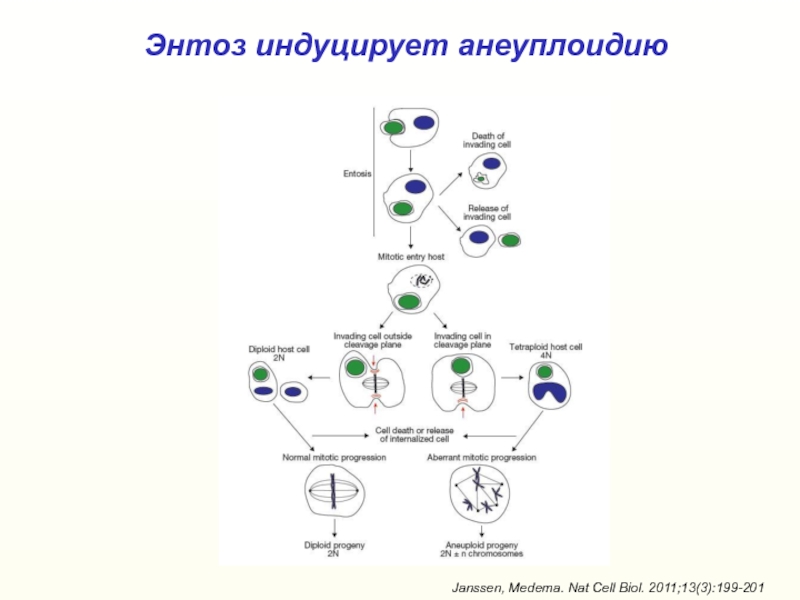
- 44. Энтоз индуцирует анеуплоидиюJanssen, Medema. Nat Cell Biol. 2011;13(3):199-201
- 45. Роль энтоза в канцерогенезеSun et al., Cell
- 46. Нестабильность генома(мутации и эпигенетические изменения)Нечувствительность крост-ингибирующим сигналам(приобретение
- 47. Курс «Биология опухолевой клетки»(2019 г.)Лекция 5Нестабильность генома неопластических клетокН.Л. Лазаревич
- 48. Скачать презентанцию
Слайды и текст этой презентации
Слайд 1Курс «Биология опухолевой клетки»
(2019 г.)
Лекция 4
Подавление программируемой клеточной смерти в
опухолевых клетках
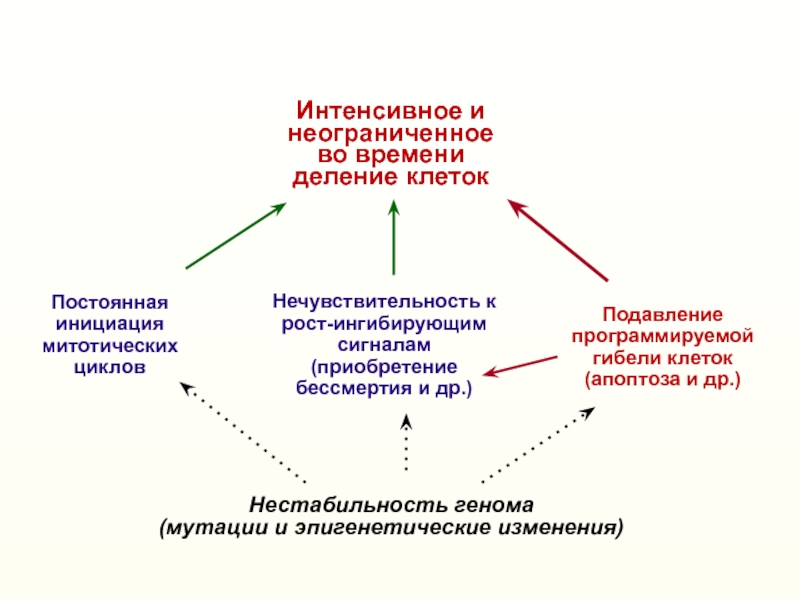
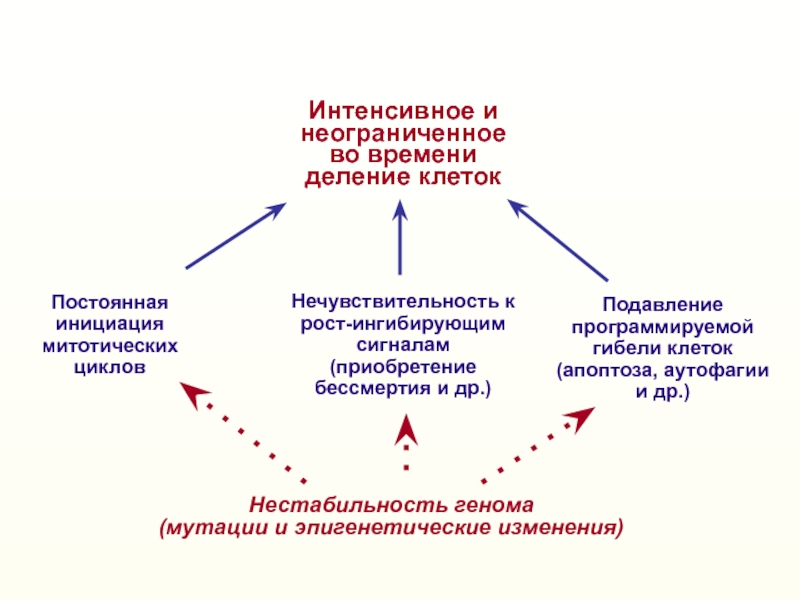
Слайд 2Нестабильность генома
(мутации и эпигенетические изменения)
Нечувствительность к
рост-ингибирующим сигналам
(приобретение бессмертия и др.)
Постоянная
инициация митотических циклов
Интенсивное и
неограниченное во времени деление клеток
Подавление
программируемой
гибели
клеток(апоптоза и др.)
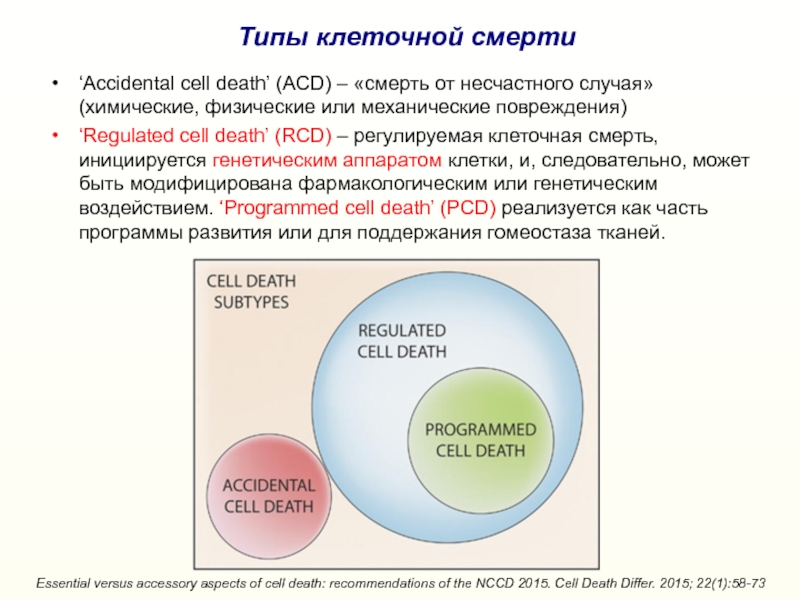
Слайд 3‘Accidental cell death’ (ACD) – «смерть от несчастного случая» (химические,
физические или механические повреждения)
‘Regulated cell death’ (RCD) – регулируемая клеточная
смерть, инициируется генетическим аппаратом клетки, и, следовательно, может быть модифицирована фармакологическим или генетическим воздействием. ‘Programmed cell death’ (PCD) реализуется как часть программы развития или для поддержания гомеостаза тканей. Essential versus accessory aspects of cell death: recommendations of the NCCD 2015. Cell Death Differ. 2015; 22(1):58-73
Типы клеточной смерти
Слайд 4Способы программируемой гибели клеток:
Классификация Номенклатурного Комитета (2012)
Nomenclature Committee on Cell
Death 2012. Cell Death and Differentiation (2012) 19, 107–120
Nomenclature Committee
on Cell Death 2018. Cell Death and Differentiation (2018) 25, 486-541Слайд 5Для неопластических клеток характерно
подавление большинства
типов программируемой гибели клеток:
Апоптоз
Митотическая
катастрофа
3. Аутофагия
4. Некроптоз
5. Энтоз
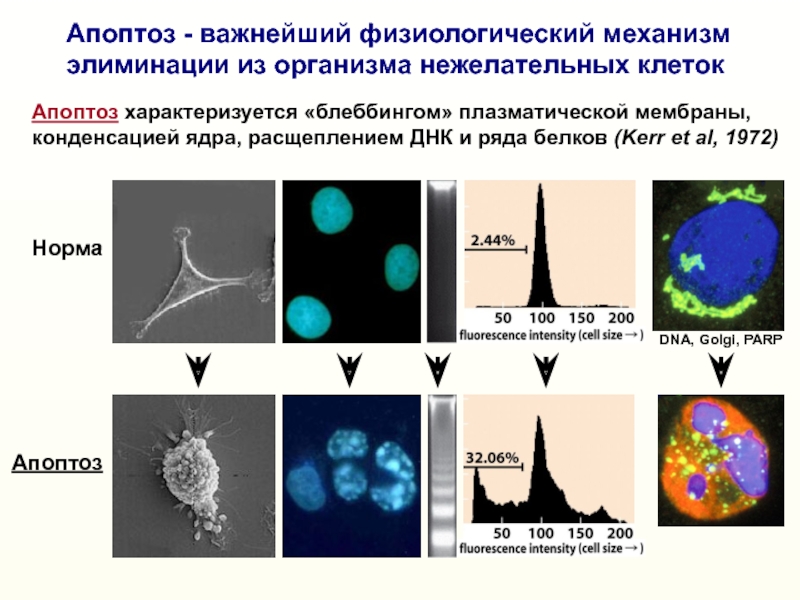
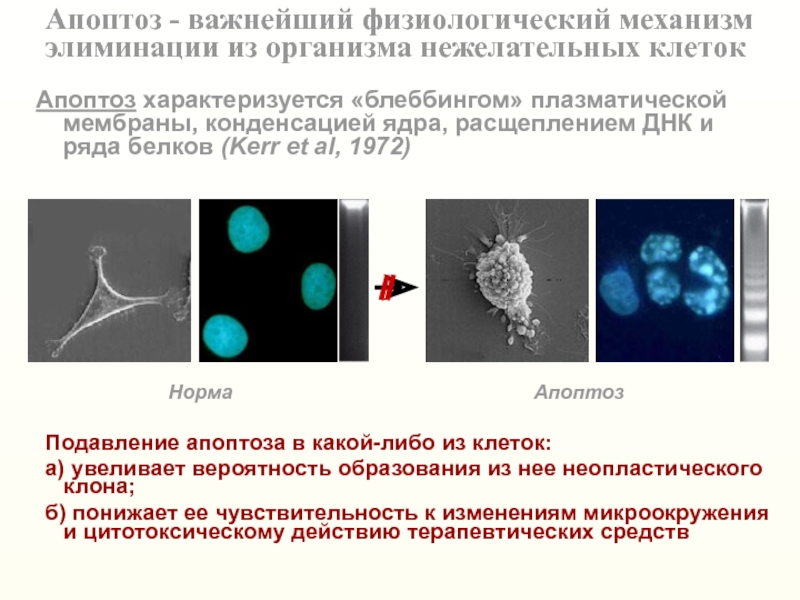
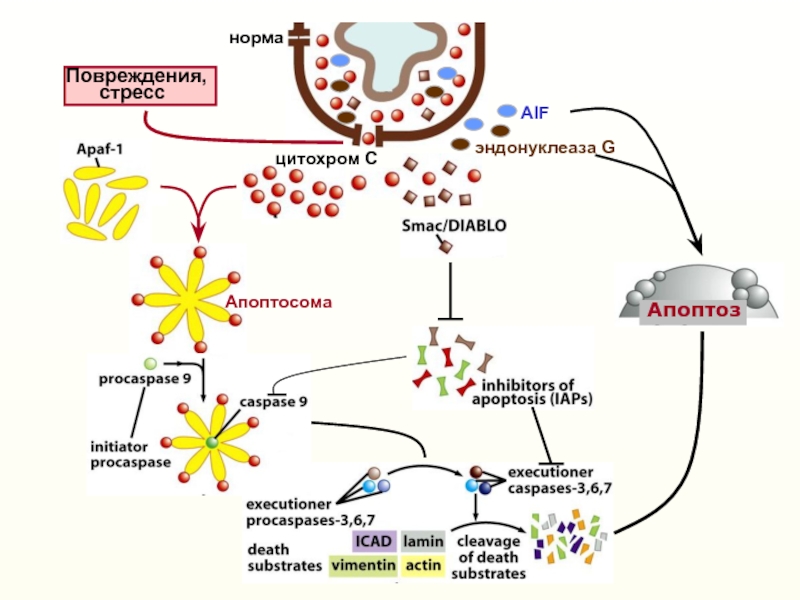
Слайд 6Апоптоз - важнейший физиологический механизм
элиминации из организма нежелательных клеток
Норма
Апоптоз
Апоптоз
характеризуется «блеббингом» плазматической мембраны, конденсацией ядра, расщеплением ДНК и ряда
белков (Kerr et al, 1972)DNA, Golgi, PARP
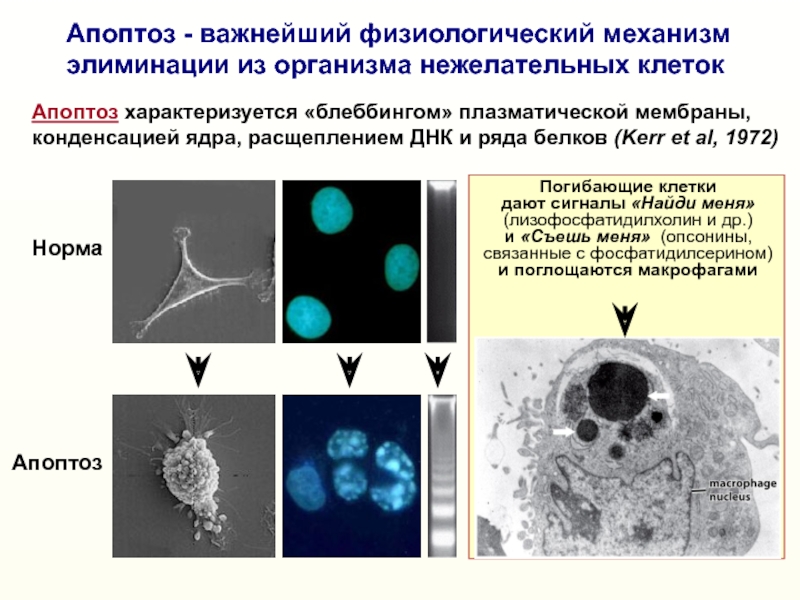
Слайд 7Погибающие клетки
дают сигналы «Найди меня»
(лизофосфатидилхолин и др.)
и
«Съешь меня» (опсонины,
связанные с фосфатидилсерином)
и поглощаются макрофагами
Норма
Апоптоз
Апоптоз - важнейший
физиологический механизм элиминации из организма нежелательных клеток
Апоптоз характеризуется «блеббингом» плазматической мембраны, конденсацией ядра, расщеплением ДНК и ряда белков (Kerr et al, 1972)
Слайд 8Существенные отличия апоптоза от некроза:
а) содержимое погибшей клетки
не выходит в межклеточное пространство; апоптотические клетки, в отличие от
некротических, не выпускают «алармины» (SAP130 и др.), привлекающие нейтрофилынет воспаления
б) программа, требующая затраты энергии и экспрессии определенных генов
Слайд 9Апоптоз - важнейший физиологический механизм
элиминации из организма нежелательных клеток
Подавление
апоптоза в какой-либо из клеток:
а) увеливает вероятность образования из нее
неопластического клона;
б) понижает ее чувствительность к изменениям микроокружения
и цитотоксическому действию терапевтических средств
Норма
Апоптоз
Апоптоз характеризуется «блеббингом» плазматической
мембраны, конденсацией ядра, расщеплением ДНК и
ряда белков (Kerr et al, 1972)
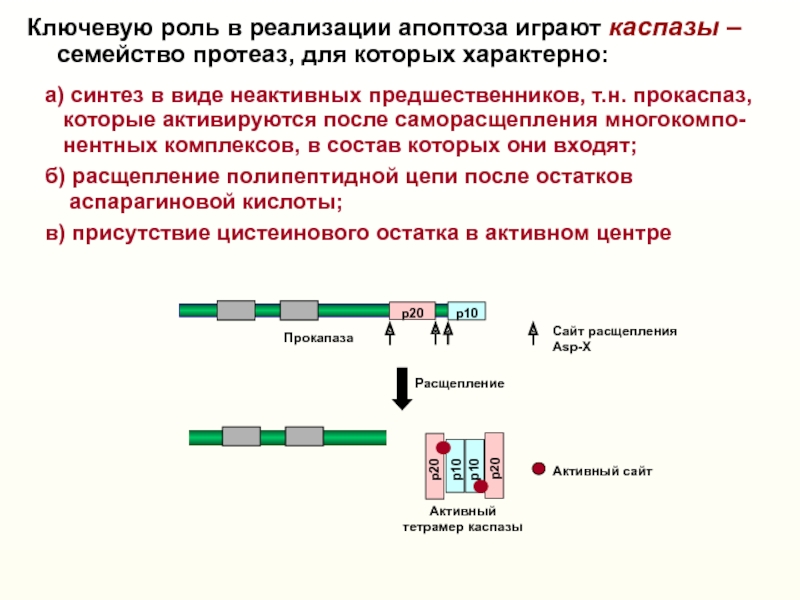
Слайд 10Активный
тетрамер каспазы
Сaйт расщепления Asp-X
Расщепление
Активный caйт
p20
p10
p20
p10
p10
p20
Ключевую роль в реализации апоптоза
играют каспазы –
семейство протеаз, для которых
характерно:а) синтез в виде неактивных предшественников, т.н. прокаспаз,
которые активируются после саморасщепления многокомпо-
нентных комплексов, в состав которых они входят;
б) расщепление полипептидной цепи после остатков
аспарагиновой кислоты;
в) присутствие цистеинового остатка в активном центре
Прокапаза
Слайд 11Эффекторные
каспазы 3, 6, 7
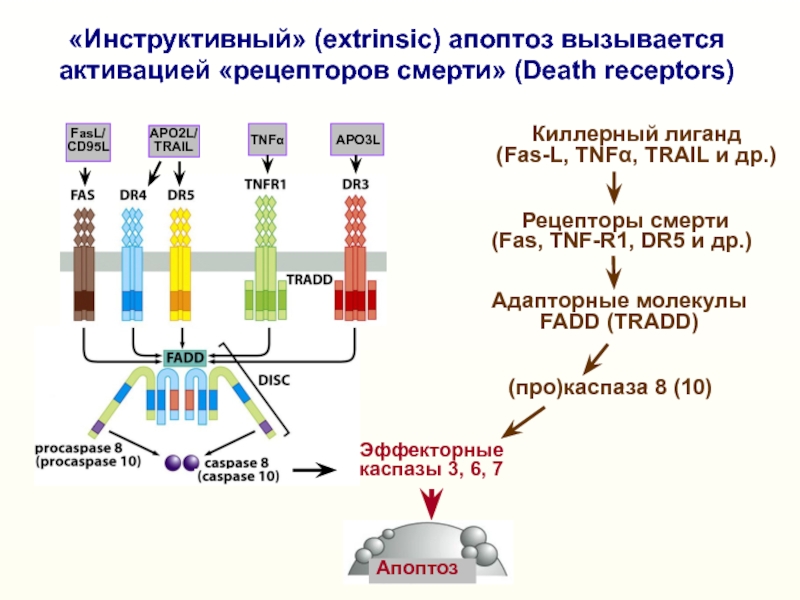
«Инструктивный» (extrinsic) апоптоз вызывается
активацией «рецепторов
смерти» (Death receptors)
Киллерный лиганд
(Fas-L, TNFα, TRAIL и др.)
Рецепторы смерти
(Fas, TNF-R1, DR5 и др.)
(про)каспаза 8 (10)
Адапторные молекулы
FADD (TRADD)
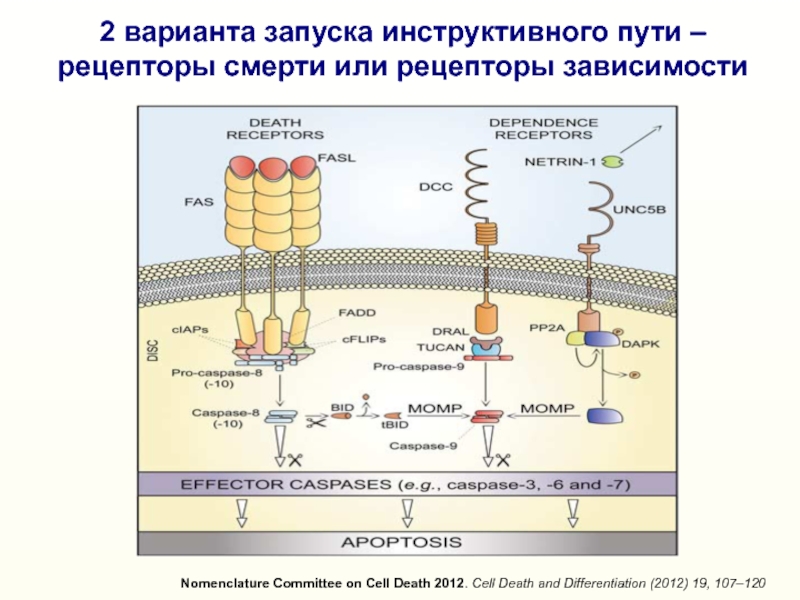
Слайд 132 варианта запуска инструктивного пути –
рецепторы смерти или рецепторы зависимости
Nomenclature
Committee on Cell Death 2012. Cell Death and Differentiation (2012)
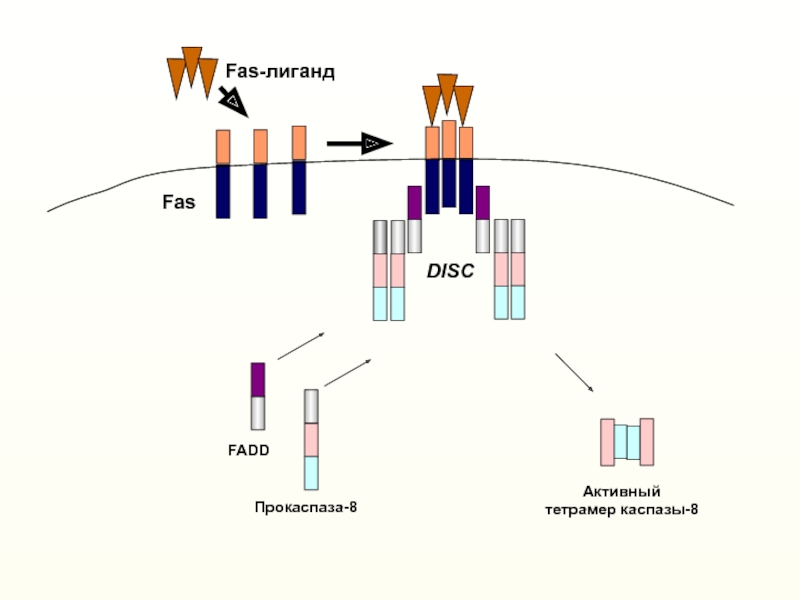
19, 107–120Слайд 14Эффекторные
каспазы 3,6,7
Киллерный лиганд
(Fas-L, TNFα, TRAIL и др.)
Рецепторы
смерти
(Fas, TNF-R1, DR5 и др.)
Каспаза 8 (10)
FADD (TRADD)
IAPs
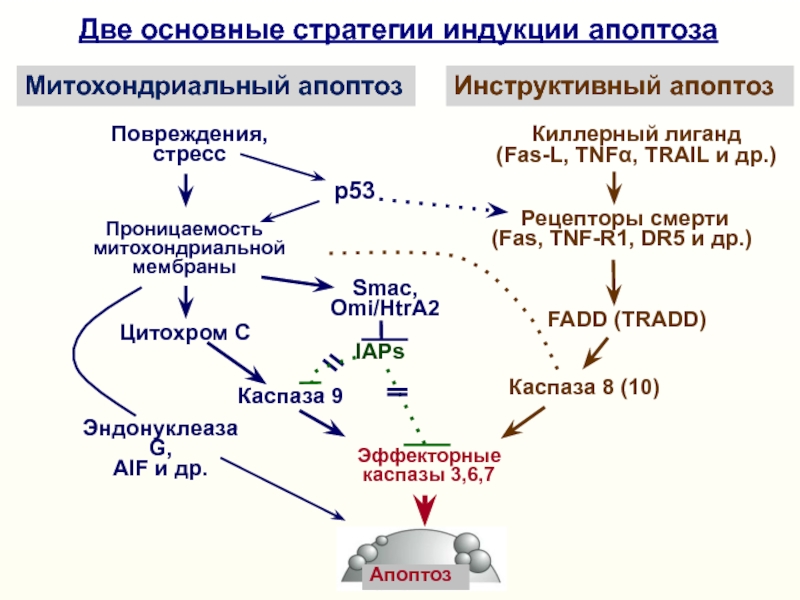
Две основные
стратегии индукции апоптозаМитохондриальный апоптоз
Инструктивный апоптоз
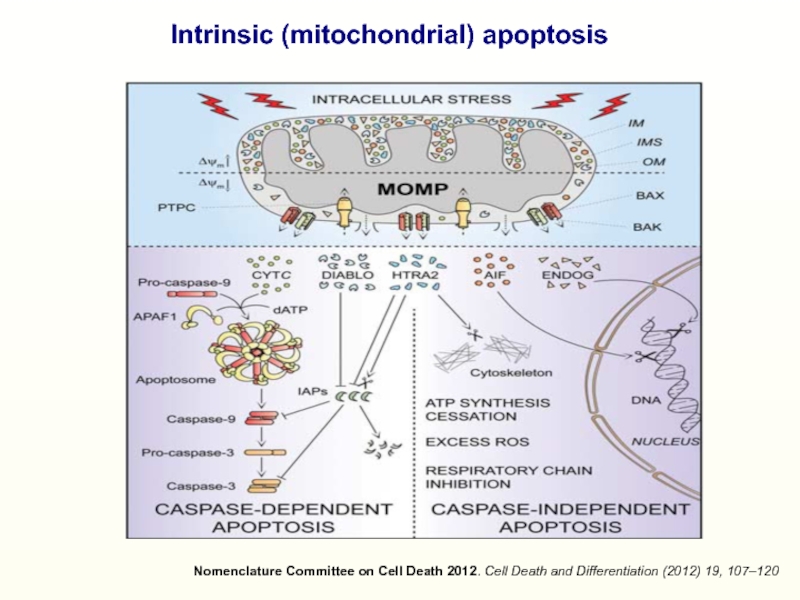
Слайд 16Nomenclature Committee on Cell Death 2012. Cell Death and Differentiation
(2012) 19, 107–120
Intrinsic (mitochondrial) apoptosis
Слайд 17нечувствительность к апоптогенному действию Fas-L
(потеря экспрессии или мутации рецептора
смерти Fas,
гиперэкспрессия рецептора-ловушки DCR3);
потеря рецептора нетрина-1 DCC
нарушения
проведения сигнала к митохондриям (инактивация опухолевых супрессоров р53, PTEN и др.);
подавление выброса из митохондрий цитохрома С
(увеличение экспрессии онкогенов семейства Bcl2 и др.);
подавление активации каспаз
(потеря экспрессии белка APAF-1, инактивация р53 и др.);
уменьшение времени жизни каспаз
(связывание каспаз с белками IAP (Inhibitors of Apoptosis),
экспрессия которых повышается вследствие активации
протоонкогенов Ras, Akt/PKB или инактивации опухолевых
супрессоров р53, PTEN и др.)
Механизмы ослабления индукции апоптоза
в опухолевых клетках:
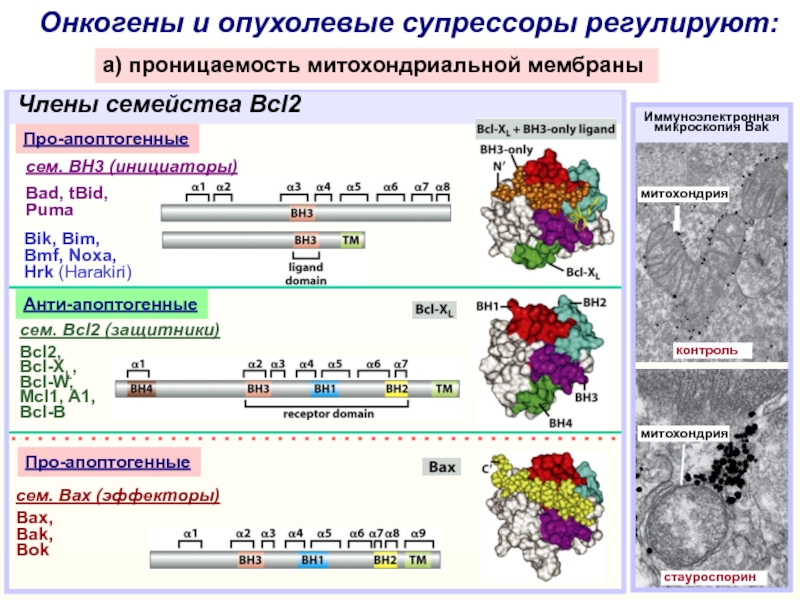
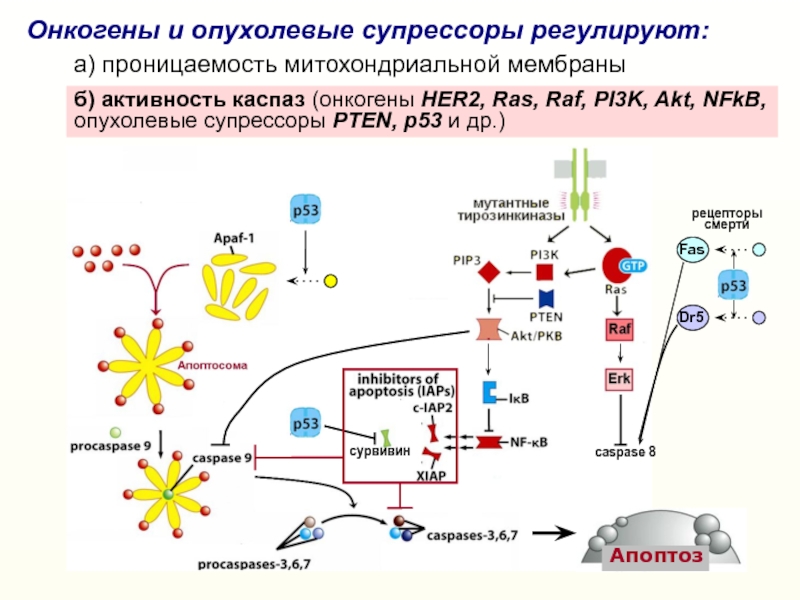
Слайд 18Онкогены и опухолевые супрессоры регулируют:
a) проницаемость митохондриальной мембраны
cем. Bcl2 (защитники)
Bcl2,
Bcl-XL,
Bcl-W,
Mcl1, A1,
Bcl-B
сем. Bax (эффекторы)
Bах,
Bak,
Bok
Bik, Bim,
Bmf, Noxa,
Hrk (Harakiri)
Анти-апоптогенные
Про-апоптогенные
сем.
BH3 (инициаторы)Bad, tBid,
Puma
Члены семейства Bcl2
Про-апоптогенные
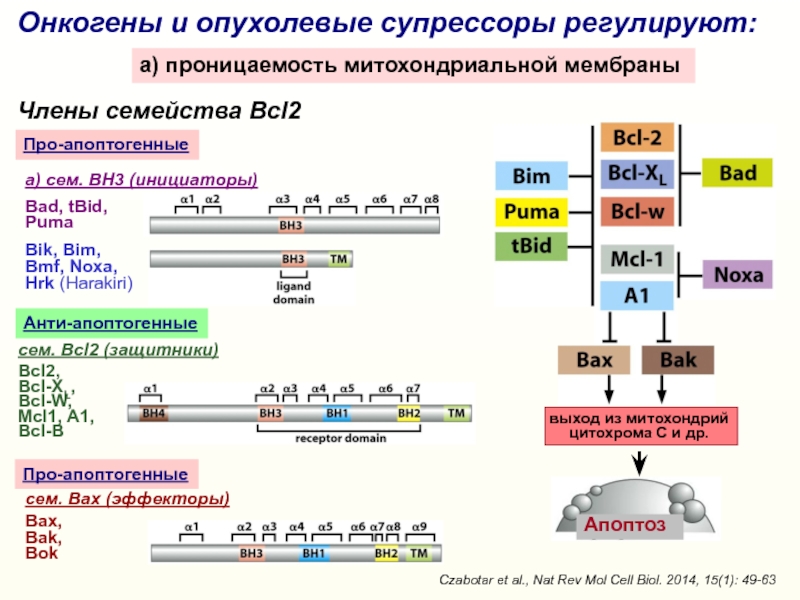
Слайд 19Онкогены и опухолевые супрессоры регулируют:
a) проницаемость митохондриальной мембраны
cем. Bcl2 (защитники)
Bcl2,
Bcl-XL,
Bcl-W,
Mcl1, A1,
Bcl-B
сем. Bax (эффекторы)
Bах,
Bak,
Bok
Анти-апоптогенные
Про-апоптогенные
Члены семейства Bcl2
выход из митохондрий
цитохрома С
и др.Про-апоптогенные
Czabotar et al., Nat Rev Mol Cell Biol. 2014, 15(1): 49-63
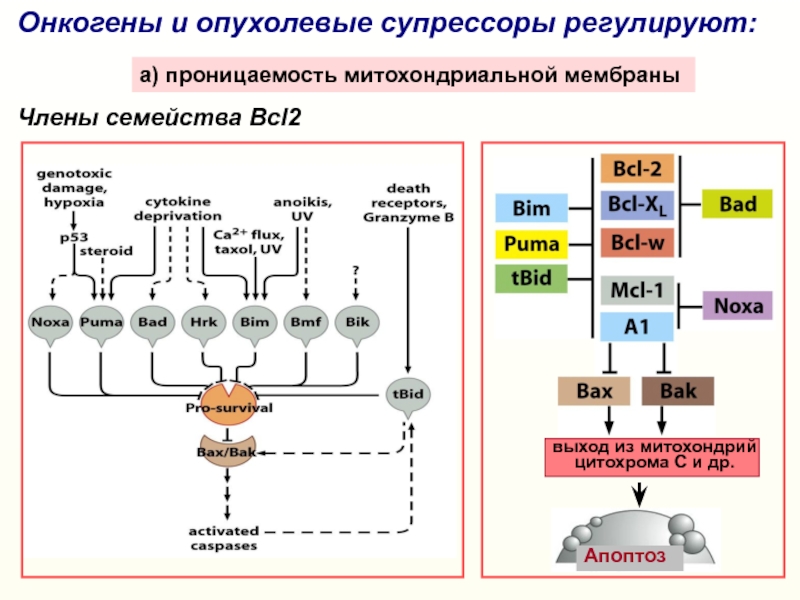
Слайд 20Онкогены и опухолевые супрессоры регулируют:
a) проницаемость митохондриальной мембраны
Члены семейства Bcl2
выход
из митохондрий
цитохрома С и др.
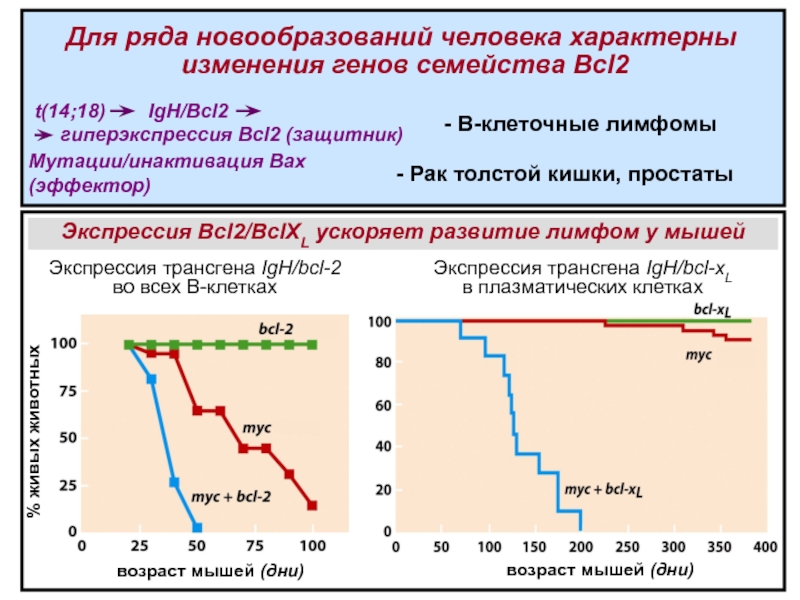
Слайд 21t(14;18)
IgH/
Bcl2
гиперэкспрессия Bcl2 (защитник)
- В-клеточные лимфомы
Мутации/инактивация Bax
(эффектор)
- Рак толстой кишки, простаты
Для ряда новообразований человека характерны
изменения
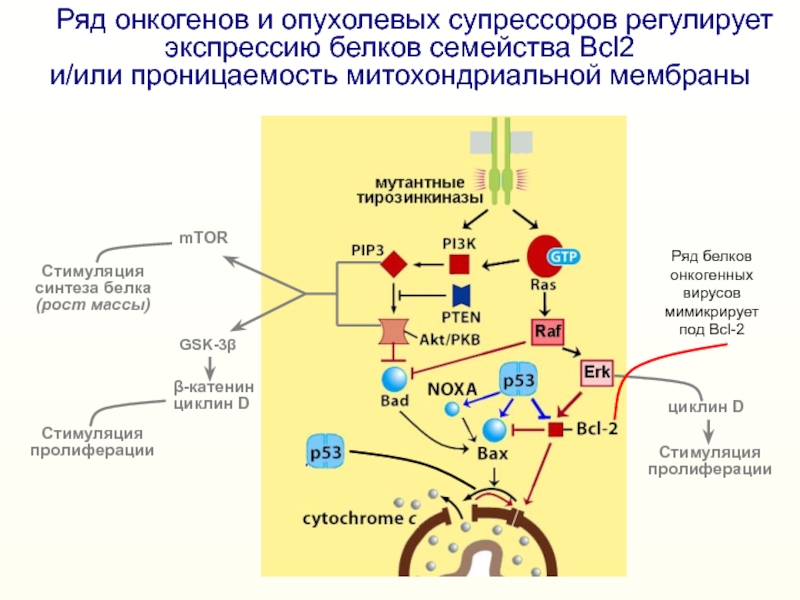
генов семейства Bcl2Слайд 22 Ряд онкогенов и опухолевых супрессоров регулирует экспрессию белков
семейства Bcl2
и/или проницаемость митохондриальной мембраны
mTOR
GSK-3β
β-катенин
циклин D
Стимуляция
пролиферации
Стимуляция
синтеза белка
(рост массы)
циклин D
Стимуляция
пролиферации
Ряд
белков онкогенных вирусов мимикрирует под Bcl-2Слайд 23нечувствительность к апоптогенному действию Fas-L
(потеря экспрессии или мутации рецептора
смерти Fas,
гиперэкспрессия рецептора-ловушки DcR3);
нарушения проведения сигнала к митохондриям
(инактивация опухолевых супрессоров р53, PTEN и др.);
подавление выброса из митохондрий цитохрома С
(увеличение экспрессии онкогенов семейства Bcl2 и др.);
подавление активации каспаз
(инактивация APAF-1, мутации Ras, PI3K, PTEN, р53 и др.);
уменьшение времени жизни каспаз
(связывание каспаз с белками IAP (Inhibitors of Apoptosis),
экспрессия которых повышается вследствие активации
протоонкогенов Ras, Akt/PKB или инактивации опухолевых
супрессоров р53, PTEN и др.)
Механизмы ослабления индукции апоптоза
в опухолевых клетках:
Слайд 24сурвивин
caspase 8
б) активность каспаз (онкогены HER2, Ras, Raf, PI3K, Akt,
NFkB, опухолевые супрессоры PTEN, p53 и др.)
Онкогены и опухолевые супрессоры
регулируют:a) проницаемость митохондриальной мембраны
Слайд 25t(14;18)
IgH/
Bcl2
гиперэкспрессия Bcl2
- В-клеточные лимфомы
Мутации/инактивация Bax
- Рак
толстой кишки, простаты
Мутации/инактивация PTEN
Мутации/активация Ras
- Многие новообразования
Метилирование Apaf1
- Рак толстой
кишкиМутации/инактивация р53
- Многие новообразования
- Многие новообразования
Мутации/инактивация Fas
- Лимфомы, рак яичка, мелкокле-
точный рак легкого
Гиперэкспрессия сурвивина
- Многие новообразования
Характерные для новообразований человека изменения генов, продукты которых регулируют апоптоз
Амплификация гена DCR3
Рак желудка, толстой кишки, печени
Слайд 26
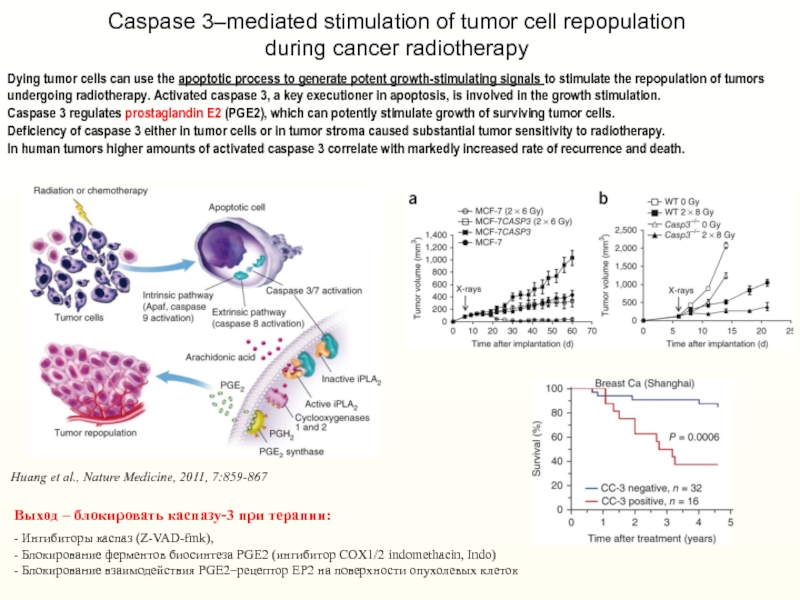
Dying tumor cells can use the apoptotic process to generate
potent growth-stimulating signals to stimulate the repopulation of tumors undergoing
radiotherapy. Activated caspase 3, a key executioner in apoptosis, is involved in the growth stimulation.Caspase 3 regulates prostaglandin E2 (PGE2), which can potently stimulate growth of surviving tumor cells.
Deficiency of caspase 3 either in tumor cells or in tumor stroma caused substantial tumor sensitivity to radiotherapy.
In human tumors higher amounts of activated caspase 3 correlate with markedly increased rate of recurrence and death.
Huang et al., Nature Medicine, 2011, 7:859-867
Caspase 3–mediated stimulation of tumor cell repopulation
during cancer radiotherapy
Выход – блокировать каспазу-3 при терапии:
- Ингибиторы каспаз (Z-VAD-fmk),
- Блокирование ферментов биосинтеза PGE2 (ингибитор COX1/2 indomethacin, Indo)
- Блокирование взаимодействия PGE2–рецептор EP2 на поверхности опухолевых клеток
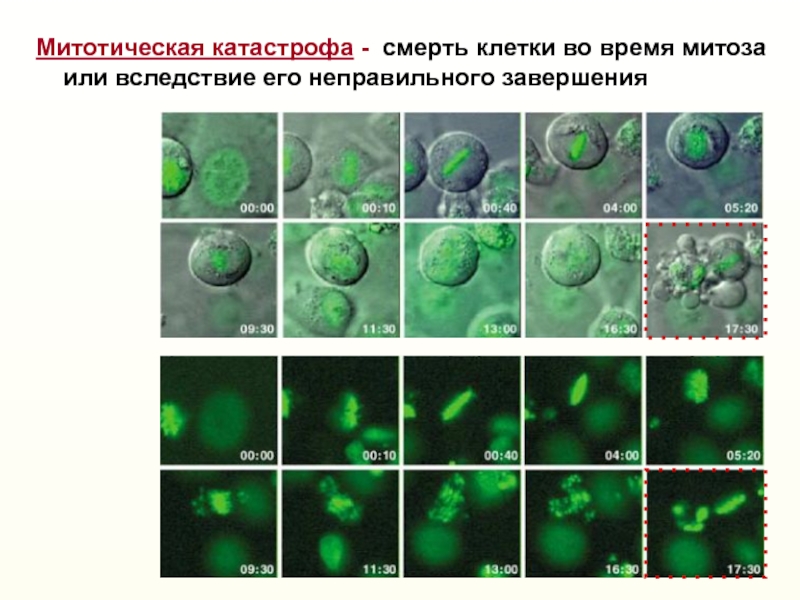
Слайд 27Митотическая катастрофа - смерть клетки во время митоза
или
вследствие его неправильного завершения
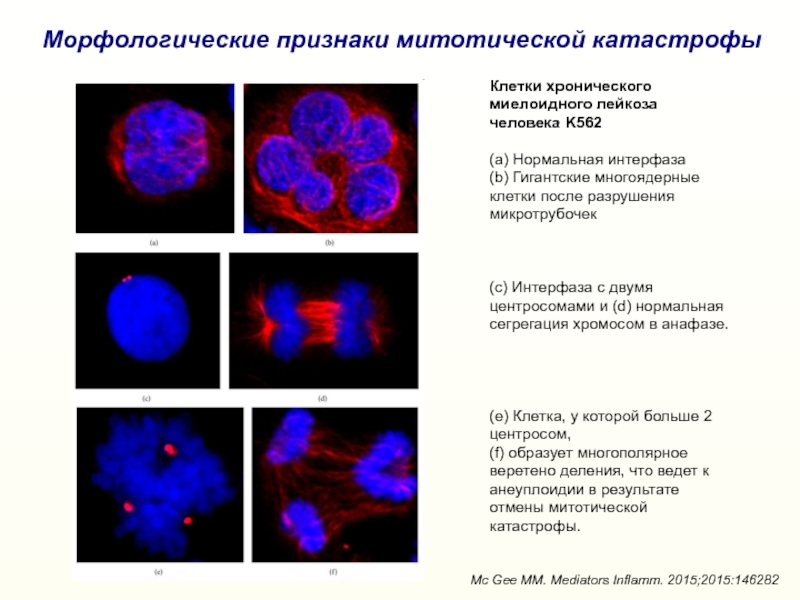
Слайд 28Морфологические признаки митотической катастрофы
Клетки хронического миелоидного лейкоза человека K562
(a)
Нормальная интерфаза
(b) Гигантские многоядерные клетки после разрушения микротрубочек
(c) Интерфаза с
двумя центросомами и (d) нормальная сегрегация хромосом в анафазе. (e) Клетка, у которой больше 2 центросом,
(f) образует многополярное веретено деления, что ведет к анеуплоидии в результате отмены митотической катастрофы.
Mc Gee MM. Mediators Inflamm. 2015;2015:146282
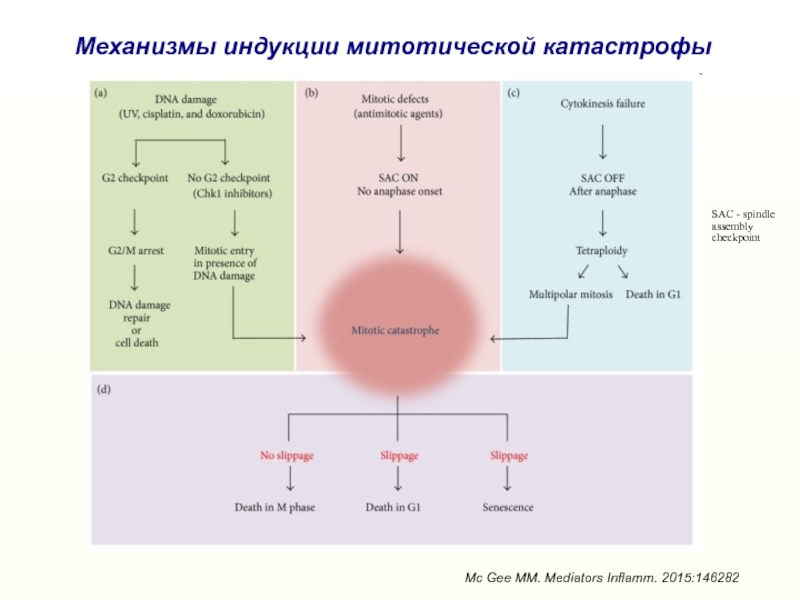
Слайд 29Механизмы индукции митотической катастрофы
Mc Gee MM. Mediators Inflamm. 2015:146282
SAC -
spindle assembly checkpoint
Слайд 30Гибель клетки при митотической катастрофе, как правило, происходит апоптоз-подобным путем
Преждевременный
вход в митоз
и/или невозможность его завершения
Каспаза-зависимый
апоптозКаспаза-независимый
апоптоз
Нормальная
метафаза
Митотическая
катастрофа
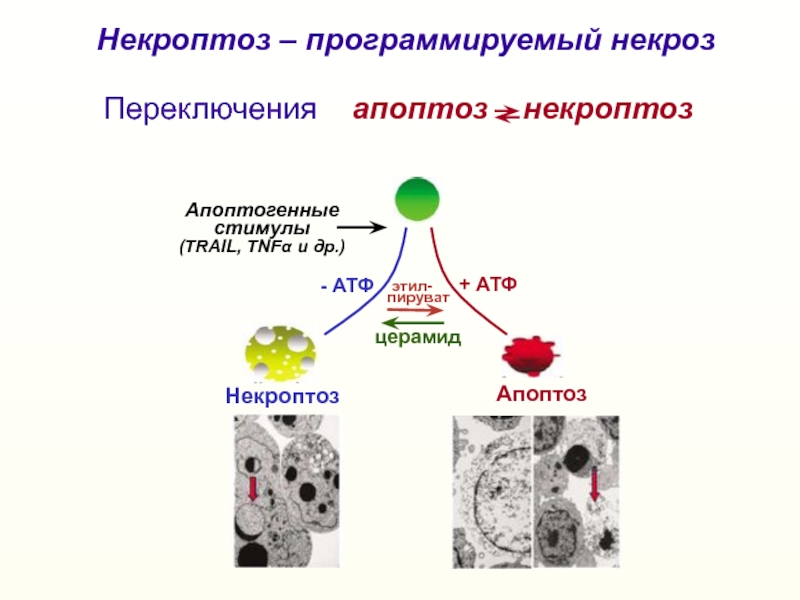
Слайд 32Некроптоз
Апоптоз
+ АТФ
- АТФ
Апоптогенные
стимулы
(TRAIL, TNFα и др.)
этил-
пируват
Переключения апоптоз
некроптоз
церамид
Некроптоз – программируемый некроз
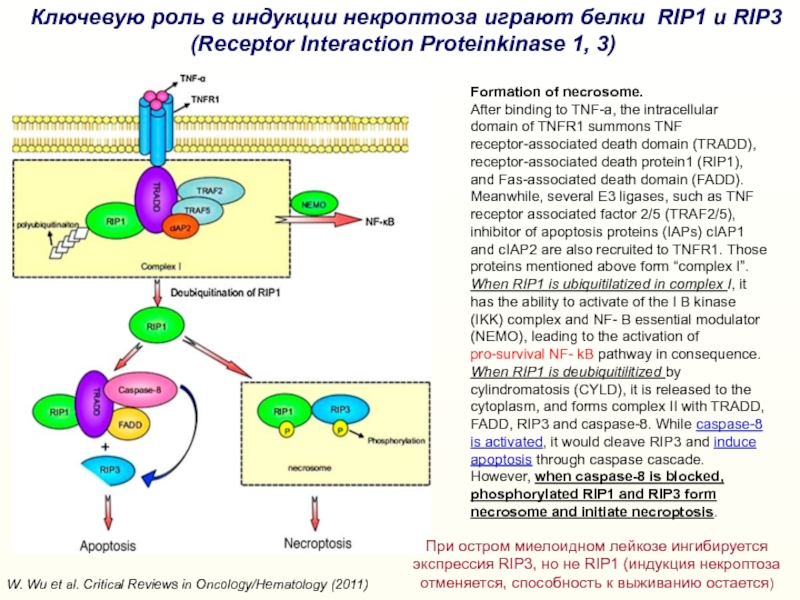
Слайд 33W. Wu et al. Critical Reviews in Oncology/Hematology (2011)
Ключевую
роль в индукции некроптоза играют белки RIP1 и RIP3 (Receptor
Interaction Proteinkinase 1, 3)Formation of necrosome.
After binding to TNF-a, the intracellular domain of TNFR1 summons TNF receptor-associated death domain (TRADD), receptor-associated death protein1 (RIP1), and Fas-associated death domain (FADD). Meanwhile, several E3 ligases, such as TNF receptor associated factor 2/5 (TRAF2/5), inhibitor of apoptosis proteins (IAPs) cIAP1 and cIAP2 are also recruited to TNFR1. Those proteins mentioned above form “complex I”.
When RIP1 is ubiquitilatized in complex I, it has the ability to activate of the I B kinase (IKK) complex and NF- B essential modulator (NEMO), leading to the activation of pro-survival NF- kB pathway in consequence.
When RIP1 is deubiquitilitized by cylindromatosis (CYLD), it is released to the cytoplasm, and forms complex II with TRADD, FADD, RIP3 and caspase-8. While caspase-8 is activated, it would cleave RIP3 and induce apoptosis through caspase cascade. However, when caspase-8 is blocked, phosphorylated RIP1 and RIP3 form necrosome and initiate necroptosis.
При остром миелоидном лейкозе ингибируется экспрессия RIP3, но не RIP1 (индукция некроптоза отменяется, способность к выживанию остается)
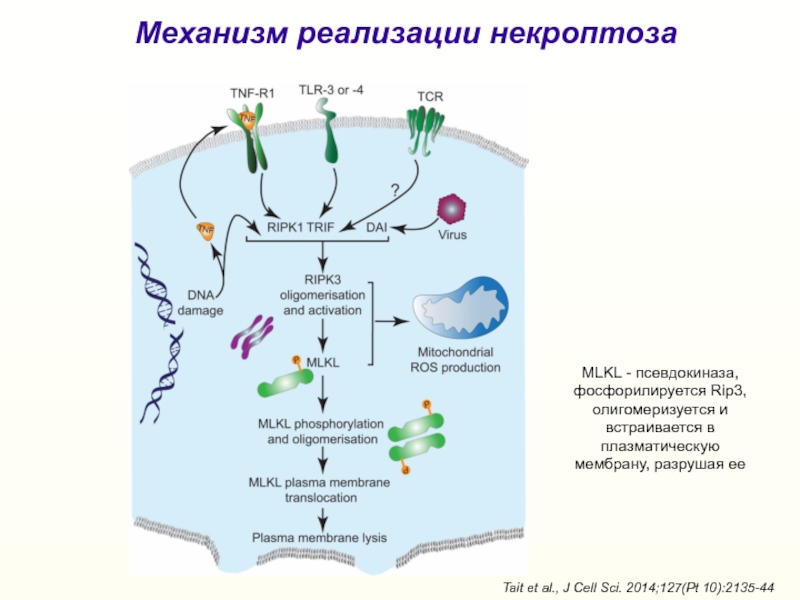
Слайд 34Tait et al., J Cell Sci. 2014;127(Pt 10):2135-44
Механизм реализации некроптоза
MLKL
- псевдокиназа, фосфорилируется Rip3, олигомеризуется и встраивается в плазматическую мембрану,
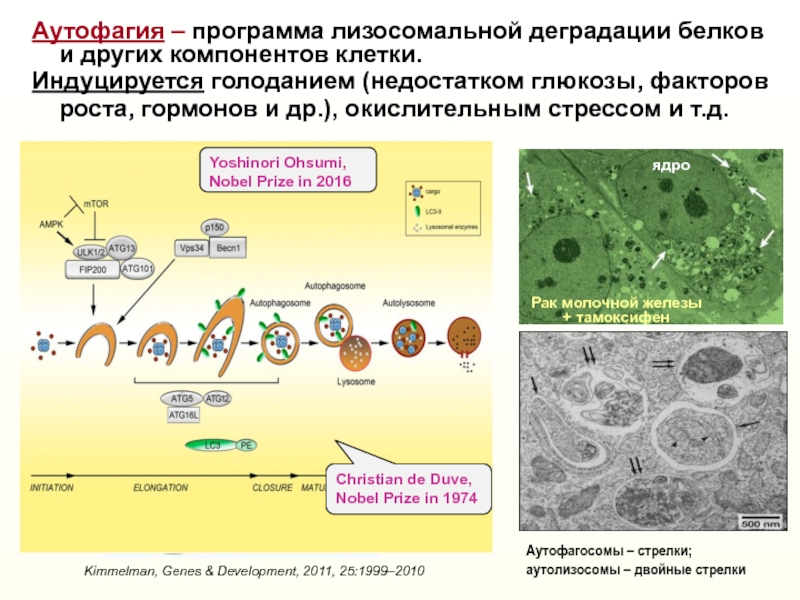
разрушая ееСлайд 35Аутофагия – программа лизосомальной деградации белков
и других компонентов
клетки.
Индуцируется голоданием (недостатком глюкозы, факторов
роста, гормонов и
др.), окислительным стрессом и т.д.ядро
Рак молочной железы + тамоксифен
Kimmelman, Genes & Development, 2011, 25:1999–2010
Аутофагосомы – стрелки;
аутолизосомы – двойные стрелки
Yoshinori Ohsumi, Nobel Prize in 2016
Christian de Duve, Nobel Prize in 1974
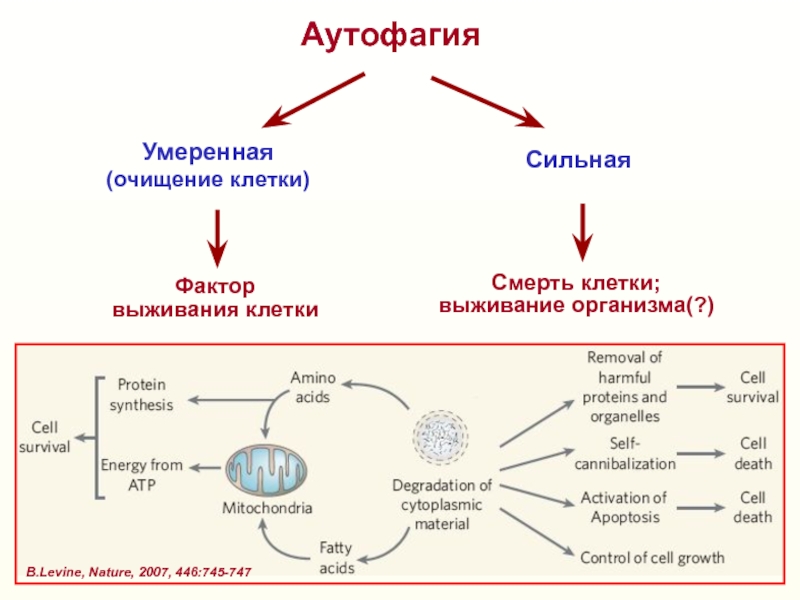
Слайд 36Аутофагия
Умеренная
(очищение клетки)
Сильная
Фактор
выживания клетки
Смерть клетки;
выживание организма(?)
В.Levine, Nature, 2007, 446:745-747
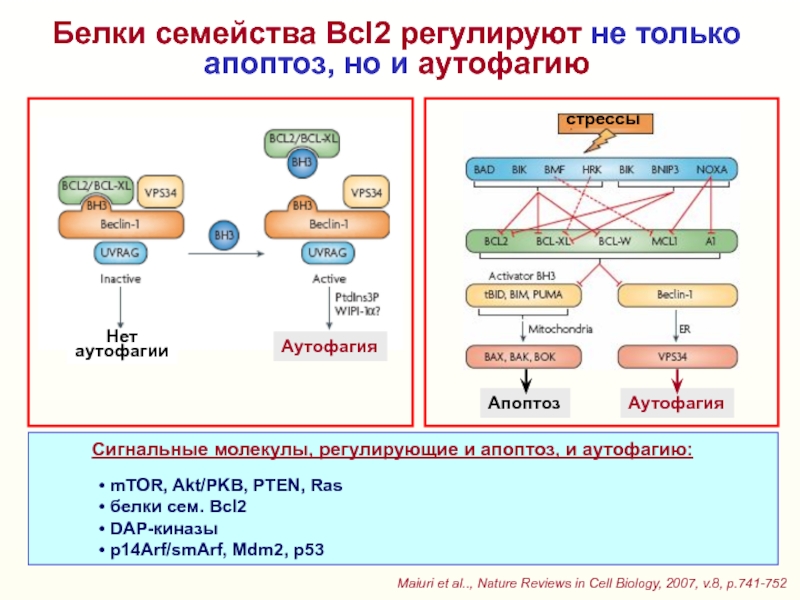
Слайд 39Белки семейства Bcl2 регулируют не только апоптоз, но и аутофагию
Maiuri
et al.., Nature Reviews in Cell Biology, 2007, v.8, p.741-752
стрессы
Апоптоз
Аутофагия
Аутофагия
Нет
аутофагии
Cигнальные молекулы, регулирующие и апоптоз, и аутофагию:
mTOR, Akt/PKB, PTEN, Ras
белки сем. Bcl2
DAP-киназы
р14Arf/smArf, Mdm2, p53
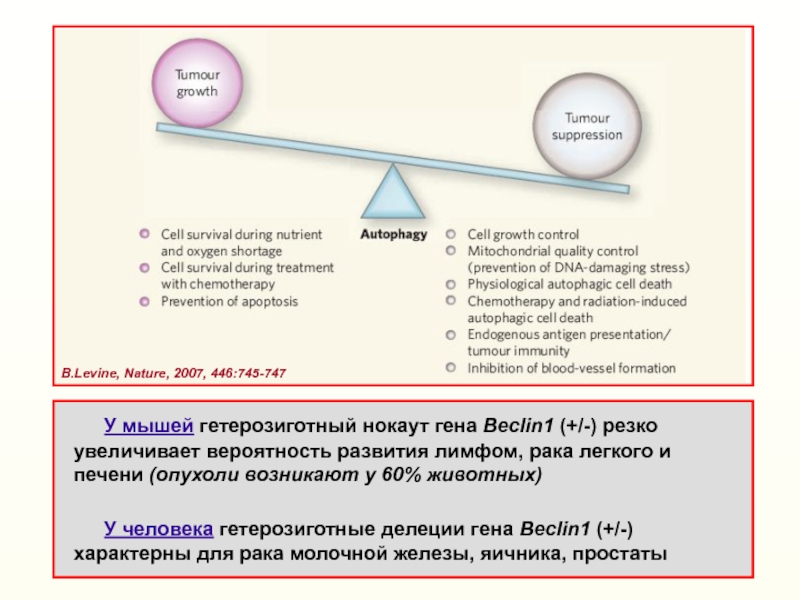
Слайд 40В.Levine, Nature, 2007, 446:745-747
У мышей гетерозиготный нокаут
гена Beclin1 (+/-) резко увеличивает вероятность развития лимфом, рака легкого
и печени (опухоли возникают у 60% животных) У человека гетерозиготные делеции гена Beclin1 (+/-) характерны для рака молочной железы, яичника, простаты
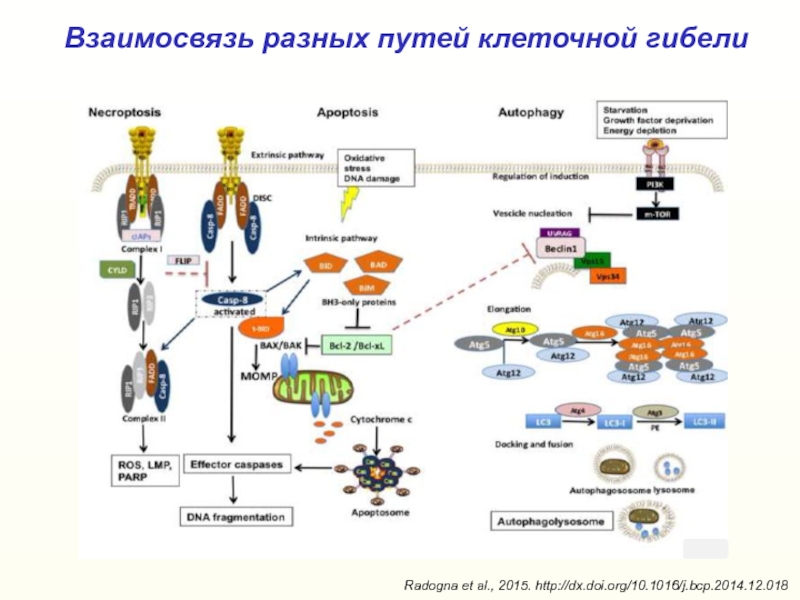
Слайд 42Взаимосвязь разных путей клеточной гибели
Radogna et al., 2015. http://dx.doi.org/10.1016/j.bcp.2014.12.018
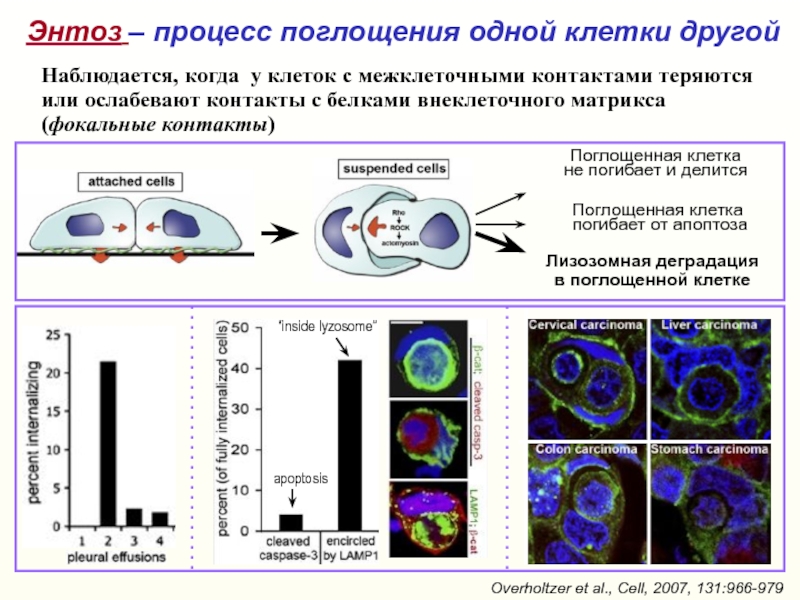
Слайд 43Лизозомная деградация
в поглощенной клетке
Поглощенная клетка
не погибает и делится
Overholtzer et al.,
Cell, 2007, 131:966-979
Энтоз – процесс поглощения одной клетки другой
apoptosis
“inside
lyzosome”Поглощенная клетка
погибает от апоптоза
Наблюдается, когда у клеток с межклеточными контактами теряются или ослабевают контакты с белками внеклеточного матрикса (фокальные контакты)
Слайд 45Роль энтоза в канцерогенезе
Sun et al., Cell Res. 2014;24(11):1299-310 and
1288-98; Kroemer, Perfettini. Cell Res. 2014;24(11):1280-1
Поглощение нетрансформированных клеток трансформированными при
ко-культивированииЭнтоз индуцируют:
- активированный онкоген K-Ras (через Rac1, PI3K/AKT/mTOR?)
- опухолевые супрессоры Е- и Р-кадхерины (RhoA, ROCK зависимо)
Высокий уровень энтоза коррелирует:
- в опухолях молочной железы и простаты – с плохим прогнозом
- в опухолях поджелудочной железы – со сниженной частотой метастазирования
Слайд 46Нестабильность генома
(мутации и эпигенетические изменения)
Нечувствительность к
рост-ингибирующим сигналам
(приобретение бессмертия и др.)
Постоянная
инициация митотических циклов
Интенсивное и
неограниченное во времени деление клеток
Подавление
программируемой
гибели
клеток(апоптоза, аутофагии и др.)