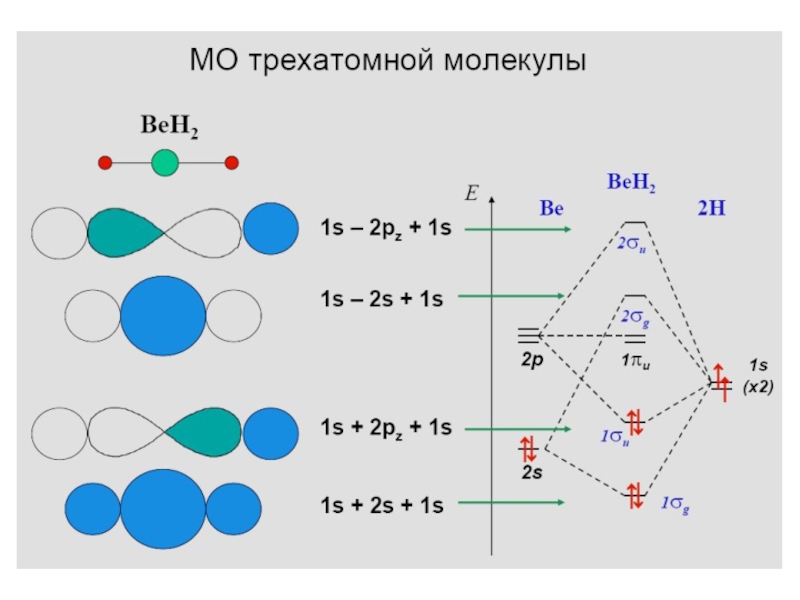
Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Курс Общая химия Лектор: проф. Майстренко Валерий Николаевич Башкирский
Содержание
- 1. Курс Общая химия Лектор: проф. Майстренко Валерий Николаевич Башкирский
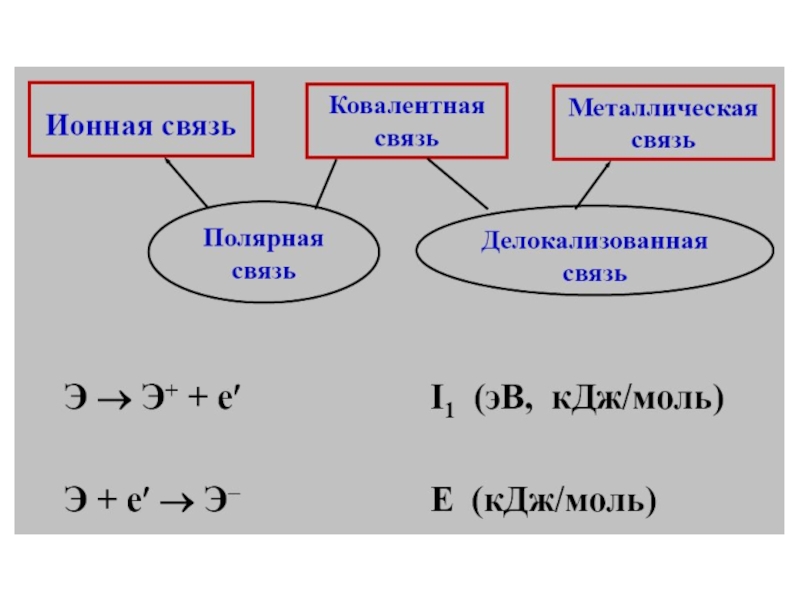
- 2. Лекция № 14Химическая связь(метод молекулярных орбиталей)
- 3. Слайд 3
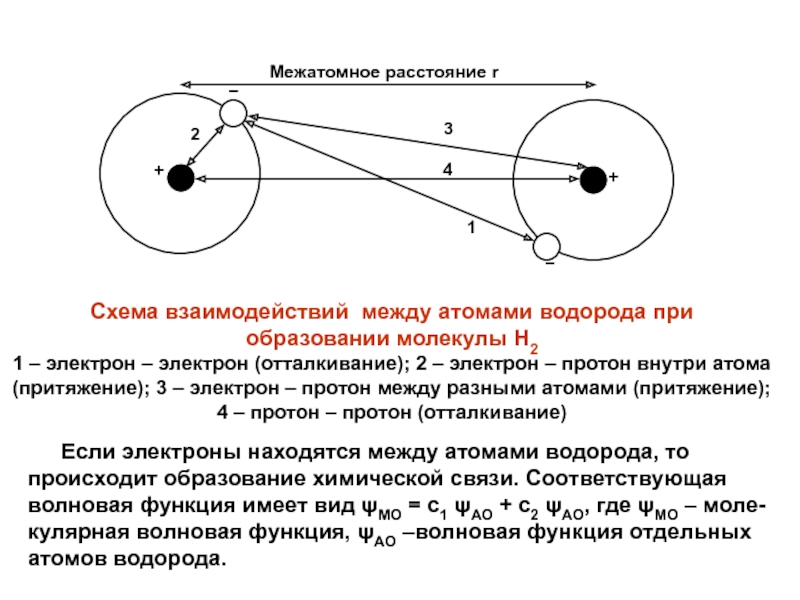
- 4. 1Межатомное расстояние r ++234Схема взаимодействий между атомами
- 5. Слайд 5
- 6. Слайд 6
- 7. Слайд 7
- 8. С современной точки
- 9. Слайд 9
- 10. σ-связь (сигма-связь) — химическая связь,
- 11. Слайд 11
- 12. Двойная связь – химическая
- 13. Слайд 13
- 14. Слайд 14
- 15. Слайд 15
- 16. Слайд 16
- 17. Слайд 17
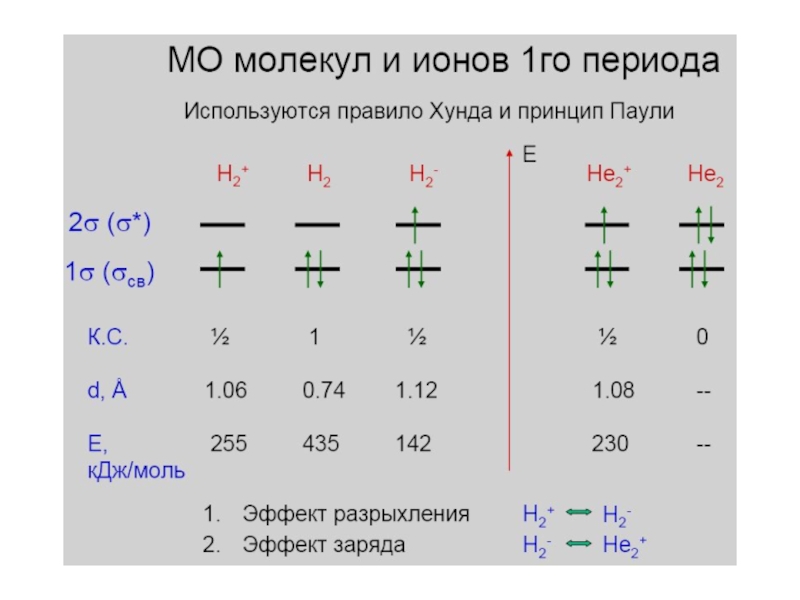
- 18. Метод молекулярных орбиталей 1. Атомные
- 19. Слайд 19
- 20. Слайд 20
- 21. Слайд 21
- 22. Слайд 22
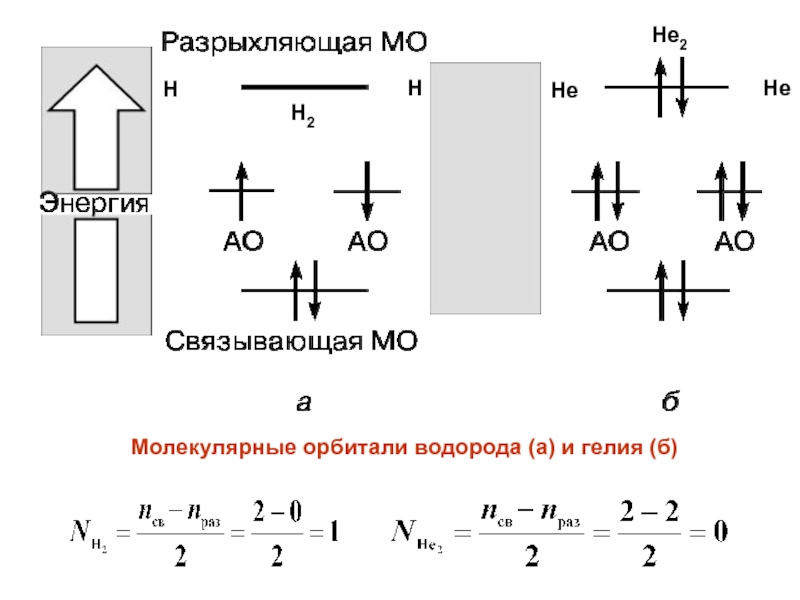
- 23. Молекулярные орбитали водорода (а) и гелия (б)HHH2HeHeHe2
- 24. Слайд 24
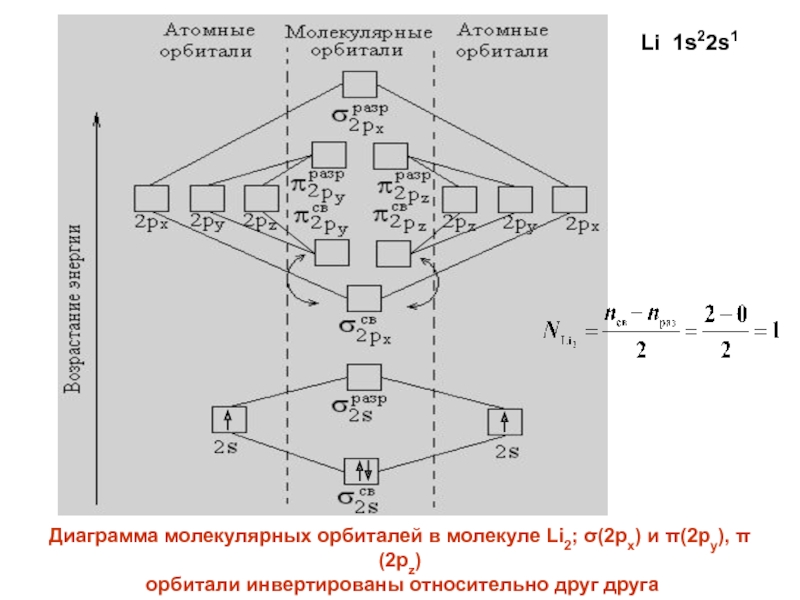
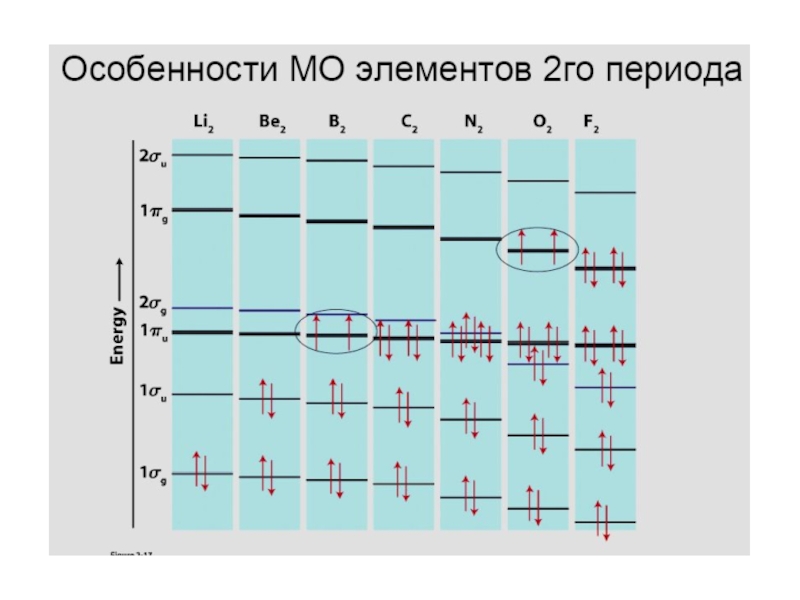
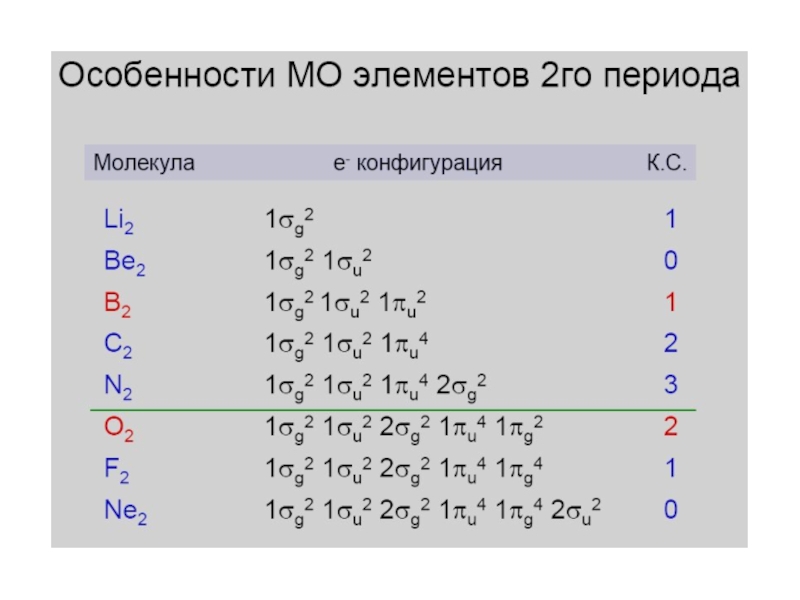
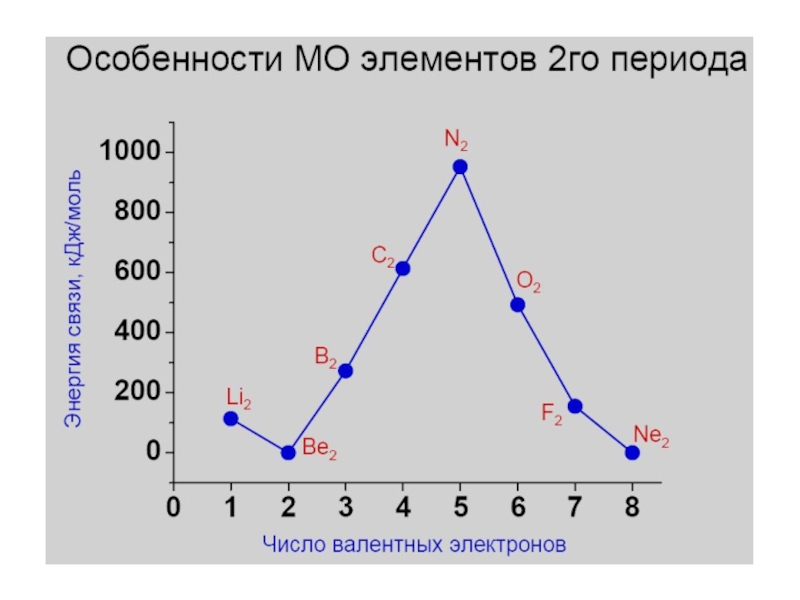
- 25. Диаграмма молекулярных орбиталей в молекуле Li2; (2px)
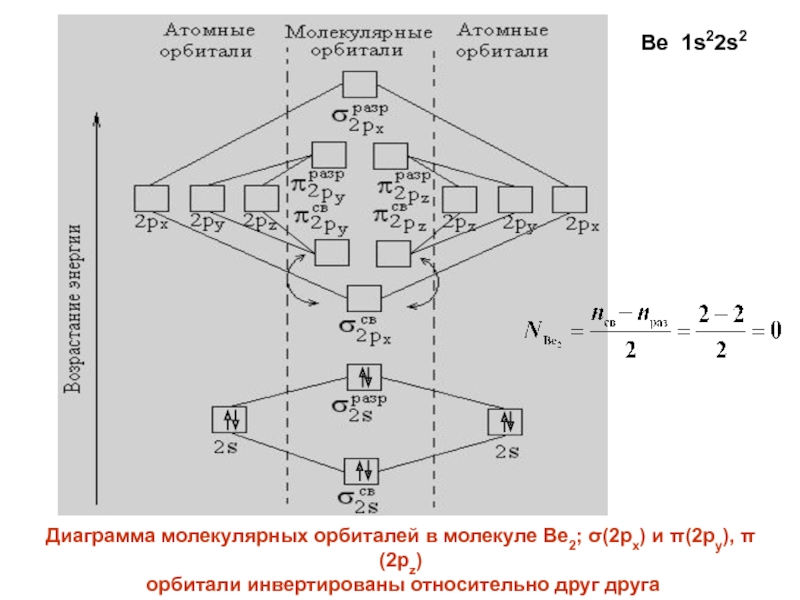
- 26. Диаграмма молекулярных орбиталей в молекуле Be2; (2px)
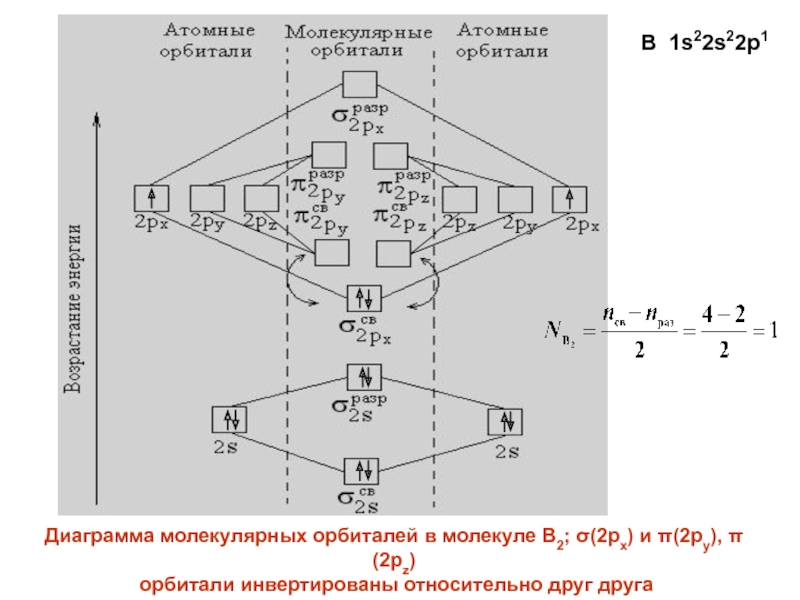
- 27. Диаграмма молекулярных орбиталей в молекуле B2; (2px)
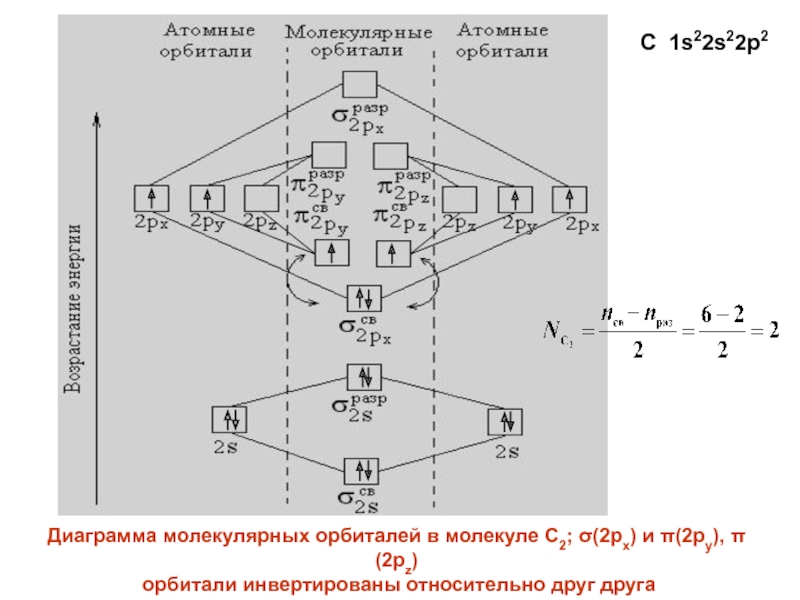
- 28. Диаграмма молекулярных орбиталей в молекуле C2; (2px)
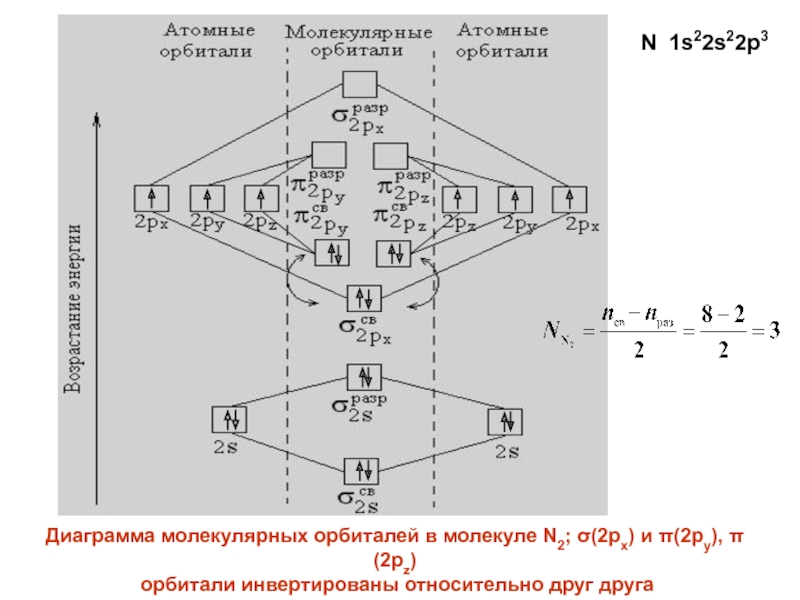
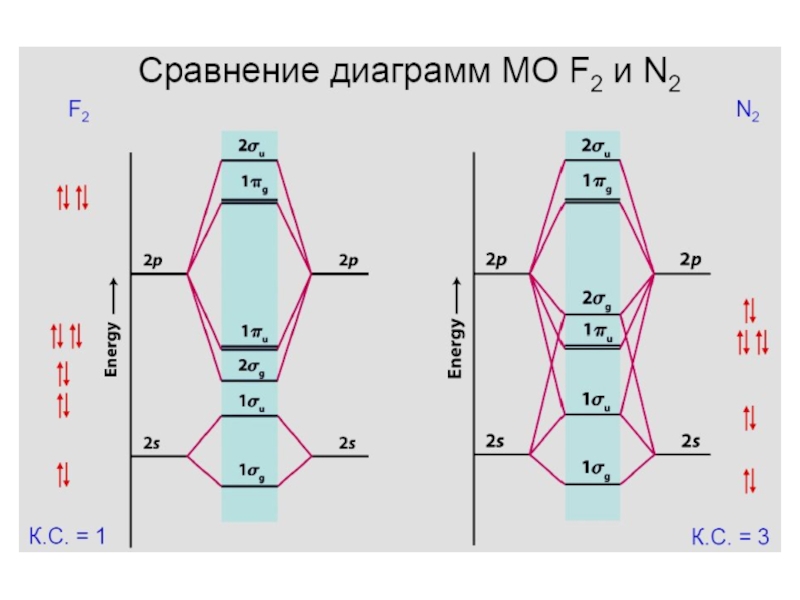
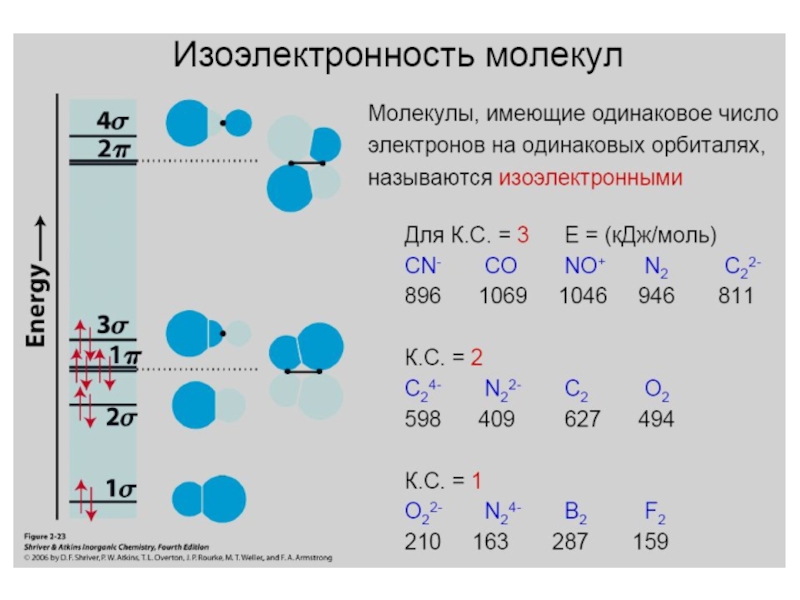
- 29. Диаграмма молекулярных орбиталей в молекуле N2; (2px)
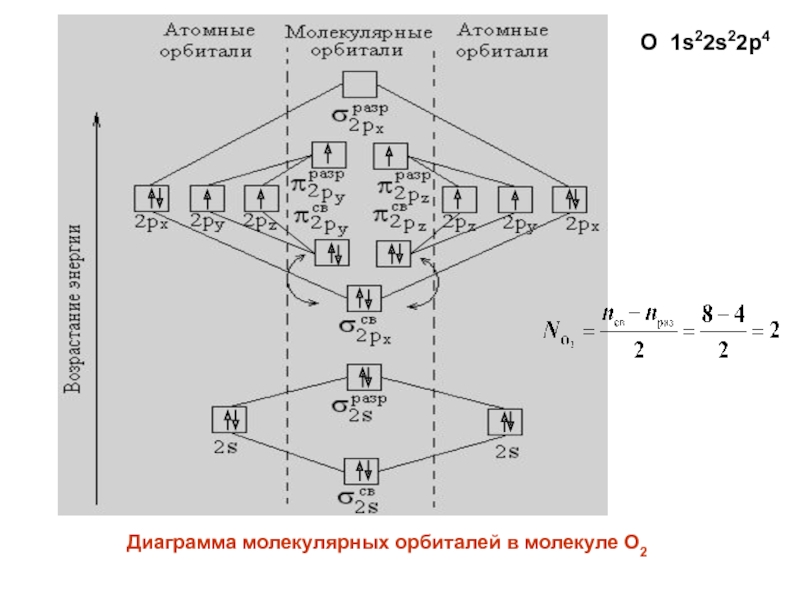
- 30. Диаграмма молекулярных орбиталей в молекуле O2 O 1s22s22p4
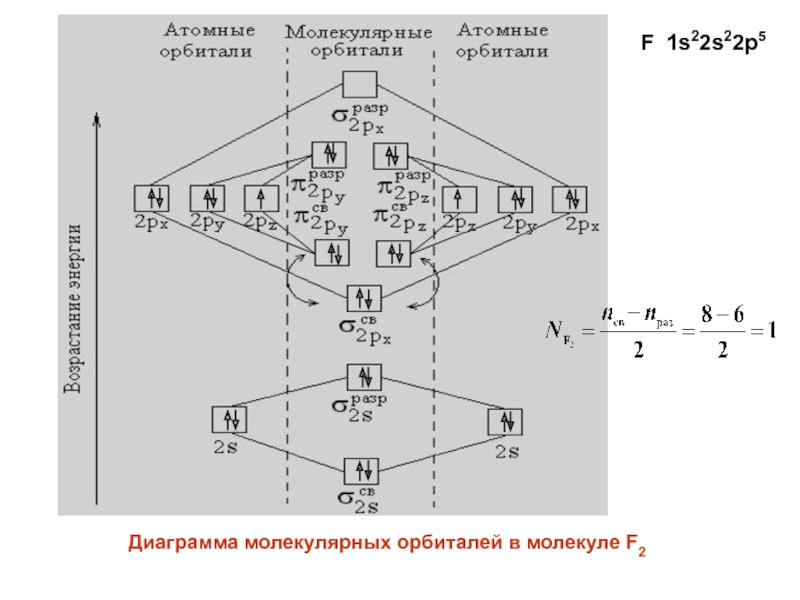
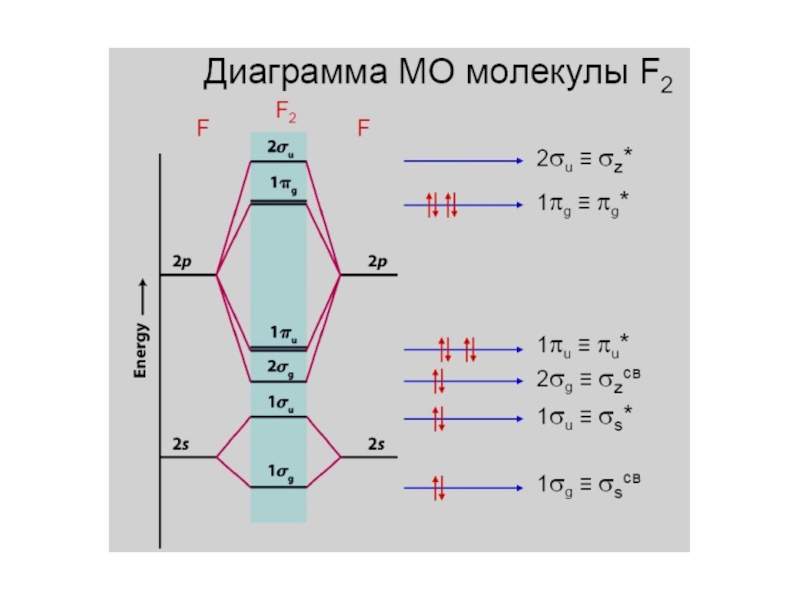
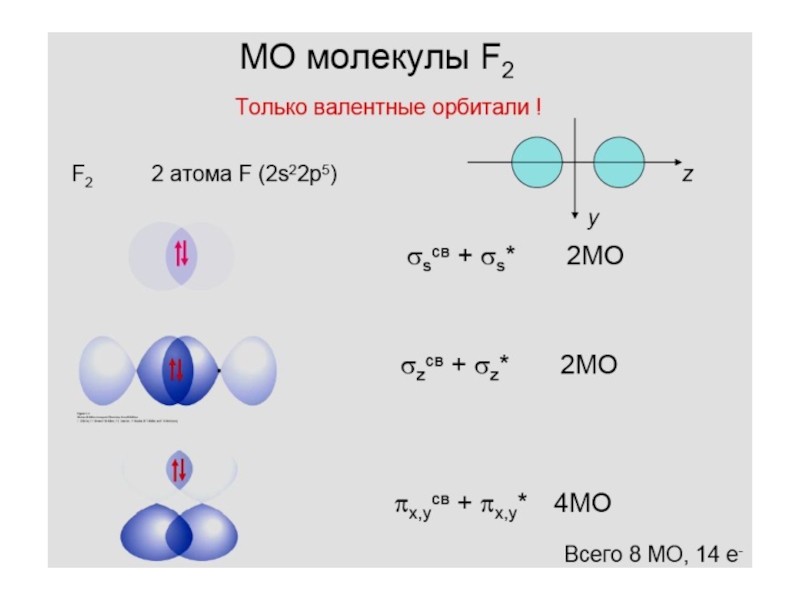
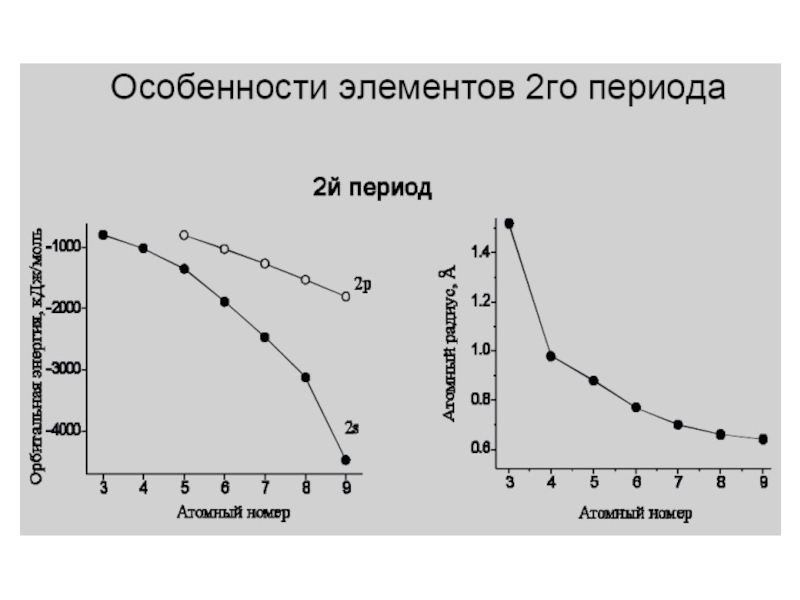
- 31. F 1s22s22p5Диаграмма молекулярных орбиталей в молекуле F2
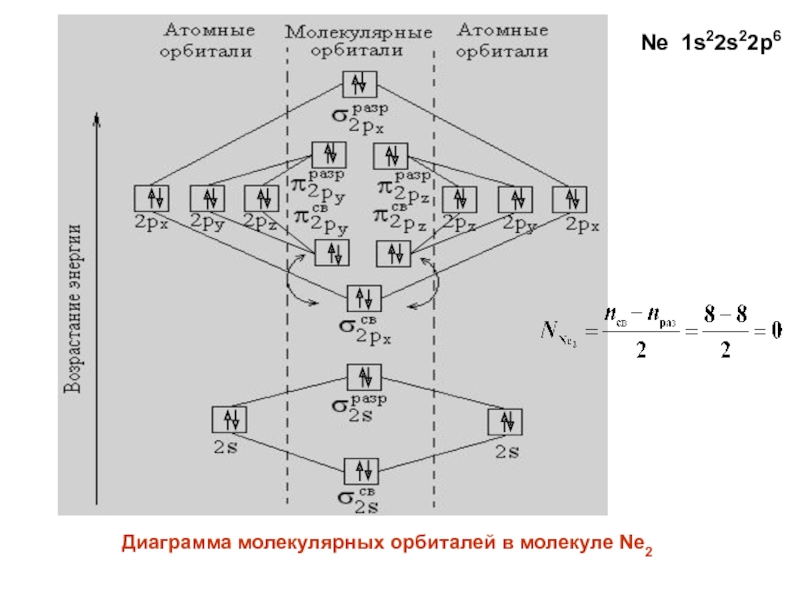
- 32. Ne 1s22s22p6Диаграмма молекулярных орбиталей в молекуле Ne2
- 33. Слайд 33
- 34. Слайд 34
- 35. Слайд 35
- 36. Слайд 36
- 37. Слайд 37
- 38. Слайд 38
- 39. Слайд 39
- 40. Слайд 40
- 41. Слайд 41
- 42. Слайд 42
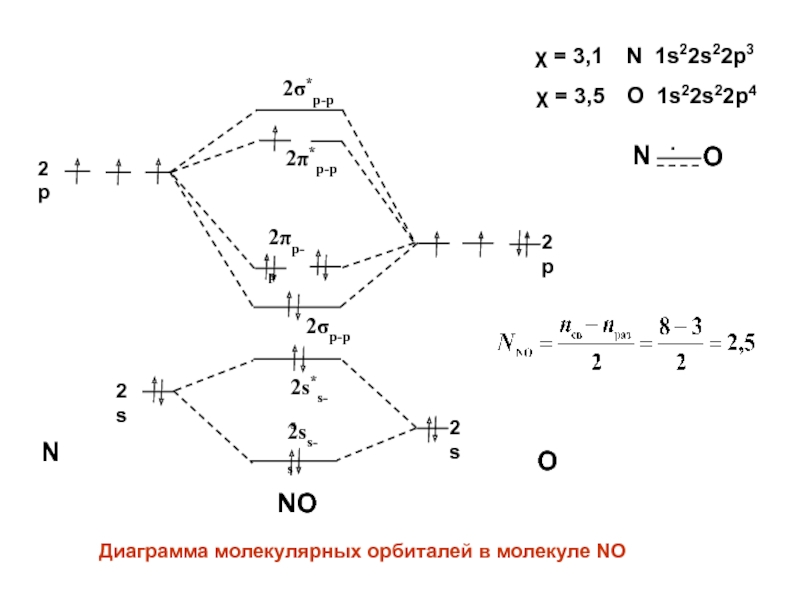
- 43. NONO2s2p2s2p2p-p2p-p2*p-p2*p-pДиаграмма молекулярных орбиталей в молекуле NО = 3,5 O 1s22s22p4 = 3,1 N 1s22s22p3NO2ss-s2s*s-s
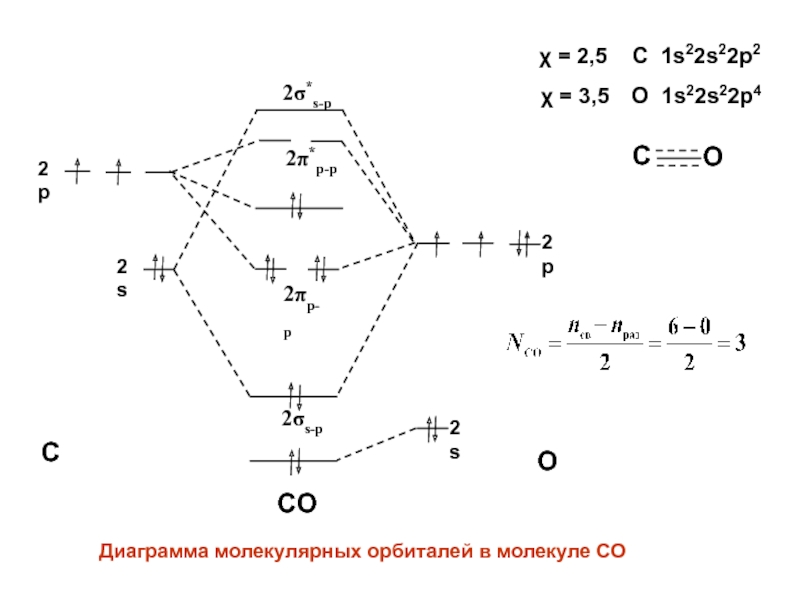
- 44. СOСO2s2p2s2p2s-p2p-p2*s-p2*p-pДиаграмма молекулярных орбиталей в молекуле СО = 2,5 C 1s22s22p2СO = 3,5 O 1s22s22p4
- 45. Слайд 45
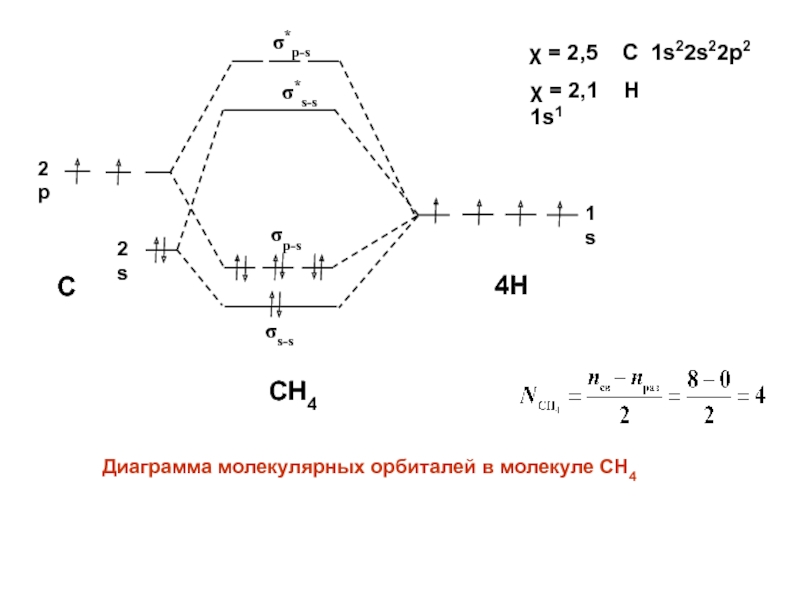
- 46. C4HCH41s2s2p*s-sДиаграмма молекулярных орбиталей в молекуле СН4 = 2,1 Н 1s1*p-ss-sp-s = 2,5 C 1s22s22p2
- 47. Слайд 47
- 48. Благодарю за внимание
- 49. Скачать презентанцию
Слайды и текст этой презентации
Слайд 1Курс «Общая химия»
Лектор: проф. Майстренко Валерий Николаевич
Башкирский государственный университет
Кафедра неорганической
химии
Слайд 41
Межатомное расстояние r
+
+
2
3
4
Схема взаимодействий между атомами водорода при
образовании
молекулы Н2
1 – электрон – электрон (отталкивание); 2 – электрон
– протон внутри атома(притяжение); 3 – электрон – протон между разными атомами (притяжение);
4 – протон – протон (отталкивание)
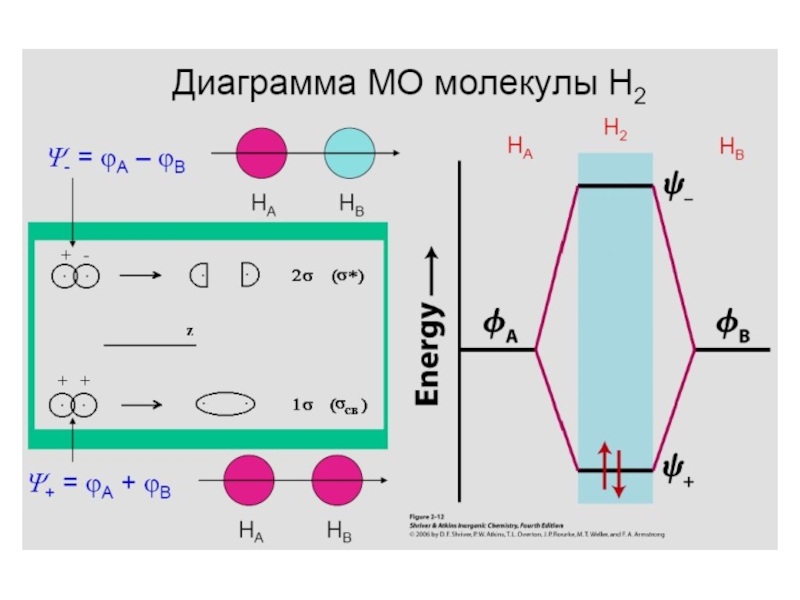
Если электроны находятся между атомами водорода, то происходит образование химической связи. Соответствующая волновая функция имеет вид MO = с1 AO + с2 AO, где MO – моле-кулярная волновая функция, AO –волновая функция отдельных атомов водорода.
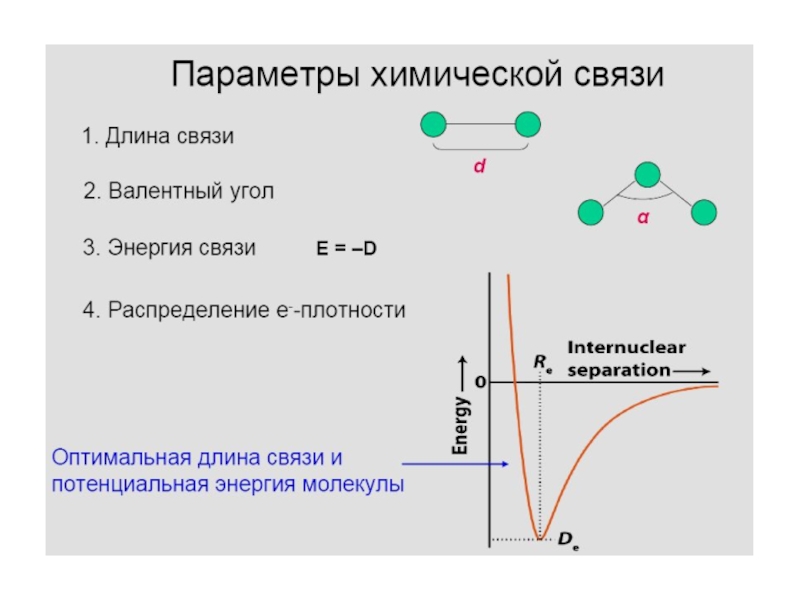
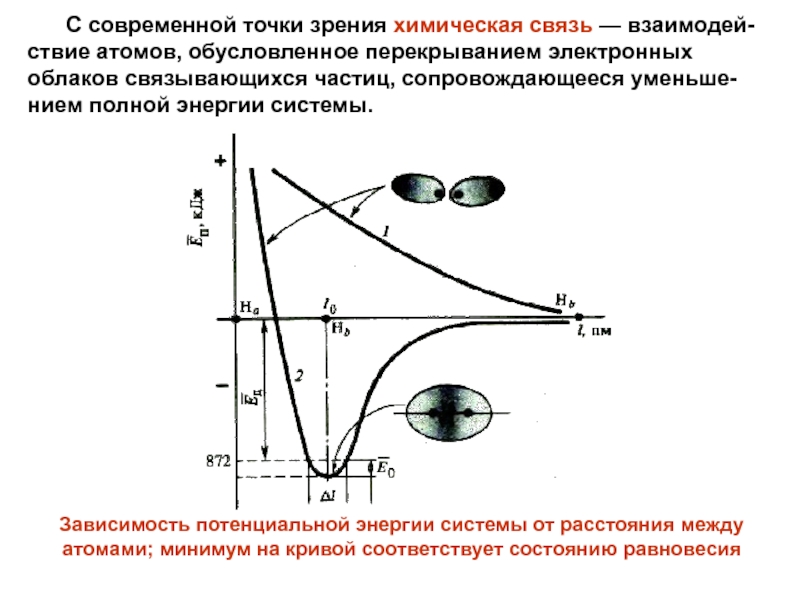
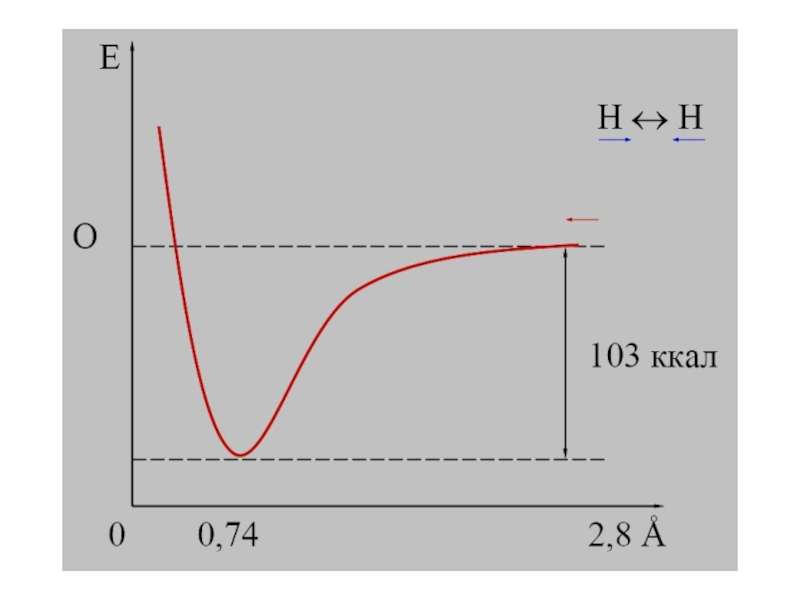
Слайд 8 С современной точки зрения химическая связь —
взаимодей-ствие атомов, обусловленное перекрыванием электронных облаков связывающихся частиц, сопровождающееся уменьше-нием
полной энергии системы.Зависимость потенциальной энергии системы от расстояния между
атомами; минимум на кривой соответствует состоянию равновесия
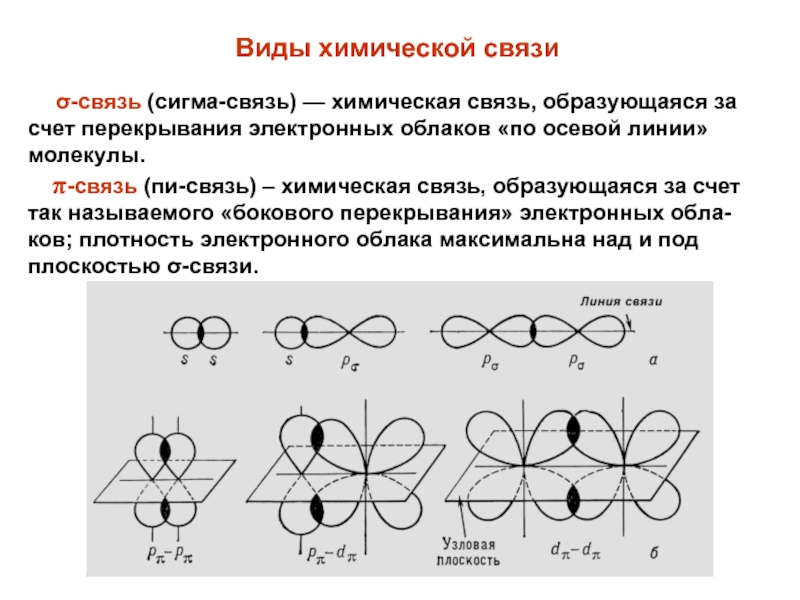
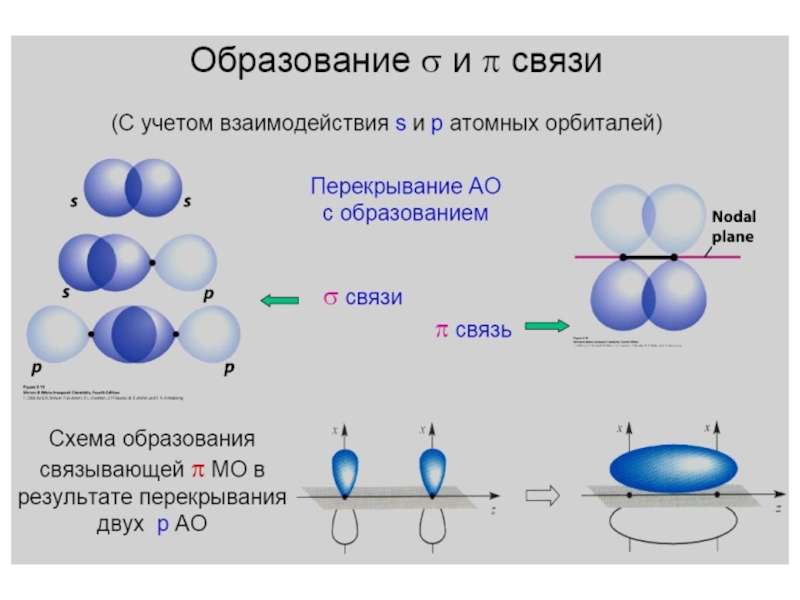
Слайд 10 σ-связь (сигма-связь) — химическая связь, образующаяся за счет
перекрывания электронных облаков «по осевой линии» молекулы.
π-связь (пи-связь)
– химическая связь, образующаяся за счет так называемого «бокового перекрывания» электронных обла-ков; плотность электронного облака максимальна над и под плоскостью σ-связи. Виды химической связи
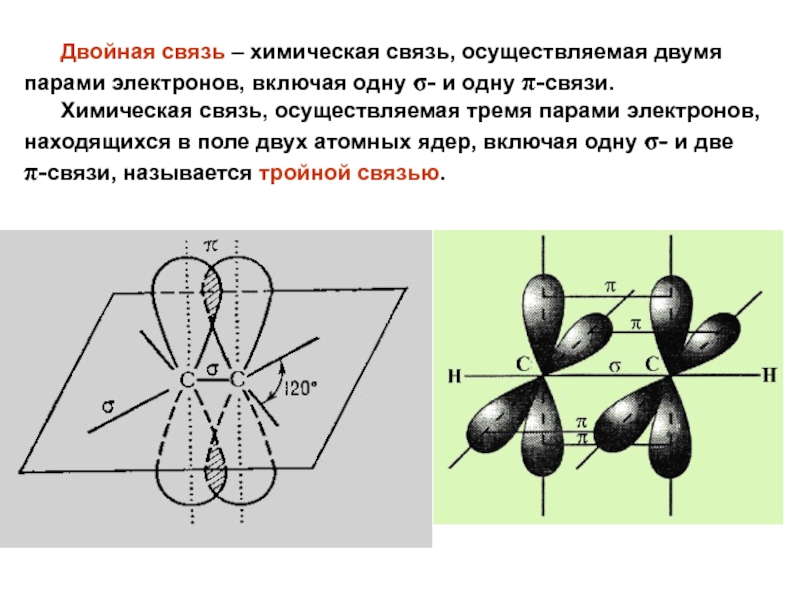
Слайд 12 Двойная связь – химическая связь, осуществляемая двумя
парами электронов, включая одну σ- и одну π-связи.
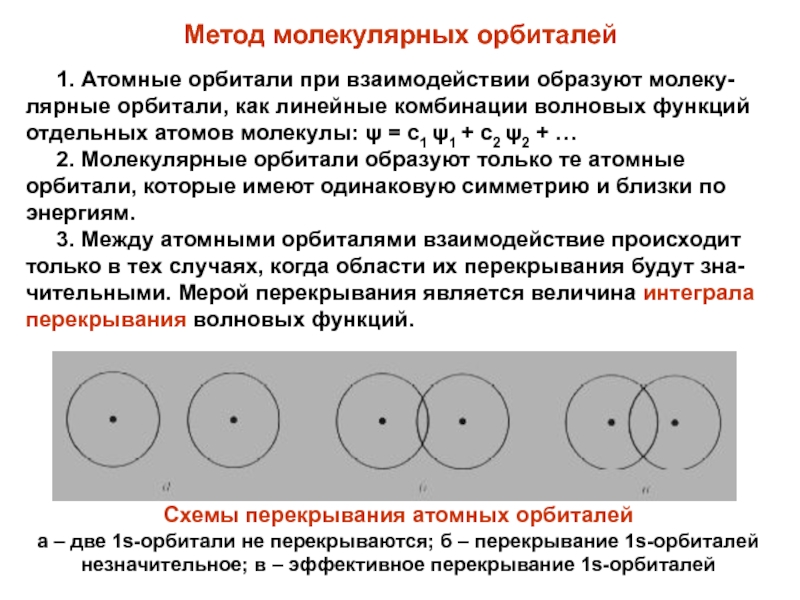
Химическая связь, осуществляемая тремя парами электронов, находящихся в поле двух атомных ядер, включая одну σ- и две π-связи, называется тройной связью. Слайд 18Метод молекулярных орбиталей
1. Атомные орбитали при взаимодействии
образуют молеку-лярные орбитали, как линейные комбинации волновых функций отдельных атомов
молекулы: = с1 1 + с2 2 + …2. Молекулярные орбитали образуют только те атомные орбитали, которые имеют одинаковую симметрию и близки по энергиям.
3. Между атомными орбиталями взаимодействие происходит только в тех случаях, когда области их перекрывания будут зна-чительными. Мерой перекрывания является величина интеграла перекрывания волновых функций.
Схемы перекрывания атомных орбиталей
а – две 1s-орбитали не перекрываются; б – перекрывание 1s-орбиталей незначительное; в – эффективное перекрывание 1s-орбиталей