Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Лекции: ЭНЗИМОЛОГИЯ
Содержание
- 1. Лекции: ЭНЗИМОЛОГИЯ
- 2. ЛЕКЦИЯ № 2КЛАССИФИКАЦИЯ ФЕРМЕНТОВ
- 3. Актуальность темыНоменклатура и классификация ферментов – «путеводитель»
- 4. План лекцииНоменклатура ферментовКлассы ферментов:характеристика структурных единиц классификатора (классов, подклассов)примеры ферментов
- 5. Цель Знать:принципы номенклатуры и классификации ферментовхарактеристику классов
- 6. Номенклатура IUBMBНоменклатура международного союза биохимии и молекулярной
- 7. Номенклатура ферментов: исключения из правилаИсключение 1.Тривиальные названия:
- 8. Номенклатура ферментов: исключения из правилаИсключение 3. Продукт
- 9. Номенклатура ферментов: исключения из правилаИсключение 4. Продукт
- 10. Классы ферментовОснова деления ферментов на классы:тип катализируемой
- 11. Что означает код фермента (КФ)?КФ 1.1.1.1. Алкоголь:
- 12. Характеристика классов ферментов Что нужно знать?Тип катализируемой
- 13. Класс 1. ОксидоредуктазыТип реакций: окислительно-восстановительные (перенос электронов
- 14. Оксидоредуктазы Реакции с участием О2 как окислителяО2
- 15. Группы оксидоредуктазОксидоредуктазы можно разделить на группы вне
- 16. Оксидоредуктазы: ОксидазыТип реакций: перенос электронов и протонов
- 17. Оксидоредуктазы: Аэробные дегидрогеназыТип реакций: дегидрированиеАкцептор водорода: кислородПродукт
- 18. Оксидоредуктазы: Анаэробные дегидрогеназыТип реакций: дегидрированиеАкцептор водорода –
- 19. Оксидоредуктазы: Анаэробные дегидрогеназыФерменты цикла Кребса – метаболического процесса энергетического обмена
- 20. Оксидоредуктазы: ОксигеназыТип реакций: окисление субстрата путем включения
- 21. Оксидоредуктазы: Оксигеназы
- 22. Роль монооксигеназных реакцийОкисление фенилаланина с образованием тирозина,
- 23. Монооксигеназы как ферменты микросомальной системы гидроксилирования (МСГ)цитохром
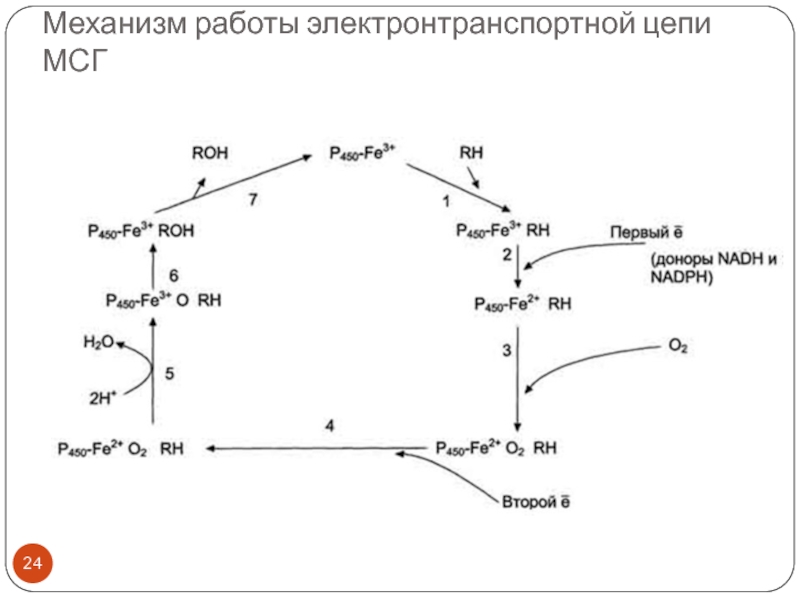
- 24. Механизм работы электронтранспортной цепи МСГ
- 25. Механизм работы электронтранспортной цепи МСГ (см. схему
- 26. Оксидоредуктазы: ГидропероксидазыТип реакции: перенос электронов и протонов
- 27. Оксидоредуктазы: ГидропероксидазыПример: каталаза«Чемпион» в мире катализа (один
- 28. Оксидоредуктазы - антиоксидантыАнтиоксиданты – ингибиторы процессов свободно-радикального
- 29. Класс 2. ТрансферазыТип реакций: перенос групп атомов
- 30. АминотрансферазыПеренос NH2-группы с аминокислоты на кетокислоту с
- 31. МетилтрансферазыSAM (S-аденозилметионин) – активная форма метионина – донора CH3Источник аденозила - АТФ Норадреналин-метилтрансфераза
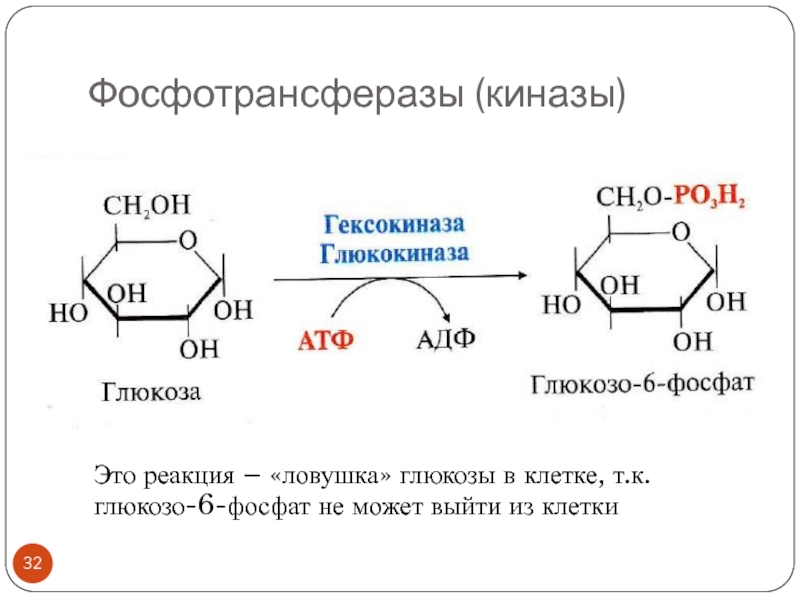
- 32. Фосфотрансферазы (киназы)Это реакция – «ловушка» глюкозы в клетке, т.к.глюкозо-6-фосфат не может выйти из клетки
- 33. Класс 3. ГидролазыТип реакций: гидролиз (расщепление ковалентной
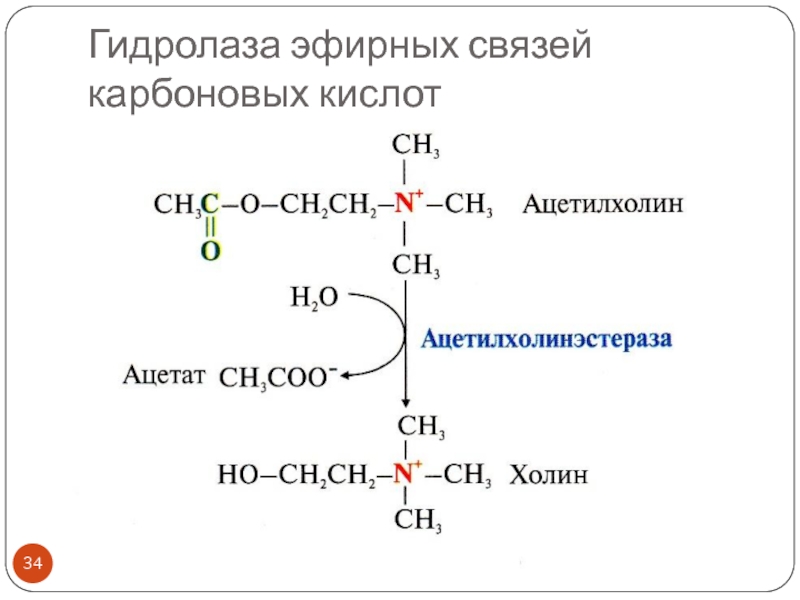
- 34. Гидролаза эфирных связей карбоновых кислот
- 35. Класс 4. ЛиазыКатализируют два типа реакций:Тип реакций
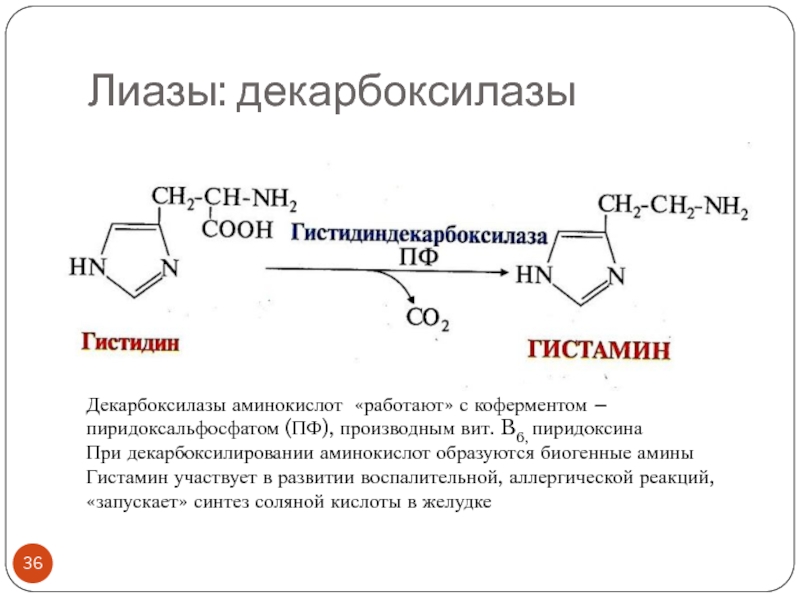
- 36. Лиазы: декарбоксилазыДекарбоксилазы аминокислот «работают» с коферментом –
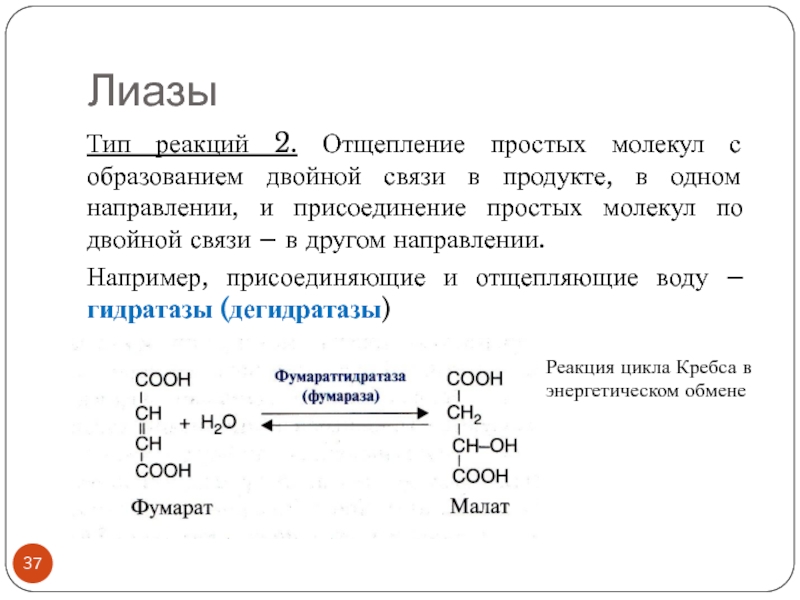
- 37. ЛиазыТип реакций 2. Отщепление простых молекул с
- 38. Класс 5. ИзомеразыТип реакций: внутримолекулярные превращения (образование
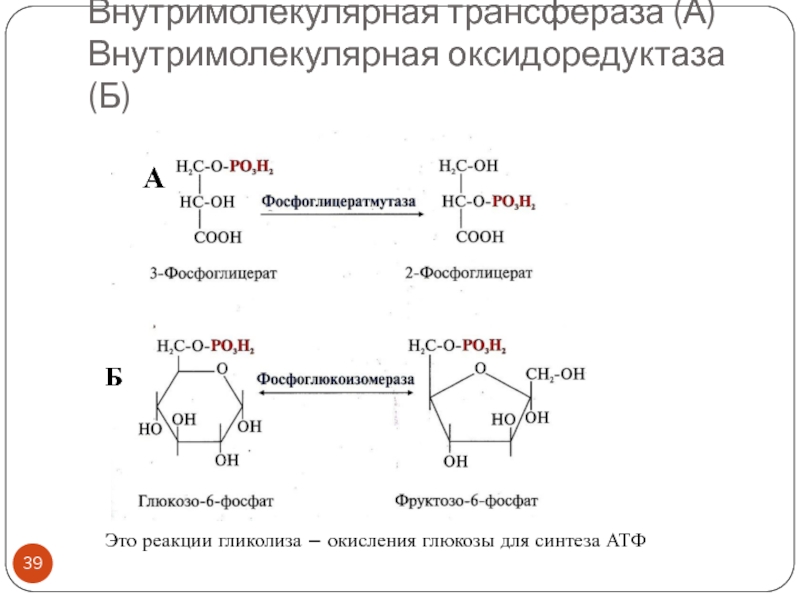
- 39. Внутримолекулярная трансфераза (А) Внутримолекулярная оксидоредуктаза (Б)АБЭто реакции гликолиза – окисления глюкозы для синтеза АТФ
- 40. Класс 6. Лигазы (синтетазы)Тип реакций: соединение двух
- 41. С-С лигазы, образующие СООННазвание: субстрат + карбоксилазаВ
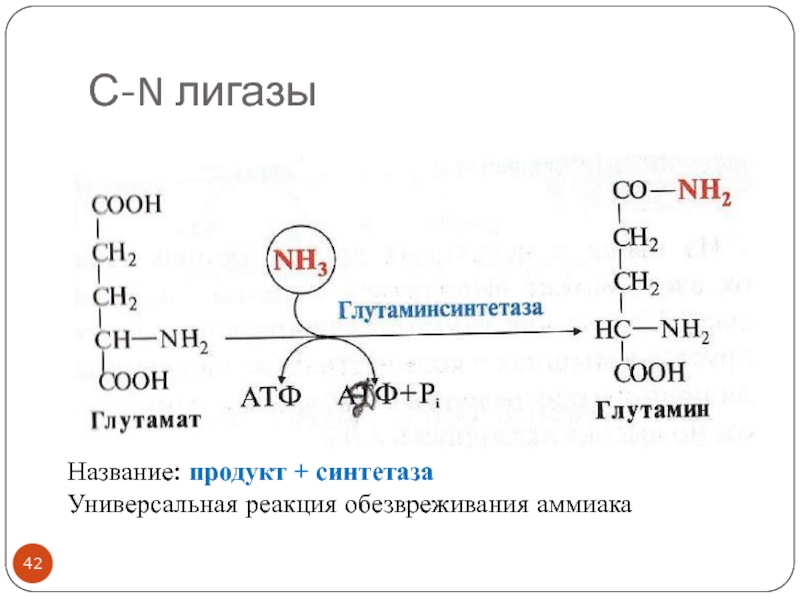
- 42. С-N лигазыНазвание: продукт + синтетазаУниверсальная реакция обезвреживания аммиака
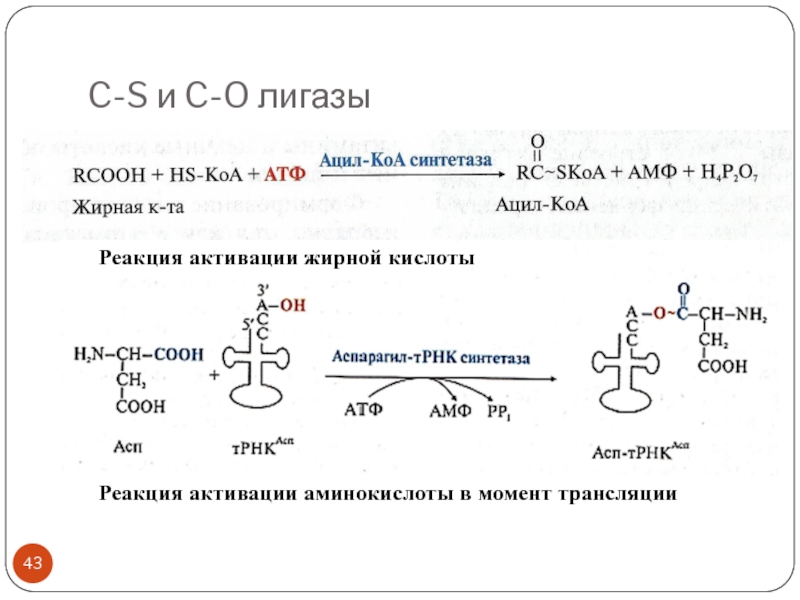
- 43. C-S и C-O лигазыРеакция активации жирной кислотыРеакция активации аминокислоты в момент трансляции
- 44. Задание для самостоятельной работы1. Используя материал слайдов
- 45. Задания для самоконтроля Задание 1. Определите класс
- 46. Задания для самоконтроля (продолжение)S + H2O →
- 47. Задания для самоконтроля Задание 2. Сравните 2
- 48. Задания для самоконтроля Задание 3. Объясните разницу
- 49. ЗаключениеВ настоящее время число различных известных реакций,
- 50. Литература1. Биохимия: учебник для вузов / Е.
- 51. Скачать презентанцию
Слайды и текст этой презентации
Слайд 1
Дисциплина: биохимия (Б1.Б.15)
Специальность: педиатрия (31.05.02)
НГМУ, кафедра медицинской химии
Д.б.н., доцент Суменкова
Дина Валерьевна
Слайд 3Актуальность темы
Номенклатура и классификация ферментов – «путеводитель» в мире ферментов,
который по названию фермента позволяет определить тип катализируемой реакции и
субстрат искомых ферментов, в том числе используемых в диагностике заболеванийПример: инфаркт миокарда
Какие реакции в кардиомиоцитах катализируют данные ферменты? Ответ на вопрос – в названии ферментов!
Значительно повышается активность
аспартат- и аланинаминотрансфераз,
креатинкиназы, лактатдегидрогеназы
Слайд 4План лекции
Номенклатура ферментов
Классы ферментов:
характеристика структурных единиц классификатора (классов, подклассов)
примеры ферментов
Слайд 5Цель
Знать:
принципы номенклатуры и классификации ферментов
характеристику классов ферментов и основных
подклассов
примеры реакций, катализируемых ферментами разных классов
Знания номенклатуры и классификации ферментов
необходимы для понимания сущности химических превращений, катализируемых основными ферментами организма детей и подростков, в том числе используемыми в диагностике заболеванийСлайд 6Номенклатура IUBMB
Номенклатура международного союза биохимии и молекулярной биологии (1961 г)
Название фермента:
название субстрата (или субстратов) + тип реакции + аза
ПРИМЕР:
алкоголь:
NAD+ оксидоредуктаза (алкогольдегидрогеназа)Слайд 7Номенклатура ферментов: исключения из правила
Исключение 1.
Тривиальные названия: пепсин, трипсин, ренин
Исключение
2. Субстрат + аза
Карбоксипептидаза
Амилаза (amylum – крахмал)
Липаза
РНКаза
Альдолаза
Енолаза
Ферменты, катализирующие реакции расщепления
связей:гидролазы,
лиазы (альдолаза, енолаза)
Слайд 8Номенклатура ферментов:
исключения из правила
Исключение 3. Продукт + синтаза
Метионинсинтаза
Тимидилатсинтаза
Цитратсинтаза
Аминолевулинатсинтаза
Название метионинсинтазы
по номенклатуре: гомоцистеин метилтрансфер аза
Синтазы встречаются и среди ферментов других
классов (например, лиазы – уропорфириногенсинтаза)Ферменты, катализирующие реакции переноса группы атомов с одного субстрата на другой (трансферазы)
Слайд 9Номенклатура ферментов:
исключения из правила
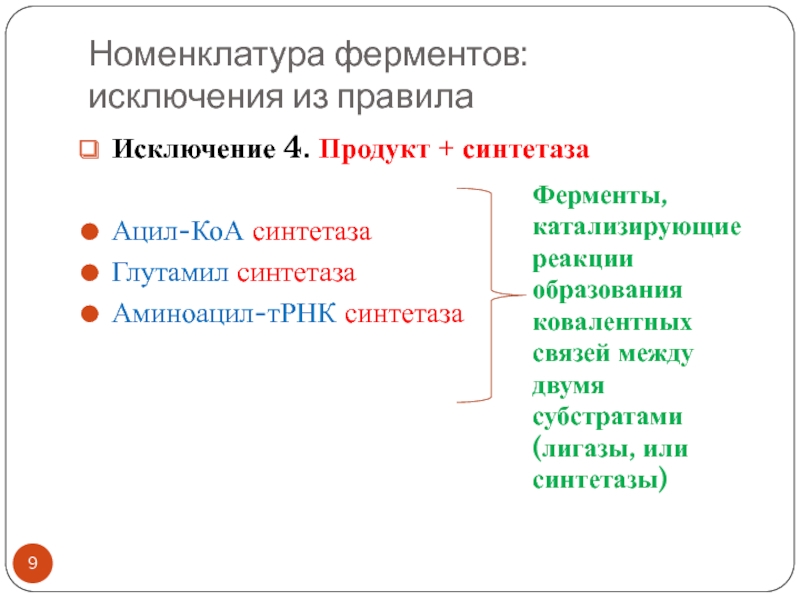
Исключение 4. Продукт + синтетаза
Ацил-КоА синтетаза
Глутамил синтетаза
Аминоацил-тРНК
синтетаза
Ферменты, катализирующие реакции образования ковалентных связей между двумя субстратами (лигазы,
или синтетазы)Слайд 10Классы ферментов
Основа деления ферментов на классы:
тип катализируемой реакции (реакционная, или
каталитическая специфичность)
6 КЛАССОВ ФЕРМЕНТОВ :
1. Оксидоредуктазы
2. Трансферазы
3. Гидролазы
4. Лиазы
5. Изомеразы
6.
ЛигазыКлассы делят на подклассы, подподклассы
Каждый фермент имеет кодовый номер
Слайд 11Что означает код фермента (КФ)?
КФ 1.1.1.1. Алкоголь: NAD+ оксидоредуктаза (алкогольдегидрогеназа)
1
- Класс: оксидоредуктазы (реакции окисления-восстановления)
1 - Подкласс: действующие на СН-ОН
группу доноров1 - Подподкласс: с NAD+ в качестве акцептора
1 – Порядковый номер фермента в группе
CH3 CH2OH + NAD+ ↔ CH3CHO + NADH + H+
Слайд 12Характеристика классов ферментов
Что нужно знать?
Тип катализируемой реакции
Принцип деления на подклассы
Кофакторы,
коферменты (если есть)
Как складывается название ферментов данного класса
Пример фермента и
реакцииРоль названной реакции в обмене веществ
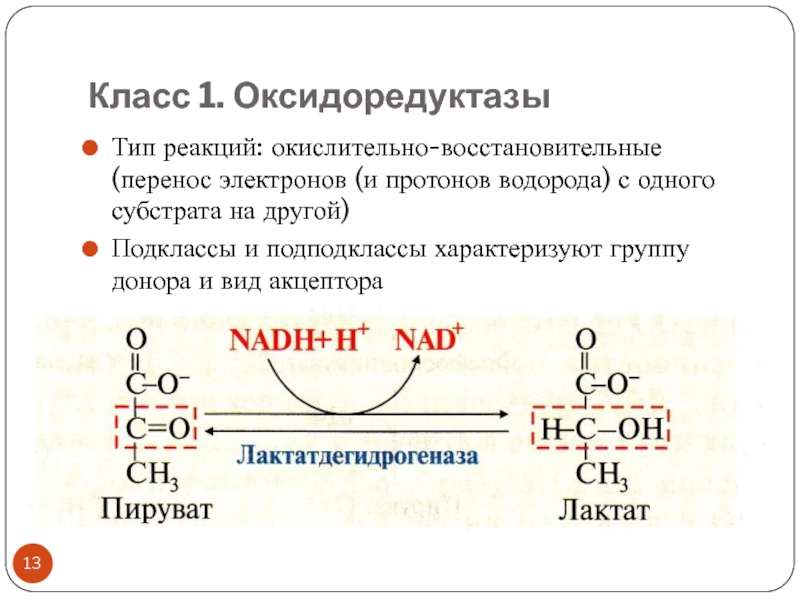
Слайд 13Класс 1. Оксидоредуктазы
Тип реакций: окислительно-восстановительные (перенос электронов (и протонов водорода)
с одного субстрата на другой)
Подклассы и подподклассы характеризуют группу донора
и вид акцептораакцепторы-коферменты: NAD+ , NADP + (vit PP), FAD, FMN (vit B2)
Слайд 14Оксидоредуктазы
Реакции с участием О2 как окислителя
О2 – акцептор электронов
и протонов (атома водорода), переносимых с окисляемого субстрата
Оксидазы
Аэробные дегидрогеназы
О2 –
встраивается в субстрат, окисляя его (меняя степень окисления атома С)Оксигеназы: моно- и диоксигеназы
Реакции без участия О2
Роль акцептора выполняют другие вещества или коферменты NAD, NADP (производные вит. РР, или В3), реже FAD, FMN (производные вит. В2)
Анаэробные дегидрогеназы
Реакции с участием Н2О2 как окислителя
Гидропероксидазы (Н2О2 превращается в воду)
Слайд 15Группы оксидоредуктаз
Оксидоредуктазы можно разделить на группы вне структуры классификатора (то
есть не на подклассы). В одной группе могут быть ферменты
разных подклассов.Оксидазы
Аэробные дегидрогеназы
Оксигеназы
Анаэробные дегидрогеназы
Гидропероксидазы
Слайд 16Оксидоредуктазы: Оксидазы
Тип реакций: перенос электронов и протонов водорода (дегидрирование) с
одного субстрата на другой
Акцептор водорода: кислород
Продукт реакции: вода
Кофакторы: медь, железо
(в активном центре участвуют в переносе электронов)Название: субстрат + оксидаза
ПРИМЕР: цитохром-с оксидаза
Фермент процесса тканевого дыхания в митохондриях, где электроны, высвобождаемые из молекул различных субстратов при их полном окислении в клетке, переносятся на кислород с образованием метаболический воды
О2 + 4Н+ + 4 е- → 2Н2О
Fe 3+ + e- → Fe2+ / Fe 2+ - e- → Fe3+
Cu 2+ + e- → Cu 1+ / Cu 1+ - e- → Cu 2+
Слайд 17Оксидоредуктазы:
Аэробные дегидрогеназы
Тип реакций: дегидрирование
Акцептор водорода: кислород
Продукт реакции: Н2О2
Кофермент (простетическая группа):
FMN, FAD (производные вит. В2 - рибофлавина)
Кофакторы: ионы металлов
Кофакторы и
коферменты – посредники в переносе электронов и протонов. В структуре кофермента именно витамин принимает и передает электроны, являясь, таким образом, «рабочей частью» кофермента.Название: субстрат + оксидаза
ПРИМЕР: ксантиноксидаза (FAD, Mo2+, Fe3+)
ксантин + O2 + H2O → мочевая кислота + Н2О2
(реакция катаболизма пуриновых нуклеотидов)
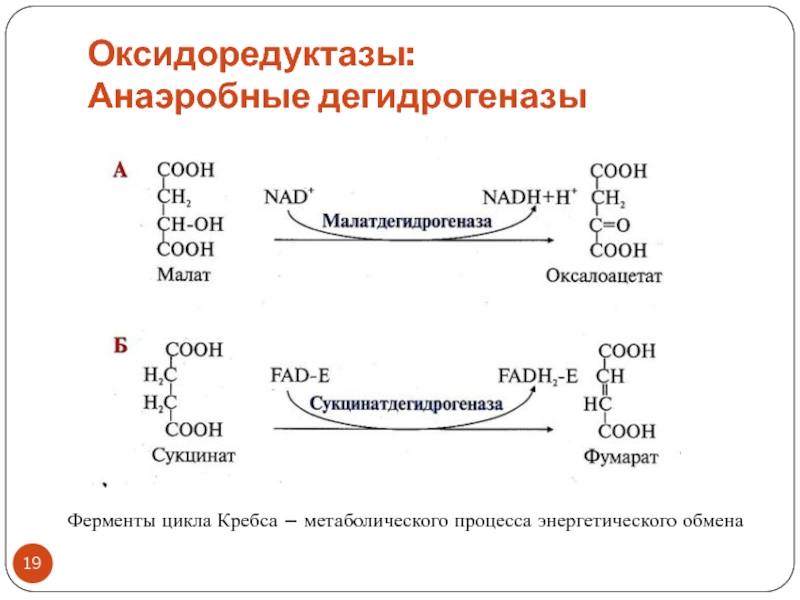
Слайд 18Оксидоредуктазы:
Анаэробные дегидрогеназы
Тип реакций: дегидрирование
Акцептор водорода – коферменты:
обычно NAD+ , NADP+
(производные вит. РР, или В3 – никотиновой кислоты)
реже FMN, FAD
(производные вит. В2 – рибофлавина)Образуются восстановленные формы коферментов – NADH+H+, NADPH+H+, FADH2, FMNH2
«Рабочей частью» коферментов, принимающей электроны и протоны, являются витамины
Название: субстрат + дегидрогеназа или редуктаза
ПРИМЕР: алкогольдегидрогеназа, глутатионредуктаза
Название «субстрат+дегидрогеназа» подчеркивает важную роль процесса окисления субстрата
Название «субстрат+редуктаза» подчеркивает важную роль процесса восстановления субстрата
Слайд 19Оксидоредуктазы:
Анаэробные дегидрогеназы
Ферменты цикла Кребса – метаболического процесса энергетического обмена
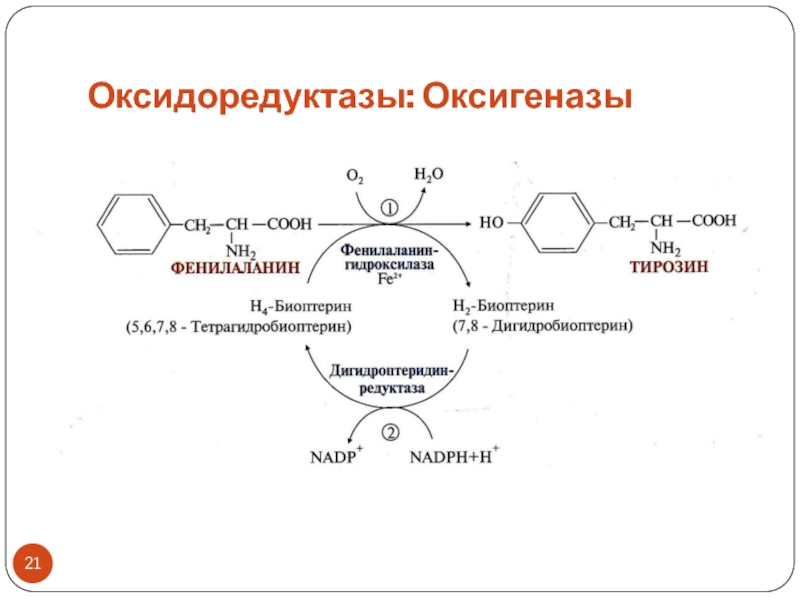
Слайд 20Оксидоредуктазы: Оксигеназы
Тип реакций: окисление субстрата путем включения кислорода в субстрат
(диоксигеназы и монооксигеназы)
Кофакторами могут быть железо или медь
Коферментами могут быть
NADPH+H+, витамин СМонооксигеназы (или гидроксилазы) – включают в субстрат 1 атом кислорода с образованием в субстрате -ОН, другой атом кислорода восстанавливается до воды с участием косубстрата как донора Н2 (обычно это NADPH+H+)
Название монооксигеназ: субстрат + гидроксилаза или монооксигеназа
ПРИМЕР: фенилаланингидроксилаза (реакция окисления фенилаланина с образованием тирозина)
Название диоксигеназ: диоксигеназа + субстрат
ПРИМЕР: диоксигеназа гомогентизиновой кислоты (реакция катаболизма тирозина)
Слайд 22Роль монооксигеназных реакций
Окисление фенилаланина с образованием тирозина, условно заменимой аминокислоты,
необходимой для синтеза тиреоидных гормонов, катехоламинов, меланина.
Окисление холестерина с образованием
желчных кислот, необходимых для усвоения пищевого жира.Окисление холекальциферола (витамина Д3) с образованием кальцитриола – гормона , регулирующего обмен кальция и фосфора.
Окисление прегненолона и прогестерона с образованием стероидных гормонов (кортизола, альдостерона, половых гормонов).
Окисление ксенобиотиков, включая лекарственные препараты, в процессе их обезвреживания в печени.
Слайд 23Монооксигеназы как ферменты микросомальной системы гидроксилирования (МСГ)
цитохром Р-450-содержащие монооксигеназы микросом
печени – ферменты метаболизма ксенобиотиков (например, лекарственных препаратов)
R-Н + О2
+ цитохром Р-450 (Fe 3+) + NADPH + H+ → R-ОН + Н2О + NADP+
R-H – субстрат окисления (гидрофобный ксенобиотик)
R-OH – продукт микросомального окисления (гидрофильный за счет образования -ОН, что способствует его выведению из организма с мочой)
Железо в составе гема цитохрома Р-450 участвует в передаче электронов с NADPH + H+ на атом кислорода с образованием Н2О.
Слайд 25Механизм работы электронтранспортной цепи МСГ (см. схему слайда 22)
(1) Связывание
в активном центре цитохрома Р450 вещества RH активирует восстановление железа
в геме - присоединяется первый электрон (2). Изменение валентности железа увеличивает сродство комплекса P450-Fe2+·RH к молекуле кислорода (3). Появление в центре связывания цитохрома Р450 молекулы О2 ускоряет присоединение второго электрона и образование комплекса P450-Fe2+O2--RH (4).На следующем этапе (5) Fe2+ окисляется, второй электрон присоединяется к молекуле кислорода P450-Fe3+O22-. Восстановленный атом кислорода (О2-) связывает 2 протона, и образуется 1 молекула воды. Второй атом кислорода идёт на построение ОН-группы (6). Модифицированное вещество R-OH отделяется от фермента (7).
Слайд 26Оксидоредуктазы: Гидропероксидазы
Тип реакции: перенос электронов и протонов с окисляемого субстрата
на Н2О2 с образованием Н2О
Кофакторы: железо, селен
Пример: глутатиопероксидаза (ГПО)
Реакция необходима
для восстановления (обезвреживания) сильного окислителя (Н2О2), способного запускать процессы ПОЛ, окислительной модификации белков и нуклеиновых кислот в клетке Кофермент-донор водорода: глутатион GSH (трипептид: γ-глутамил-цистеинил-глицин)
Кофактор: селен
Н2О2 + 2GSH → 2Н2О + GSSG
GSH – восстановленный глутатион (SH - группы цистеина)
GSSG – окисленный глутатион
Восстановление глутатиона после реакции обеспечивает глутатион редуктаза (донор водорода – NADPH+Н+)
Слайд 27Оксидоредуктазы: Гидропероксидазы
Пример: каталаза
«Чемпион» в мире катализа (один из самых «быстрых»
ферментов)
Кофактор: гем (Fe 3+)
2Н2О2 → 2Н2О + О2
Чем
отличается «работа» каталазы и ГПО?Слайд 28Оксидоредуктазы - антиоксиданты
Антиоксиданты – ингибиторы процессов свободно-радикального окисления биомолекул (перекисного
окисления липидов, окислительной модификации белков и нуклеиновых кислот) под действием
активных метаболитов кислородаАктивные метаболиты кислорода – окислители (НО•, Н2О2 , О2·- )
Ферменты-антиоксиданты: каталаза, ГПО, СОД
Супероксиддисмутаза (СОД)
О2·- + О2·- + 2Н+ → Н2О2 + О2
Реакция дисмутации супероксид-аниона довольно быстро протекает спонтанно, но супероксид ещё быстрее реагирует с NO, образуя пероксинитрит – сильнейший окислитель
Супероксиддисмутаза обладает самой высокой скоростью катализа
Слайд 29Класс 2. Трансферазы
Тип реакций: перенос групп атомов с одного субстрата
на другой
Подклассы характеризуют переносящую группу:
Аминотрансферазы
Метилтрансферазы
Фосфотрансферазы (киназы) и
др.Название по номенклатуре:
Субстрат (с которого или на который идет перенос) + переносимая группа + аза
ПРИМЕРЫ:
аланинаминотрансфераза (перенос аминогруппы с аланина на кетокислоту)
норадреналинметилтрансфераза (перенос метильной группы на норадреналин с активной формы метионина)
Два субстрата + переносимая группа + аза
лецитин: холестерол ацилтрансфераза (перенос ацила – остатка жирной кислоты – с лецитина на холестерол в процессе его транспорта из крови в печень)
Субстрат (на который идет перенос) + киназа (перенос фосфатных групп с АТФ)
глюкокиназа (перенос фосфата с АТФ на глюкозу)
Субстрат + фосфорилаза (перенос части субстрата на фосфорную кислоту)
гликогенфосфорилаза (отщепление от гликогена остатка глюкозы с переносом на фосфорную кислоту)
Продукт + синтаза
Примеры см. на слайде 8
Слайд 30Аминотрансферазы
Перенос NH2-группы с аминокислоты на кетокислоту с образованием другой кетокислоты
(из аминокислоты) и другой аминокислоты (из кетокислоты).
Кофермент: пиридоксальфосфат (производное
вит. В6, пиридоксина). Витамин принимает и передает аминогруппу.Пример: аспартатаминотрансфераза
Слайд 31Метилтрансферазы
SAM (S-аденозилметионин) – активная форма метионина – донора CH3
Источник аденозила
- АТФ
Норадреналин-метилтрансфераза
Слайд 32Фосфотрансферазы (киназы)
Это реакция – «ловушка» глюкозы в клетке, т.к.
глюкозо-6-фосфат не
может выйти из клетки
Слайд 33Класс 3. Гидролазы
Тип реакций: гидролиз (расщепление ковалентной связи с присоединением
молекулы воды по месту разрыва)
Подклассы характеризуют тип гидролизуемой связи:
Пептидазы (гидролиз
пептидных связей)Пример: пепсин (переваривание белков пищи)
Гликозидазы (гидролиз гликозидных связей)
Пример: амилаза (переваривание углеводов пищи)
Гидролазы эфирных связей и другие
Примеры: эстеразы, липазы (гидролазы эфирных связей, образованных карбоновыми кислотами), фосфатазы (гидролазы эфирных связей, образованных фосфорной кислотой)
Название по номенклатуре:
Субстрат + аза
Примеры см. на слайде 7
Субстрат + фосфатаза
фосфопротеинфосфатаза (реакция регуляции активности ферментов путем их дефосфорилирования)
Слайд 35Класс 4. Лиазы
Катализируют два типа реакций:
Тип реакций 1: Расщепление связей
негидролитическим путем и отщепление простых молекул (СО2, Н2О, NH2, SH2).
Подклассы
характеризуют вид расщепляемой связи:C-C, C-N, C-O,C-S, P-O лиазы
Название по номенклатуре:
Субстрат + аза
Примеры см. на слайде 7
Субстрат + лиаза
аргининосукцинатлиаза (реакция в цикле обезвреживания аммиака)
Субстрат + декарбоксилаза
(С-С лиазы, расщепляющие связь -СН2-СООН с отщеплением СО2 )
гистидиндекарбоксилаза
Слайд 36Лиазы: декарбоксилазы
Декарбоксилазы аминокислот «работают» с коферментом – пиридоксальфосфатом (ПФ), производным
вит. B6, пиридоксина
При декарбоксилировании аминокислот образуются биогенные амины
Гистамин участвует в
развитии воспалительной, аллергической реакций, «запускает» синтез соляной кислоты в желудкеСлайд 37Лиазы
Тип реакций 2. Отщепление простых молекул с образованием двойной связи
в продукте, в одном направлении, и присоединение простых молекул по
двойной связи – в другом направлении.Например, присоединяющие и отщепляющие воду – гидратазы (дегидратазы)
Реакция цикла Кребса в энергетическом обмене
Слайд 38Класс 5. Изомеразы
Тип реакций: внутримолекулярные превращения (образование изомеров)
Подклассы:
рацемазы (внутримолекулярные превращения
субстратов, имеющих один хиральный атом углерода, например, взаимопревращения L и
D –изомеров)эпимеразы (внутримолекулярные превращения субстратов, имеющих несколько хиральных атомов углерода, например, превращение галактозы в глюкозу)
цис-транс-изомеразы
Внутримолекулярные оксидоредуктазы (окисление одной части молекулы с одновременным восстановлением другой)
Название: субстрат + изомераза
Внутримолекулярные трансферазы (мутазы)
Название: субстрат + мутаза
Слайд 39Внутримолекулярная трансфераза (А)
Внутримолекулярная оксидоредуктаза (Б)
А
Б
Это реакции гликолиза – окисления глюкозы
для синтеза АТФ
Слайд 40Класс 6. Лигазы (синтетазы)
Тип реакций: соединение двух субстратов ковалентной связью
(C-C, C-N, C-O,C-S) с образованием более сложного соединения (синтез нового
вещества, в структуру которого входят оба субстрата)Подклассы характеризуют вид образуемой связи: C-C, C-N, C-O,C-S лигазы
Реакции синтеза сопряжены с затратой энергии АТФ или ГТФ (макроэргические связи подвергаются гидролизу с освобождением энергии)
!!! Не путать с синтазами (это представители трансфераз и некоторых других классов)
Слайд 41С-С лигазы, образующие СООН
Название: субстрат + карбоксилаза
В реакции карбоксилирования участвует
кофермент биоцитин, производное вит. H, или В7, биотина.
Это ключевая реакция
в синтезе глюкозы, а также реакция-поставщик оксалоацетата для цикла Кребса – процесса энергетического обменаСлайд 43C-S и C-O лигазы
Реакция активации жирной кислоты
Реакция активации аминокислоты в
момент трансляции
Слайд 44Задание для самостоятельной работы
1. Используя материал слайдов 22-25, учебник, интернет-ресурсы
объясните роль реакций гидроксилирования и механизм работы электронтранспортной цепи микросомального
окисления ксенобиотиков в печени.2. Используя знания из курса химии, интернет-ресурсы, слайды 26-28, объясните понятие «свободно-радикальное окисление», «перекисное окисление липидов», «активные метаболиты кислорода», «антиоксиданты». Назовите ферменты-антиоксиданты. Какие реакции они катализируют? К какому классу ферментов они относятся?
Слайд 45Задания для самоконтроля
Задание 1. Определите класс ферментов, катализирующих реакции
с общей формулой:
2SH2 + O2 → 2S + 2H2O
SH2 +
O2 → S + H2O2 (с участием FAD)SH2 + NAD+ → S+ NADH + H+
S-H + O2 + NADPH+H+ → S-OH + H2O + NADP+
2H2O2 → 2H2O + O2
S1 + S2-CH3 → S1-CH3 + S2
Слайд 46Задания для самоконтроля (продолжение)
S + H2O → P1 + P2
S
→ P1 + P2
S (-CH=CH-) + H2O → S (-CH2-CH-OH)
S → P (изомер S)
S1 + S2 + ATP → P (S1S2) + ADP + H3PO4
S1 + S2 + ATP → P (S1S2) + AMP + H4P2O7
Слайд 47Задания для самоконтроля
Задание 2. Сравните 2 реакции с участием
АТФ. Назовите роль АТФ в каждом случае и класс ферментов:
S
(OH) + ATP → S (OPO3H2) + ADPS1 + S2 + ATP → P (S1S2) + ADP + H3PO4
Сравните 2 реакции с участием воды и назовите класс ферментов:
S + H2O → P1 + P2
S (-CH=CH-) + H2O → S (-CH2-CH-OH)
Слайд 48Задания для самоконтроля
Задание 3. Объясните разницу между названиями ферментов
и назовите тип катализируемых реакций (класс ферментов):
1) гидролаза, гидроксилаза, гидратаза
2)
киназа, фосфатаза Задание 4. По названию ферментов определите их класс (для оксидоредуктаз и их группу), назовите субстрат ферментов:
Лактатдегидрогеназа, глутатионредуктаза, ксантиноксидаза, глутатионпероксидаза
Глюкокиниза, аланинаминотрансфераза
Глюкозо-6-фосфатаза, ацетилхолинэстераза, ТАГ-липаза
Гистидиндекарбоксилаза, сериндегидратаза, фумаратгидратаза
Фосфоглюкомутаза, фосфоглюкоизомераза
Пируваткарбоксилаза, глутаминсинтетаза
Задание 5. Охарактеризуйте реакции, катализируемые ферментами энзимодиагностики инфаркта миокарда (см. слайд «Актуальность темы»). Назовите субстраты, продукты, класс.
Слайд 49Заключение
В настоящее время число различных известных реакций, катализируемых ферментами, составляет
около 2 тысяч и число их непрерывно возрастает. Для того,
чтобы ориентироваться в этом множестве биохимических превращений Международный союз биохимии и молекулярной биологии создал классификацию и номенклатуру ферментов.В основу классификации ферментов положен тип катализируемой реакции.
В основу номенклатуры – субстрат и тип реакции.
Слайд 50Литература
1. Биохимия: учебник для вузов / Е. С. Северин -
М.: ГЭОТАР-Медиа, 2014. -768 с.
2. Биологическая химия с упражнениями и
задачами: учебник / ред. С. Е. Северин. - М.: ГЭОТАР-Медиа, 2013. - 624 с. (С.73-76; С. 552 обезвреживание ксенобиотиков при участии монооксигеназ микросом печени)3. Биологическая химия: учебник для студентов медицинских вузов / А.Я. Николаев. – М.: Мед. информ. агенство, 2007. – 568 с.