Слайд 2Содержание сегодняшней лекции
Молекулярно-кинетическая теория (МКТ)
Распределение Больцмана и барометрическая формула.
Наиболее
вероятная, арифметическая скорости молекул.
Определение числа Авогадро методом Перрена.
Элементы физической кинетики
Число столкновений и длина свободного пробега молекул идеального газа.
Явления переноса: диффузия, теплопроводность, внутреннее трение.
Броуновское движение.
Эмпирическое уравнение переноса: Фика, Фурье, Ньютона.
Релаксация к состоянию переноса.
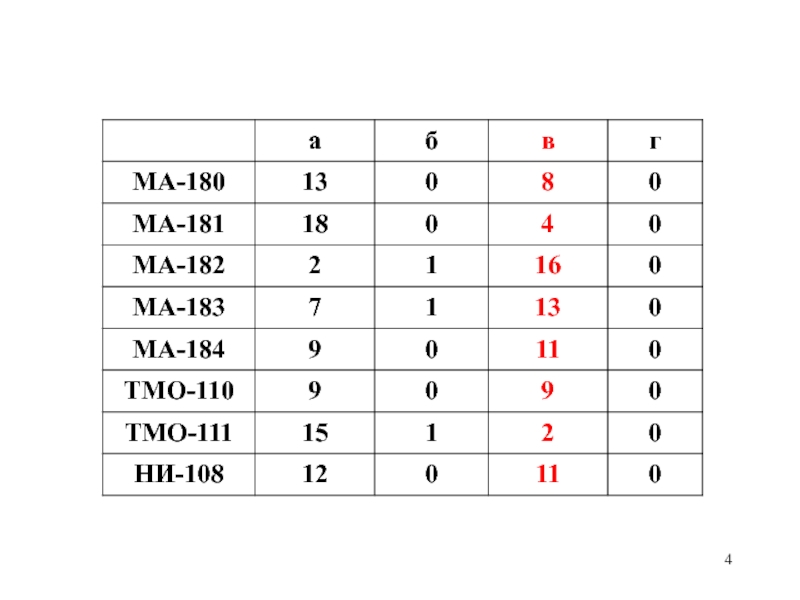
Слайд 3Контрольный вопрос
С повышение высоты в атмосфере Земли концентрация атомов водорода:
а)
возрастает,
б) не меняется,
в) уменьшается,
г) невозможно ответить.
в) уменьшается
Слайд 5Содержание сегодняшней лекции
Феноменологическая термодинамика
Термодинамическое равновесие и температура.
Внутренняя энергия. Закон
равномерного распределения энергии по степеням свободы.
Первое начало термодинамики.
Теплоемкость.
Уравнение Майера. Теплоемкость твердых тел. Закон Дюлонга-Пти.
Адиабатический процесс, политропический процесс и его частные случаи, обратимые и необратимые процессы.
Преобразование теплоты в механическую работу. Цикл Карно и его коэффициент полезного действия.
Слайд 6Температура, давление, объем, плотность и т.д. –
параметры состояния термодинамической
системы.
Неравновесное состояние – хотя бы один из параметров
системы не имеет
определенного значения.
Равновесное состояние – все параметры системы
имеют определенное значение.
Термодинамическое равновесие и температура
Слайд 7Термодинамические параметры
Изолированные (замкнутые) системы – термодинамические системы, не обменивающиеся
с внешней
средой ни энергией, ни веществом.
Слайд 8Термодинамические параметры
Релаксация – самопроизвольный переход изолированной
(предоставленной самой себе) неравновесной
системы
в равновесное состояние.
Время релаксации параметра – время, за которое первоначальное
отклонение этого параметра
от равновесного значения уменьшается в е = 2,72 раз.
Соответствие времени релаксации термодинамической системы наибольшему времени релаксации
какого-либо из параметров системы.
Слайд 9Термодинамический процесс
Термодинамический процесс –
переход системы из одного термодинамического состояния
в другое.
Нарушение равновесия системы –
следствие протекания термодинамического процесса.
Равновесный или
квазистатический процесс – процесс, состоящий из последовательности равновесных состояний.
Обратимость равновесного процесса,
являющегося бесконечно медленным.
Слайд 10Термодинамический процесс
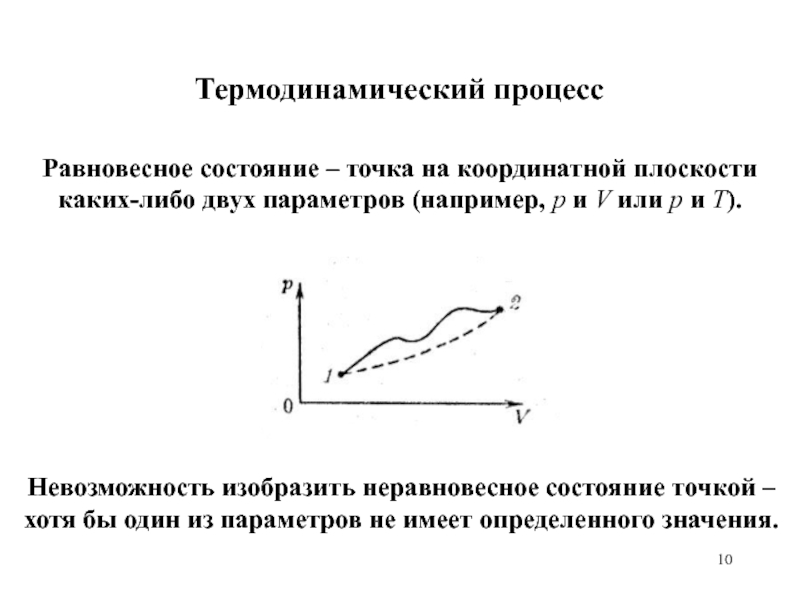
Равновесное состояние – точка на координатной плоскости каких-либо двух
параметров (например, р и V или p и T).
Невозможность
изобразить неравновесное состояние точкой – хотя бы один из параметров не имеет определенного значения.
Слайд 11Термодинамический процесс
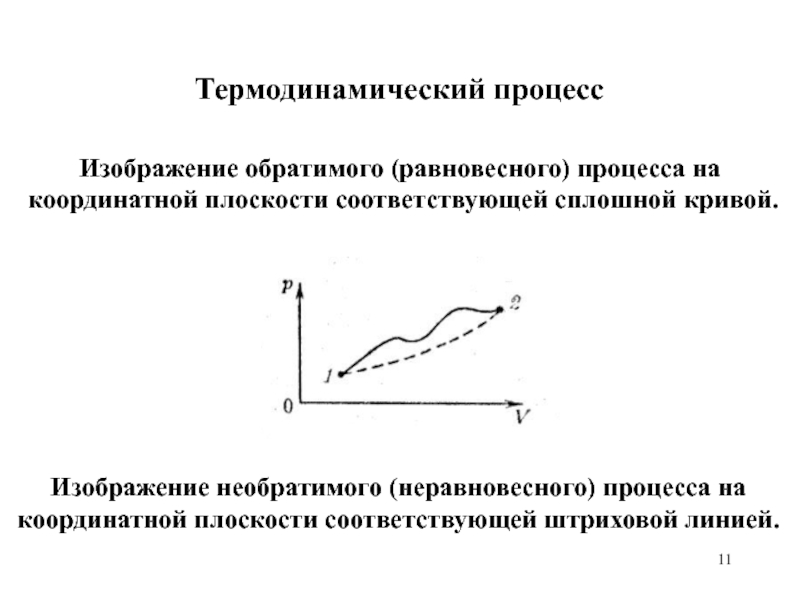
Изображение обратимого (равновесного) процесса на координатной плоскости соответствующей сплошной
кривой.
Изображение необратимого (неравновесного) процесса на координатной плоскости соответствующей штриховой линией.
Слайд 12Термодинамический процесс
Круговой процесс или цикл – процесс, при котором система
после ряда изменений возвращается в исходное состояние.
Замкнутая кривая – графический
образ цикла.
Слайд 13Термодинамический процесс
Важная роль равновесных состояний
и обратимых процессов –
все количественные
выводы термодинамики
применимы только к ним.
Слайд 14Температура
Температура – параметр, позволяющий определить находится ли тело в тепловом
равновесии с другими телами.
Одинаковая температура тел,
находящихся в тепловом равновесии
(не обменивающихся
теплом в результате теплопередачи или электромагнитного излучения).
Переход тел, находящихся в тепловом контакте, в состояние теплового равновесия (с одинаковыми температурами).
Слайд 15Температура
Шкала температур Цельсия:
тающий лед - 0 С,
кипящая вода 100 С.
V,
V0, V100 – объем тела (спирт, ртуть)
при температурах t,
0 С и 100 С соответственно.
Слайд 16Температура
Термодинамическая шкала температур –
независимость от свойств термометрического тела.
Термодинамическая температура
T = t + 273,15.
Соответствие 0 К по термодинамической шкале
- 273,15 С.
Кельвин – единица термодинамической температуры.
Взаимосвязь между термодинамической температурой и средней кинетической энергией,
приходящейся на одну молекулу газа.
Слайд 17Внутренняя энергия
Компоненты внутренней энергии какого-либо тела:
потенциальная энергия взаимодействия между атомами
в молекулах,
кинетическая энергия поступательного движения молекул,
кинетическая энергия вращательного движения молекул,
кинетическая
энергия колебательного движения атомов в молекулах,
потенциальная энергия колебательного движения атомов в молекулах,
внутримолекулярная энергия (энергия электронных облаков атомов и внутри ядерная энергия).
Слайд 18Внутренняя энергия
Во внутреннюю энергию тела не входят:
кинетическая энергия тела как
целого,
потенциальная энергия тела во внешнем силовом поле.
Слайд 19Внутренняя энергия
Возможность определять внутреннюю энергию с точностью
до произвольной аддитивной постоянной
для упрощения выражений.
Вхождение в термодинамические формулы изменения внутренней энергии или
ее производной по какому-либо параметру.
Постоянство внутримолекулярной энергии в большинстве случаев – приравнивание нулю (отбрасывание).
Слайд 20Внутренняя энергия
Возможность пренебречь небольшой энергией взаимодействия между телами – энергией
взаимодействия в тонком слое на границе между телами.
Равенство внутренней энергии
системы тел
сумме внутренних энергий каждого из тел в отдельности
и энергии взаимодействия между телами.
Аддитивность внутренней энергии.
Слайд 21Внутренняя энергия
Независимость значения энергии системы в данном состоянии
от предыстории.
Внутренняя энергия
– функция состояния системы.
Независимость приращения внутренней энергии системы от пути,
по которому происходил ее переход
(от характера процесса, приведшего к переходу)
из одного состояния в другое.
Равенство приращения внутренней энергии системы
при ее переходе из одного состояния в другое
разности значений внутренней энергии
конечного и начального состояний системы.
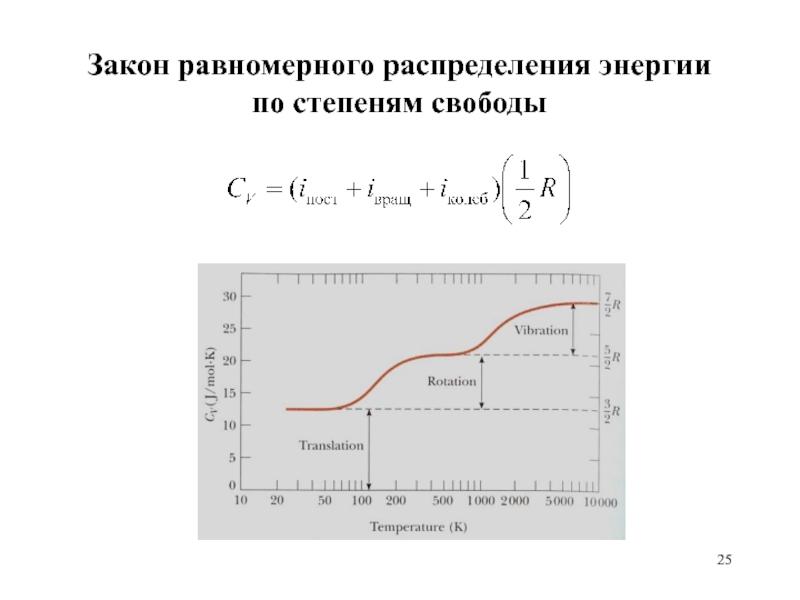
Слайд 22Закон равномерного распределения энергии
по степеням свободы
Внутренняя энергия газа – вклад
поступательного, вращательного и колебательного движений молекул.
Статистическая механика – равномерное распределение
энергии между всевозможными независимыми степенями свободы
в системах, состоящих из большого числа молекул, подчиняющихся 2-му закону Ньютона.
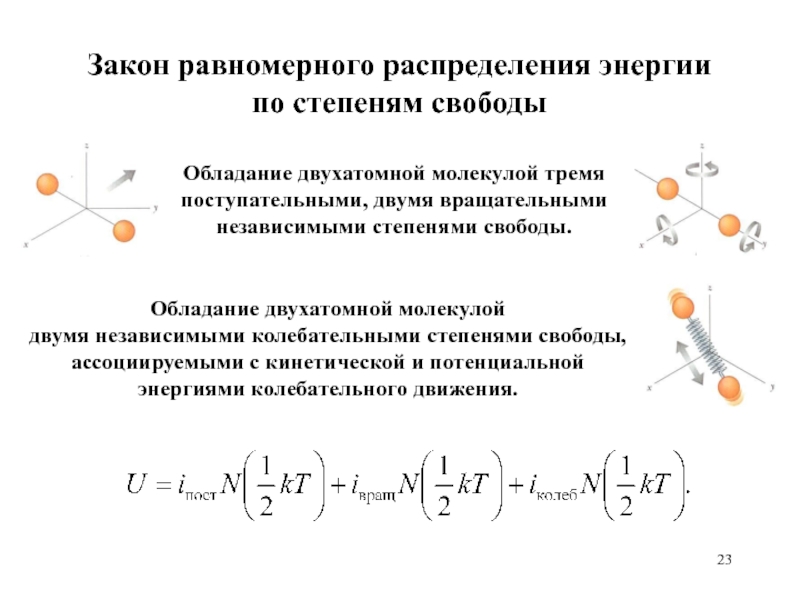
Возможность обладания молекулами в газе независимыми поступательными, вращательными и колебательными степенями свободы.
Соответствие каждой степени свободы молекулы в равновесии энергии, равной ½ kT.
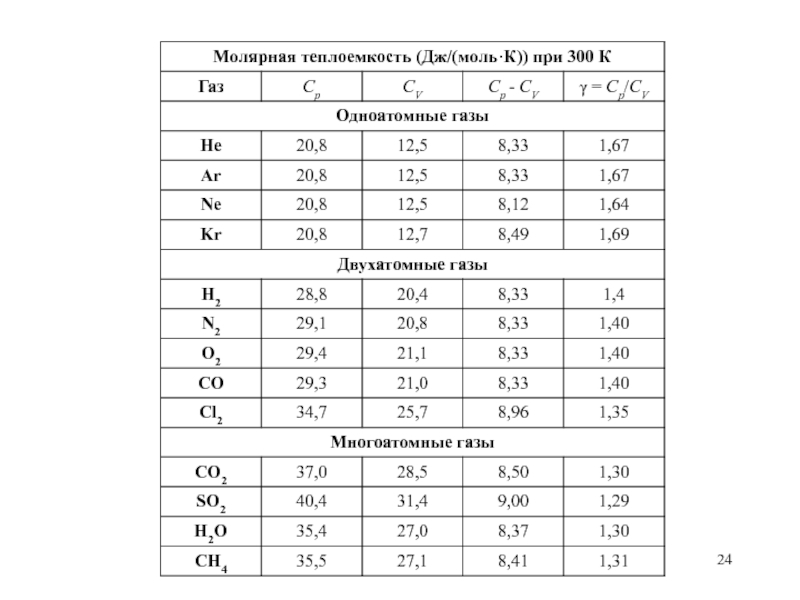
Слайд 23Закон равномерного распределения энергии
по степеням свободы
Слайд 25Закон равномерного распределения энергии
по степеням свободы
Слайд 26Первое начало термодинамики
Возможность изменения внутренней энергии тела за счет
совершения над
телом работы А и передачи ему теплоты Q.
Равенство работы А,
совершаемой над телом внешними телами, взятой со знаком минус работе А, совершаемой телом над внешними телами,
А = - А.
Равенство количества теплоты Q, переданной данному телу внешней средой,
взятому со знаком минус количеству теплоты Q,
переданному данным телом внешней среде,
Q = - Q.
Слайд 27Первое начало термодинамики
совершение отдельными молекулами более нагретого тела
положительной работы над отдельными молекулами менее
нагретого тела,
Равенство нулю макроскопической работы
при совершении теплообмена.
Физическая природа теплопередачи –
2) обмен энергией между отдельными молекулами через излучение.
Слайд 28Первое начало термодинамики
Следствие закона сохранения энергии:
увеличение внутренней энергии одного тела
сопровождается
таким же уменьшением внутренней энергии другого тела.
Первое начало термодинамики
Q
= U2 – U1 + A,
U1 и U2 – начальное и конечное значения внутренней энергии тела (или системы тел),
A – работа, совершенная телом (или системой тел),
Q – количество теплоты, сообщенной телу (системе тел) .
Количество теплоты, сообщенной системе,
идет на приращение внутренней энергии системы и
на совершение системой работы над внешними телами.
Слайд 29Первое начало термодинамики
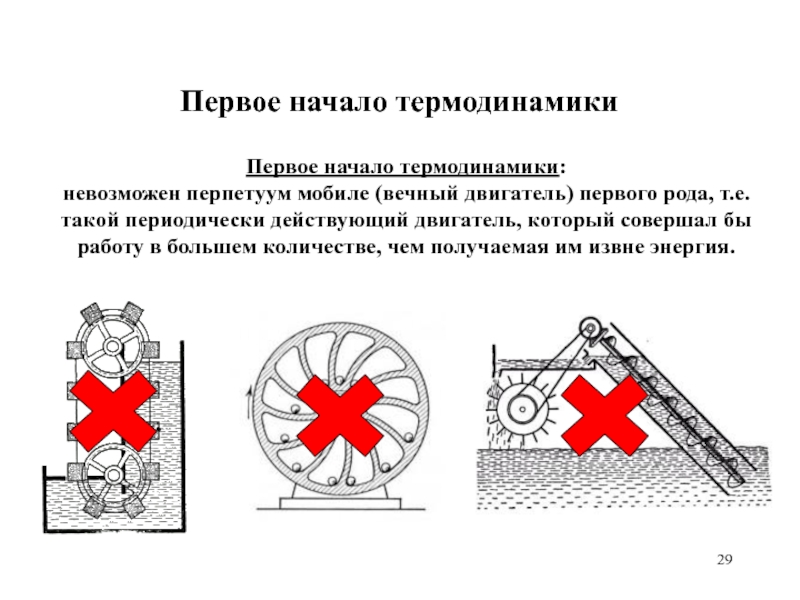
Первое начало термодинамики:
невозможен перпетуум мобиле (вечный двигатель) первого
рода, т.е. такой периодически действующий двигатель, который совершал бы работу
в большем количестве, чем получаемая им извне энергия.
Слайд 30Первое начало термодинамики
Необходимость разбиения рассматриваемого термодинамического процесса на ряд элементарных
процессов, соответствующих очень малому изменению параметров системы,
Q = U +
A,
Q – элементарное количество теплоты,
A – элементарная работа,
U – приращение внутренней энергии в ходе
данного элементарного процесса.
Слайд 31Первое начало термодинамики
Внутренняя энергия U – функция состояния системы.
Следствия:
независимость
приращения внутренней энергии U от пути перехода системы из одного
состояния в другое,
возможность рассматривать запас энергии, которым обладает система в различных состояниях.
Слайд 32Первое начало термодинамики
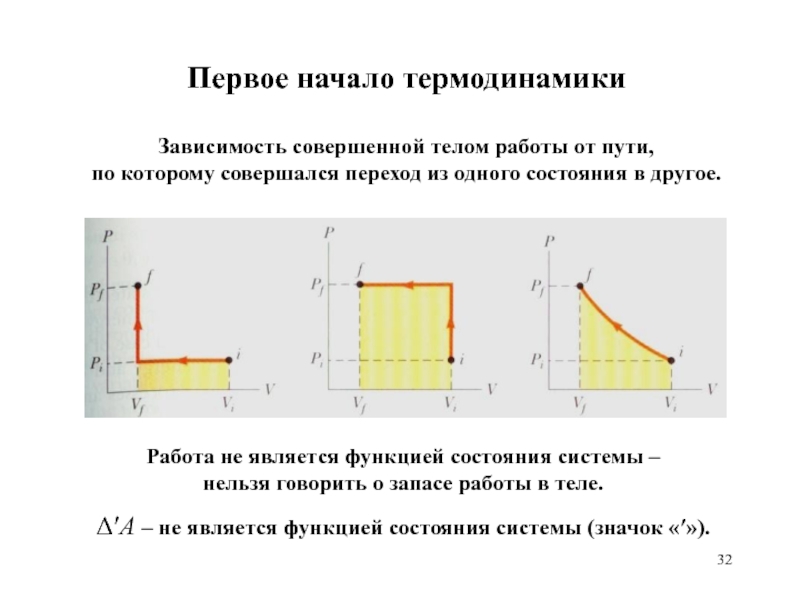
Работа не является функцией состояния системы –
нельзя
говорить о запасе работы в теле.
Зависимость совершенной телом работы от
пути,
по которому совершался переход из одного состояния в другое.
A – не является функцией состояния системы (значок «»).
Слайд 33Первое начало термодинамики
Q – не является функцией состояния системы (значок
«»).
Зависимость величины полученной телом теплоты от пути,
по которому совершался
переход из одного состояния в другое.
Количество теплоты не является функцией состояния системы –
нельзя говорить о запасе теплоты в теле.
Слайд 34Теплоемкость
Теплоемкость какого-либо тела – величина, равная количеству теплоты, которое нужно
сообщить телу, чтобы повысить его температуру на один кельвин.
Слайд 35Теплоемкость
Удельная теплоемкость тела с – теплоемкость единицы массы вещества.
Молярная теплоемкость
тела С – теплоемкость 1 моля вещества.
Слайд 36Теплоемкость
СV – молярная теплоемкость при постоянном объеме.
Нагрев тела при V
= const – работа тела над внешними телами = 0.
Слайд 37Теплоемкость
СV = const в широких температурных интервалах
для газов, близких
к идеальным.
Слайд 38Теплоемкость
Сp – молярная теплоемкость при постоянном давлении.
1 начало термодинамики для
1 моля газа при постоянном давлении
Слайд 39Теплоемкость
Равенство работы, совершаемой молем идеального газа при повышении его температуры
на 1 К при постоянном давлении, величине R.
Уравнение Майера Сp
= СV + R
(справедливо только для идеального газа).
Слайд 40Теплоемкость
- характерная для каждого газа величина,
определяемая числом и характером степеней
свободы молекул.
Слайд 41Теплоемкость
Внутренняя энергия идеального газа
пропорциональна произведению давления на объем.
Внутренняя энергия
1 моля идеального газа
Внутренняя энергия
произвольной массы идеального газа
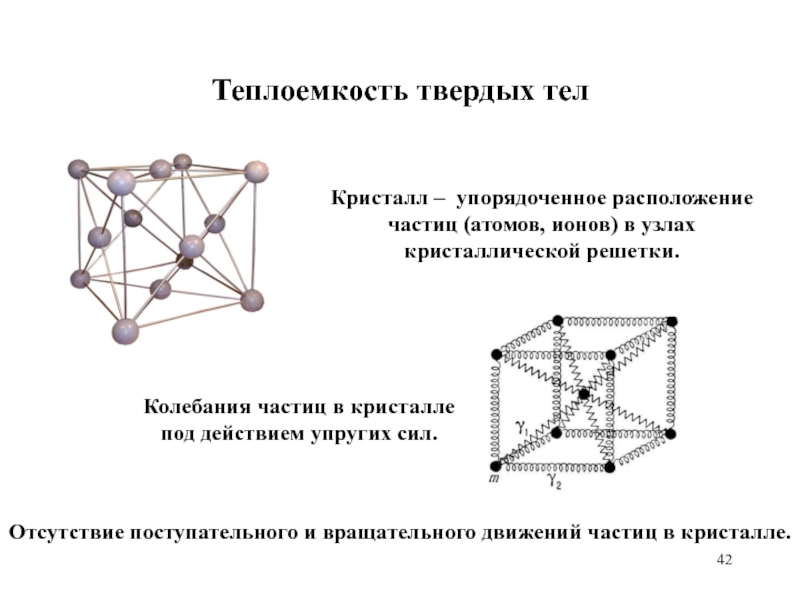
Слайд 42Теплоемкость твердых тел
Кристалл – упорядоченное расположение частиц (атомов, ионов) в
узлах кристаллической решетки.
Колебания частиц в кристалле
под действием упругих сил.
Отсутствие
поступательного и вращательного движений частиц в кристалле.
Слайд 43Теплоемкость твердых тел
Возможность представления колебания вдоль произвольного направления как наложения
колебаний в трех взаимно перпендикулярных направлениях.
Соответствие каждой колебательной степени свободы
энергии, равной kT (1/2 kT – кинетическая энергия, 1/2 kT – потенциальная энергия).
Соответствие каждой частице в кристалле трех степеней свободы.
Обладание каждой частицей энергией 3kT.
Слайд 44Теплоемкость твердых тел
Закон Дюлонга и Пти –
теплоемкость 1 моля
химически простых веществ одинакова и равна 3R.
Выполнение закона Дюлонга и
Пти
(эмпирического закона классической физики)
для большинства простых веществ при комнатной температуре.
Слайд 45Адиабатический процесс
Адиабатический процесс – процесс, при котором отсутствует теплообмен между
системой и окружающей средой.
Примеры:
очень быстрое расширение сжатого газа,
очень медленное расширение
газа, теплоизолированного от окружающей среды.
Слайд 46Первое начало термодинамики
Адиабатический процесс
Слайд 47Адиабатический процесс
Дифференцирование
Умножение на R/CV
Cложение
Слайд 48Адиабатический процесс
Уравнение адиабаты
или Пуассона
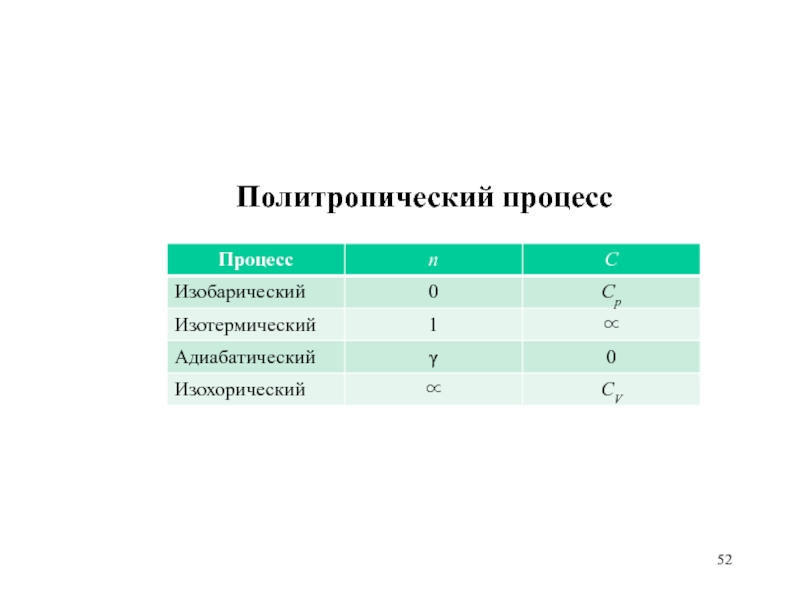
Слайд 50Политропический процесс
Политропические процессы –
процессы, в ходе которых теплоемкость тела
остается постоянной
С = const.
Первое начало термодинамики
Слайд 53Преобразование теплоты в механическую работу
Одна из формулировок первого начала термодинамики:
Невозможен
перпетуум мобиле (вечный двигатель) первого рода, т.е. такой периодически действующий
двигатель, который совершал бы работу в большем количестве, чем получаемая им извне энергия.
Тепловая машина (периодически действующий двигатель) –
система, совершающая некий круговой процесс (цикл).
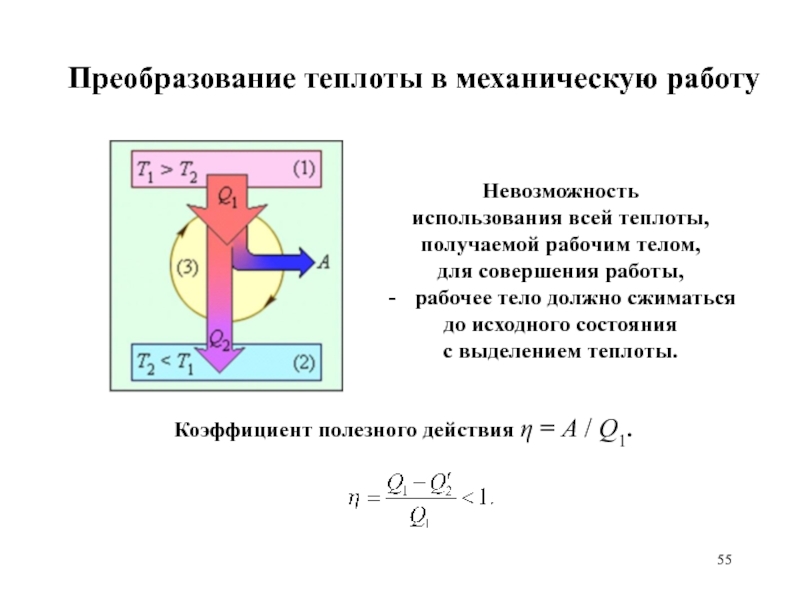
Слайд 54Преобразование теплоты в механическую работу
Циклический процесс:
необходимость сообщения рабочему телу
в ходе расширения некоторого количества теплоты Q1 и отнятия некоторого
количества теплоты Q'2 при сжатии.
Работа, совершаемая за цикл,
А = Q1 - Q'2.
Равенство работы, совершаемой за цикл, площади,
заключенной внутри кривой цикла.
Равенство внутренних энергий исходного и конечного состояний – равенство нулю изменения внутренней энергии рабочего тела.
Слайд 55Преобразование теплоты в механическую работу
Коэффициент полезного действия = А
/ Q1.
Невозможность
использования всей теплоты,
получаемой рабочим телом,
для совершения работы,
рабочее
тело должно сжиматься
до исходного состояния
с выделением теплоты.
Слайд 56Преобразование теплоты в механическую работу
Слайд 57Цикл Карно и его коэффициент полезного действия
Сади Карно,
французский инженер
(1796-1832)
Теоретические
рассуждения:
тепловая машина, работающая по идеальному, обратимому циклу (циклу Карно), наиболее
эффективна (обладает максимальным кпд).
Цикл Карно – последовательность процессов
как сопровождающихся, так и не сопровождающихся теплообменом рабочего тела с нагревателем и холодильником.
Слайд 58Цикл Карно и его коэффициент полезного действия
Предположения:
бесконечно высокая теплоемкость
нагревателя с
температурой Т1 и холодильника с температурой Т2 –
их температура при
теплообмене с рабочим телом не меняется.
Изотермический процесс – единственный обратимый процесс,
сопровождающийся теплообменом с резервуаром,
температура которого при этом остается неизменной.
Адиабатический процесс – теплообмен отсутствует.
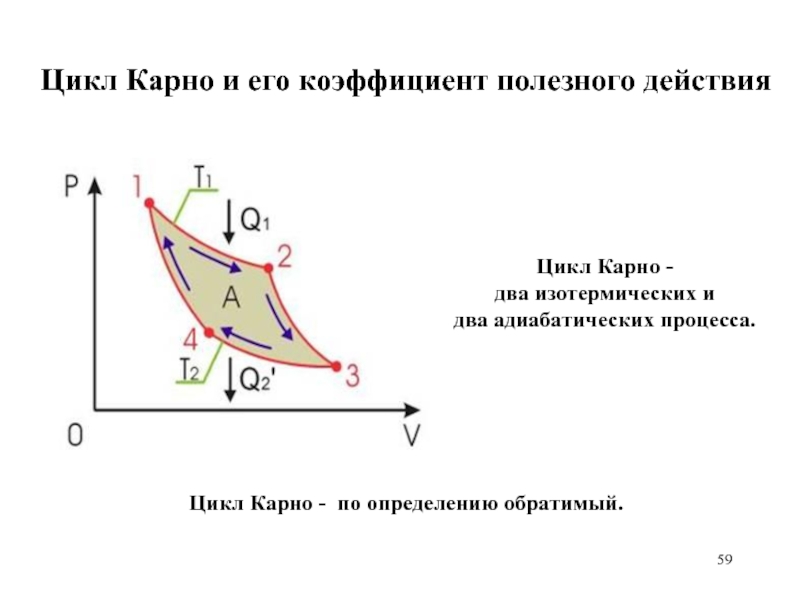
Слайд 59Цикл Карно и его коэффициент полезного действия
Цикл Карно -
два
изотермических и
два адиабатических процесса.
Цикл Карно - по определению обратимый.
Слайд 60Цикл Карно и его коэффициент полезного действия
Изотермические процессы (1-2, 3-4):
внутренняя
энергия идеального газа постоянна.
1-2:
3-4:
Адиабатические процессы (2-3, 4-1):
÷
Слайд 61Цикл Карно и его коэффициент полезного действия
Эффективность цикла Карно была
бы равна 100%,
если бы температура холодильника была равна 0
К.