Слайд 1Лекция 4
Соединения азота в атмосфере
Слайд 2Схема трансформации соединений азота в тропосфере
Слайд 3Среднее содержание газообразного аммиака в приземном слое воздуха составляет 0,3-9,1
мгк*м-3 и резко падает с подъемом вверх.
Нa высоте около
2 км содержание аммиака в воздухе снижается более чем в три раза и далее в тропосфере практически не меняется.
Вертикальный профиль концентраций аммиака и увеличение его концентрации в приземном слое с ростом температуры (летнее время) свидетельствует о биологическом происхождении основного количества NH3.
Слайд 4В тропосфере аммиачный азот представлен, в основном, содержащимися в аэрозолях
ионами аммония. Общее содержание NH4+ ионов, в пересчете на элементный
азот, составляет порядка 2 млн. т., что примерно в два раза превышает общее содержание газообразного аммиака.
С атмосферными осадками и в результате процессов сухого осаждения ежегодно около 70 млн. т соединений аммония выводится из атмосферы.
Слайд 5Часть аммиака (от 3 до 8 млн. т*год-1) вступает во
взаимодействие со свободными радикалами, в основном с гидроксидным радикалом:
NH3 + OH = NH2 + H2O
В дальнейшем NH2 легко окисляется до оксида азота.
Слайд 6Под общей формулой оксидов азота NOx обычно подразумевают NO, NO2
и N2O.
Среднее значение концентрации гемиоксида азота (N2O) в тропосфере незначительно
меняется с высотой над уровнем моря и географической широтой местности и составляет в среднем, по данным различных авторов, 0,26 - 0,33 млн-1.
Слайд 7Окисление азота воздуха в процессах горения
Пример
Константа равновесия реакции образования
оксида азота из азота и кислорода при 800 К равна
3 *10-11. Какого равновесного значения может достигнуть концентрация оксида азота в смеси, если исходная смесь –воздух?
Слайд 8Решение.
Процесс образования молекул оксида азота из азота и кислорода воздуха
может быть представлен следующим уравнением:
N2 + O2 = 2 NO
Поскольку
в процессе образования оксида азота не происходит изменения количества молей газов в смеси, константы равновесия Кр и Кс равны, и нет необходимости в дополнительных пояснениях в условиях задачи. Константу равновесия можно представить уравнением:
Кр = Р(NO)2 / Р(N2) * Р(O2)
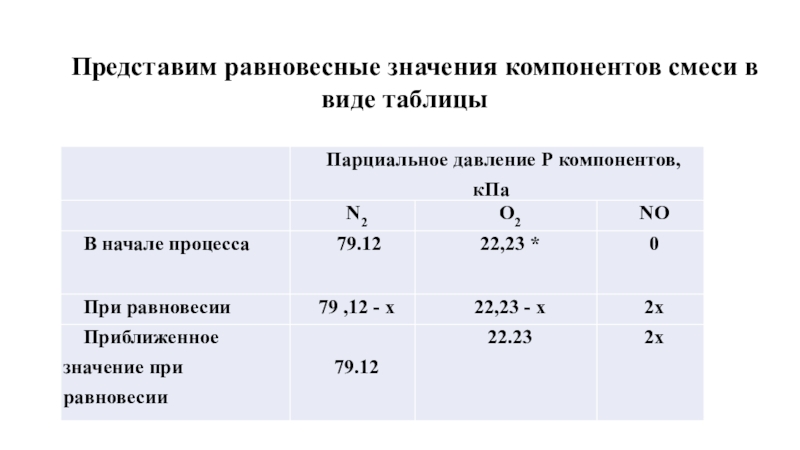
Слайд 9Представим равновесные значения компонентов смеси в виде таблицы
Слайд 10Парциальные давления азота и кислорода соответствуют значениям, характерным для сухого
воздуха при нормальном атмосферном давлении:
Рi = 101,3 *αi ,
где αi
объемная доля i компонента в смеси/
Поскольку константа равновесия процесса образования оксида азота мала, можно предположить, что равновесные значения парциального давления NO будут низкими, поэтому парциальные давления азота и кислорода практически не изменятся. В связи с этим, при расчете можно воспользоваться приближенными равновесными значениями парциальных давлений компонентов смеси.
Слайд 113 * 10-11 = 4х2 / 79.12 * 22,23
х =
Р(NO) = 22,97 * 10 -5 кПа = 0,23 Па.
Ответ: в воздухе при температуре 800К равновесное парциальное давление оксида азота составит 0,23 Па
Слайд 12Оксид и диоксид азота в тропосфере подвергаются взаимным превращениям
Как известно,
NO в присутствии кислорода может окисляться до NO2,
но в тропосфере
в связи с низкой концентрацией NO скорость этого процесса очень низкая
Слайд 13В тропосфере NO, взаимодействуя с гидропероксидным радикалом, переходит в диоксид
азота:
NO+HO2 = NO2 +
OH
Другой возможный путь окисления оксида азота связан со взаимодействием с озоном:
NO + О3 = NO2 + O2
Слайд 14ПРИМЕР
Известно, что окисление оксида азота (NO) может протекать при взаимодействии
с молекулярным кислородом и озоном. Оценим время полувыведения оксида азота
из приземного слоя атмосферного воздуха и определим, какой из этих процессов вносит основной вклад в окисление NO.
Примем, что содержание молекул оксида азота в воздухе в среднем составляет - 2 * 109 см-3, а концентрация озона равна 15 млрд-1. Константы скоростей реакций окисления оксида азота кислородом и озоном равны, соответственно:
Кк = 1,93 * 10-38 см6/( молекула с) ` и
Ко = 1,8 * 10-14 см3/( молекула с)`. Температура воздуха 288К, давление 101,3 кПа.
Слайд 15Решение.
Определим время полувыведения оксида азота из воздуха при его
взаимодействии с молекулярным кислородом.
Процесс окисления в рассматриваемом случае описывается уравнением:
2
NO + O2 = 2 NO2
Скорость процесса окисления NO можно определить по уравнению:
VNO = Кк [O2] [NO]2 где
VNO - скорость процесса окисления NO (см-3/с);
Кк - константа скорости реакции третьего порядка
[O2] и [NO] - концентрации кислорода и оксида азота в воздухе (см-3).
Слайд 16Концентрация молекул кислорода в приземном слое воздуха равна 20,95 об.
%, что составляет:
[O2] = 2,55 * 1019 * 20,95
/ 100 = 5,34 * 1018 см-3.
Поскольку количество молекул кислорода в воздухе значительно превосходит количество молекул оксида азота, можно считать, что концентрация О2 в процессе окисления NO практически не изменяется. Поэтому скорость реакции окисления оксида азота можно представить в виде уравнения псевдо-второго порядка:
VNO = Кк* [NO]2 ,
где Кк* - константа скорости реакции псевдо-второго порядка (см3 /. с);
Кк* = Кк [O2] = 1,93 * 10-38 * 5,34 * 1018 = 10,31 * 10-20 (см3/ с).
Слайд 17Для реакций второго порядка время, или период, полувыведения, то есть
время, за которое концентрация исходных реагентов снизится вдвое, при условии
равенства исходных концентраций реагентов определяется по уравнению:
t1/2 = 1 / К * С, где
К - константа скорости реакции второго порядка (см3/ с);
С - концентрация исходного реагента (см-3).
В рассматриваемом нами случае, для реакции псевдо-второго порядка имеем:
t1/2 = 1 / Кк* [NO]
t1/2 = 1/ 10,31 * 10-20 * 2 * 109 = 4,85 * 107 с = 1,5 года.
Слайд 18 Определим время полувыведения оксида азота из приземного слоя воздуха
при его взаимодействии с озоном.
В этом случае, уравнение реакции окисления
NO имеет следующий вид:
NO + О3 = NO2 + О2
Скорость реакции можно рассчитать по уравнению:
VNO* = Ко [NO] [O3],
где: VNO* - скорость процесса окисления оксида азота озоном (см-3/с);
Ко - константа скорости реакции второго порядка (см3/ с);
[NO] и [O3] концентрации в воздухе (см-3).
Слайд 19Поскольку концентрация озона более чем в сто раз больше концентрации
оксида азота, можно принять, что в процессе окисления NO значение
концентрации озона практически не изменяется. В этом случае скорость реакции можно представить в виде уравнения псевдо-первого порядка:
V*NO = Ко** [NO],
где Ко** - константа скорости псевдо-первого порядка;
Ко** = Ко. [O3] = 1,8 * 10-14 * 3,82 * 1011 = 6,88 * 10-3 с-1.
Для реакций первого порядка время полувыведения реагента определяется по уравнению:
t1/2 = 0,693 / K,
где K - константа скорости реакции первого порядка.
Слайд 20В рассматриваемом нами случае для реакции псевдо-первого порядка имеем:
t1/2 =
0,693 / К = 0,693 / 6,88 * 10-3 =
100,7 с = 1,7 мин.
Ответ: времена полувыведения оксида азота при его взаимодействии с кислородом и озоном равны, соответственно 1,5 года и 1,7 минуты. В приземном воздухе процесс окисления NO , в основном, протекает при участии озона.
Слайд 21Диоксид азота в тропосфере в присутствии излучения длиной волны
398 нм разлагается с образованием оксида азота и атома
кислорода:
NO2 + h = NO + O(3P), 398 нм
Образующийся оксид азота вновь подвергается процессу окисления, а атомарный кислород приводит к появлению в тропосфере озона.
Слайд 22Важной частью атмосферного цикла соединений азота является образование азотной кислоты.
Примерно 44% азотной кислоты в тропосфере образуется в результате взаимодействия
диоксида азота с гидроксидным радикалом:
NO2 + OH = HNO3
Часть азотной кислоты разлагается с образованием диоксида азота, и вновь включаются в атмосферный цикл его соединений.
HNO3 = OH + NO2
Слайд 23Основное количество азотной кислоты выводится из тропосферы с атмосферными осадками
в виде растворов HNO3 и её солей.
Доля азотной кислоты
в кислотности атмосферных осадков составляет 15% и постепенно возрастает.
Среди нитратов, присутствующих в атмосфере, основное количество составляет азотнокислый аммоний NН4NO3, который, как и в случае сульфата аммония, образуется при взаимодействии аэрозолей соответствующих кислот с NH3 и его аэрозолями.
Слайд 24Оценка масштабов антропогенных поступлений соединений серы и азота в атмосферу
Пример
Оцените
мольное отношение и общую массу диоксида серы и оксидов азота,
поступающих в атмосферу в течение суток с выбросами тепловой электростанции, работающей на угле. Содержание серы в угле равно 1,5%. В сутки на станции сжигается 10 тыс. т угля. Концентрация оксидов азота в газовых выбросах составляет 150 млн-1. Для сжигания угля используется стехиометрически необходимое количество воздуха. При оценке принять, что уголь состоит из углерода и содержит в качестве примеси только серу.
Слайд 25Решение
Появление диоксида серы в выбросах отходящих газов при сжигании топлива
связано с процессом окисления соединений серы, присутствующих в исходном топливе.
В рассматриваемом случае процесс можно представить уравнением:
S + O2 = SO2
Количество серы, сжигаемое на станции за сутки, составит:
m (S) = M(угля) *(S),
где: m (S) и M(угля) - масса серы и угля сжигаемого на станции в сутки; (S) - массовая доля серы в угле.
m (S) = 10000 * 0,015 = 150 (т/сутки)
Слайд 26Количество молей диоксида серы, образующегося в процессе горения угля, равное
количеству молей серы, содержащейся в угле, составит:
N(SO2) = N(S)
= m (S) / М.М.(S)
где М.М.(S) - масса моля серы.
N(SO2) = 150 * 106 / 32 = 4,69 * 106 (молей/сутки)
Слайд 27Для вычисления количества молей оксида азота, образующегося в процессе горения
угля, необходимо найти общее количество молей газов, содержащееся в отходящих
продуктах (Nоб.). Эта величина будет определяться количеством молей азота, содержащегося в воздухе, необходимом для окисления углерода и серы из угля (NN2), количеством молей диоксида углерода, образующегося при горении углерода (NСО2), и количеством молей образующегося диоксида серы (N SO2):
Nоб. = NN2+ NСО2 + N SO2 ,
Слайд 28Процесс окисления углерода можно представить уравнением:
С + О2 = СО2
Каждые сутки на станции сжигается 10000 т угля, которые,
по условию задачи, содержат 150 т серы и 9850 т углерода. Количество молей углерода, сжигаемого на станции в сутки, составит:
N(С) = m (С) / М.М.(С)
где М.В.(С) – масса моля углерода.
N(С) = 9850 * 106 / 12 = 8,21 * 108 молей/сутки
Слайд 29На каждый моль углерода образуется моль диоксида углерода и расходуется,
как и при окислении серы, один моль кислорода из воздуха.
Поэтому количество молей диоксида углерода, образовавшегося в процессе горения угля, составит:
NСО2 = N(С) = 8,21 * 108 молей/сутки
Общее количество молей кислорода, необходимое для окисления серы и углерода, содержащихся в угле, составит:
N(О2) = N(О2 на окисление серы) + N(О2 на окисление углерода)
N(О2) = 4,69 * 106 + 8,21 * 108 = 8,26 * 108 молей/сутки
Слайд 30Поскольку в процессе сжигания угля используется воздух, кислород из которого,
по условию задачи, будет полностью израсходован на окисление серы и
углерода, в отходящих газах останется лишь азот, если не принимать во внимание другие инертные газы и процесс окисления самого азота. Содержание азота можно определить, зная средний состав воздуха:
NN2 = N(О2) * (N2)/ (О2),
где (N2) и (О2) - содержание азота и кислорода в воздухе, соответственно.
NN2= 8,26 * 108 * 78,11 / 20,95 = 3,08 * 108 молей/сутки
Слайд 31Общее количество молей газов, содержащихся в отходящих продуктах сжигания угля,
составит:
N (общее) = 3,08 * 108 + 8,21 * 108
+ 4,69 * 106 = 11,34 * 108 молей/сутки
Количество молей оксида азота в отходящих газах составит: N(NО) = С(NО) * N (общее),
где С(NО) - объемная доля оксида азота в отходящих газах, по условию задачи равна 150 * 10-6.
N(NО) = 150 * 10-6 * 11,34 * 108 = 1,70 * 105 молей/сутки
Слайд 32Массы диоксида серы и оксида азота, поступающего в атмосферу в
процессе сжигания угля, можно определить по уравнению:
М = N *
М.М.,
где: М - масса газа (г); N - содержание в отходящих газах (моль/сутки); М.М. – масса моля соответствующего газа.
М(SO2) = 4,69 * 106 * 64 = 300 * 106 г/сутки = 300 т/сутки
М (NО) = 1,70 * 105 * 30 = 51* 105 г/сутки = 5,1т/сутки
Слайд 33Ответ: с отходящими газами тепловой станции в сутки в атмосферу
поступает 300 т диоксида серы и 5,1 т оксида азота,
мольное соотношение диоксида серы и оксида азота примерно равно 28














![Лекция 4 Концентрация молекул кислорода в приземном слое воздуха равна 20,95 об. %, Концентрация молекул кислорода в приземном слое воздуха равна 20,95 об. %, что составляет: [O2] = 2,55 *](/img/tmb/7/617208/8dcbec8bccb72cdeaa196e1493d01a1c-800x.jpg)
































![АВТОМАТИЗАЦИЯ ЗВУКА [Л'] В ЧИСТОГОВОРКАХ](/img/thumbs/30e40b3b356c62aa0d8bf0aef29fea6a-800x.jpg)
