Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Лекция 4 Химическая связь. Типы и характеристики химической связи. Метод
Содержание
- 1. Лекция 4 Химическая связь. Типы и характеристики химической связи. Метод
- 2. СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ
- 3. СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТHI H· ·I;
- 4. СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТТермин «химическое строение» введено А.М.
- 5. СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТХимическая связь – это совокупность
- 6. СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТИонная химическая связь – это
- 7. СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТФизические свойства веществ с ионной
- 8. СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТКовалентная связь - это связь
- 9. СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ
- 10. СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТЧисло общих электронных пар равно
- 11. СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТПараметры ковалентной связи:1. Направленность –
- 12. СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ2. Энергия связи – это
- 13. СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ3. Длина связи – это
- 14. СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ4. Полярность связи – неравномерное
- 15. СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ
- 16. СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТВещества с ковалентной связью при
- 17. СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ При
- 18. СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТМолекулярную кристаллическую решётку имеют также
- 19. СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТМеталлическая связьВ узлах кристаллической решетки
- 20. СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТВодородная химическая связь – это
- 21. СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТРазличают:Межмолекулярные водородные связи, которые значительно
- 22. СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТРезких границ между разными видами
- 23. Метод валентных связей (МВС) или теория локализованных
- 24. Основные положения теории гибридизации:1. Введение гибридных орбиталей
- 25. Рис. 2 Несвязывающие электронные пары и углы
- 26. СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ
- 27. Распределение электронов в пространстве
- 28. СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТМетод молекулярных орбиталей как линейная комбинация атомных орбиталей
- 29. Основные положения МО ЛКАОМолекулярные орбитали (МО) образуются
- 30. 5. Заполнение молекулярных орбиталей осуществляется парой электронов
- 31. СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТНапример: определить существование молекул и
- 32. СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТНапример: определить существование молекул и
- 33. СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ
- 34. СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ
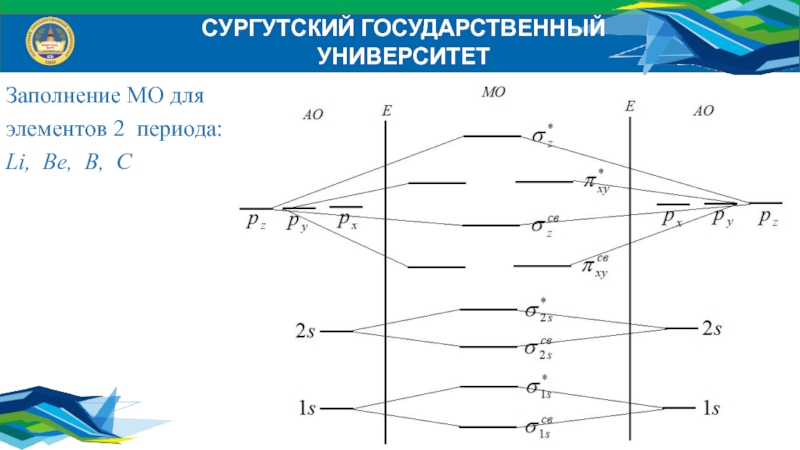
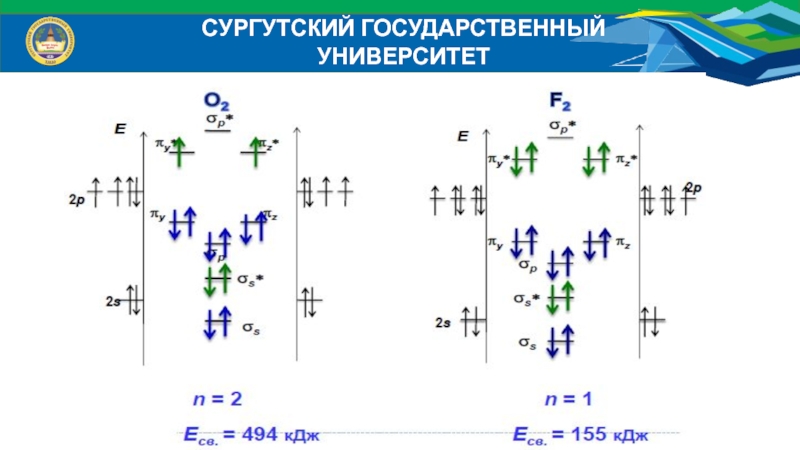
- 35. Заполнение МО для элементов 2 периода:Li, Be, B, CСУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ
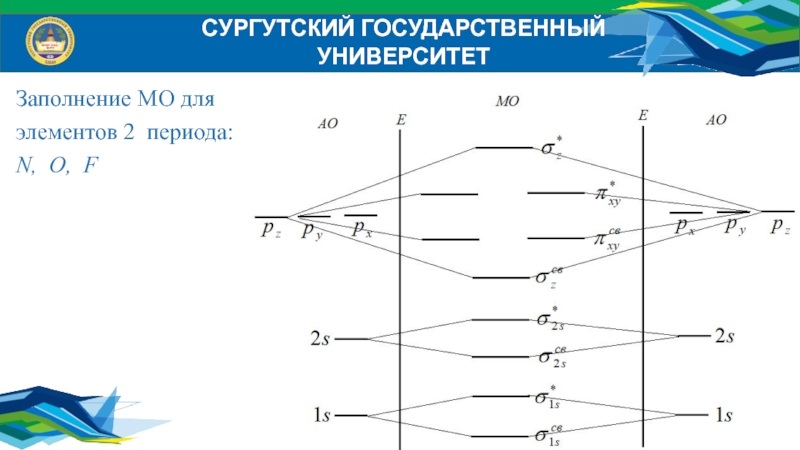
- 36. СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТЗаполнение МО для элементов 2 периода:N, O, F
- 37. СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ
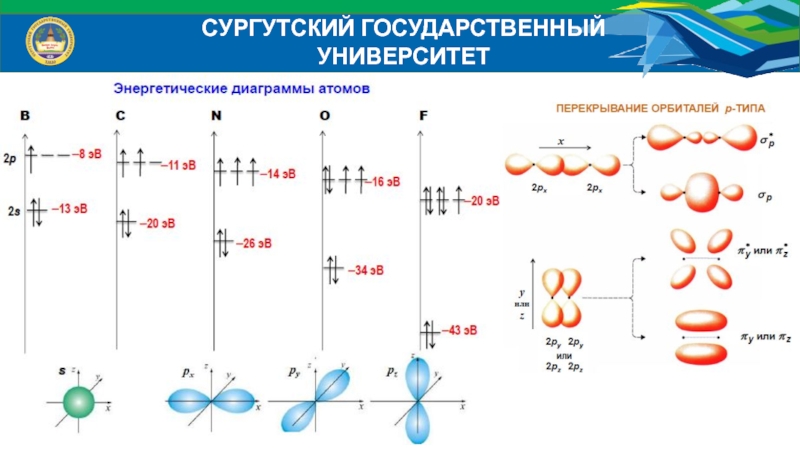
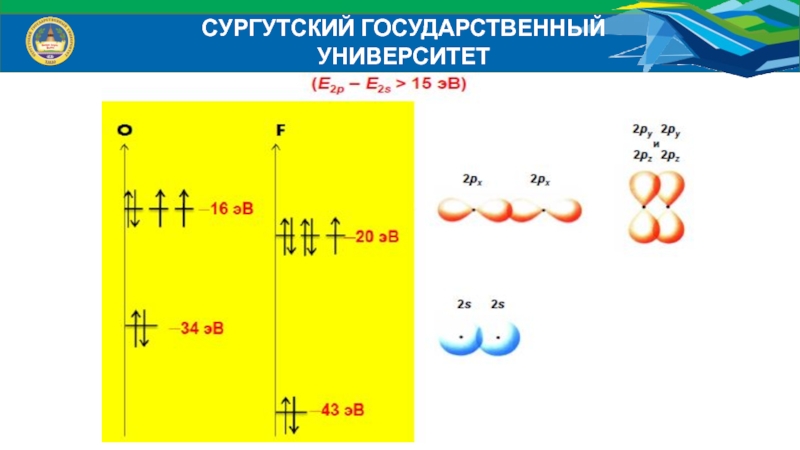
- 38. СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТЭнергетические диаграммы атомов:
- 39. СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТЭнергетические диаграммы МО гетероядерных молекулИсходные
- 40. СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ
- 41. СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ
- 42. Спасибо за внимание!Вопросы?СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ
- 43. Спасибо за внимание!Вопросы?СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ
- 44. Скачать презентанцию
Слайды и текст этой презентации
Слайд 1Лекция 4
Химическая связь.
Типы и характеристики химической связи.
Метод валентных
связей (МВС).
(МО ЛКАО)Слайд 3СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ
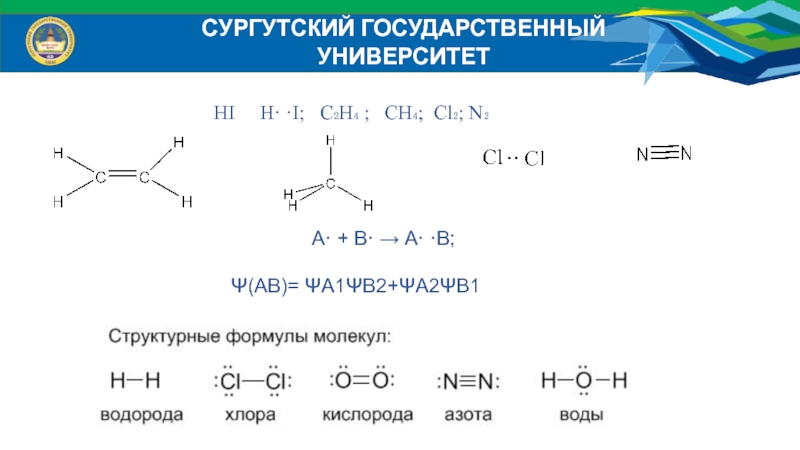
HI H· ·I; C₂H₄ ;
CH₄; Cl₂; N₂
А· + В· → А· ·В;
Ψ(АВ)= ΨА1ΨВ2+ΨА2ΨВ1
Слайд 4СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ
Термин «химическое строение» введено А.М. Бутлеровым в 1861
году. Также он заложил основы теории химического строения.
Положения теории
химического строения молекул1. Атомы в молекулах соединены друг с другом в определённой последовательности. Изменение этой последовательности приводит к образованию нового вещества с новыми свойствами.
2. Соединение атомов происходит в соответствии с их валентностью.
3. Свойства веществ зависят не только от их состава, но и от «химического строения», то есть от порядка соединения атомов в молекулах и характера их взаимного влияния.
Слайд 5СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ
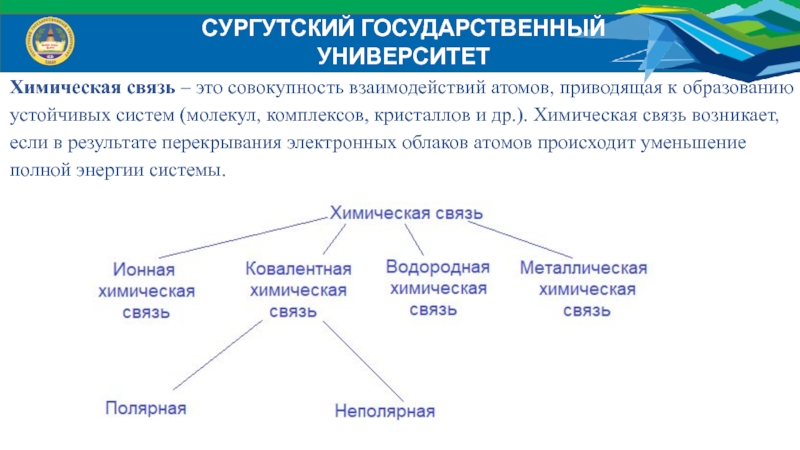
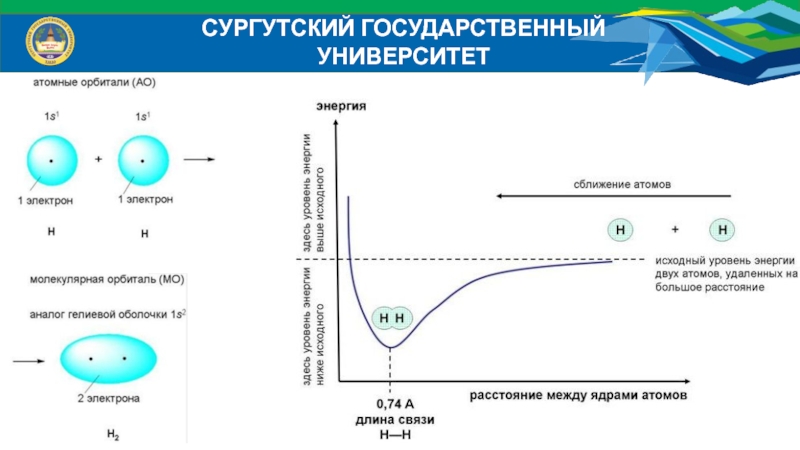
Химическая связь – это совокупность взаимодействий атомов, приводящая
к образованию устойчивых систем (молекул, комплексов, кристаллов и др.). Химическая
связь возникает, если в результате перекрывания электронных облаков атомов происходит уменьшение полной энергии системы.Слайд 6СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ
Ионная химическая связь – это связь, образовавшаяся за
счет электростатического притяжения катионов (положительно заряженных ионов) к анионам (отрицательно
заряженных ионов).Ионная связь возникает:
Между атомами, имеющими большую разность электроотрицательности
(Э.О>2);
2. Между атомами наиболее активных металлов и неметаллов;
При образовании ионной связи атом металла отдает свои электроны атому
неметалла, при этом каждый из атомов получает завершенный энергетический
уровень.
Слайд 7СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ
Физические свойства веществ
с ионной кристаллической решеткой:
тугоплавкие;
Нелетучие;
Твердые, но
хрупкие;
Многие растворимы;
В растворах и расплавах проводят электрический ток.
Слайд 8СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ
Ковалентная связь - это связь между атомами, возникающая
за счет образования
общих электронных пар.
Механизм образования ковалентной связи может быть различным:Обменный – когда каждый из взаимодействующих атомов предоставляет по
одному неспаренному электрону на образование общей электронной пары;
2. Донорно-акцепторный механизм, когда один атом предоставляет неподеленную
электронную пару (донор), а второй – вакантную орбиталь (акцептор).
Слайд 10СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ
Число общих электронных пар равно числу связей между
двумя атомами,
или кратности связи.
Простая (одинарная) связь образуется за счет
перекрывания электронныхоблаков по линии, соединяющей центры атомов (σ-связь):
Двойная связь содержит одну σ-связь и одну π-связь. π-связь образуется
за счет бокового перекрывания р- и d-орбиталей;
Тройная связь содержит одну σ-связь и две π-связи;
Полуторная связь (электронные облака «размазаны» между тремя и большим
числом атомов.
Слайд 11СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ
Параметры ковалентной связи:
1. Направленность – это такое размещение
электронной плотности между атомами, которое определяется расположением в пространстве валентных
орбиталей и обеспечивает их максимальное перекрывание.Электронные орбитали имеют разные формы и разную ориентацию в пространстве, поэтому их взаимное перекрывание может происходить разными способами. В зависимости от этого различают σ- и π-связи.
Количественно направленность связи выражается в виде валентных углов
между направлениями химической связи в молекулах.
Например:
Слайд 12СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ
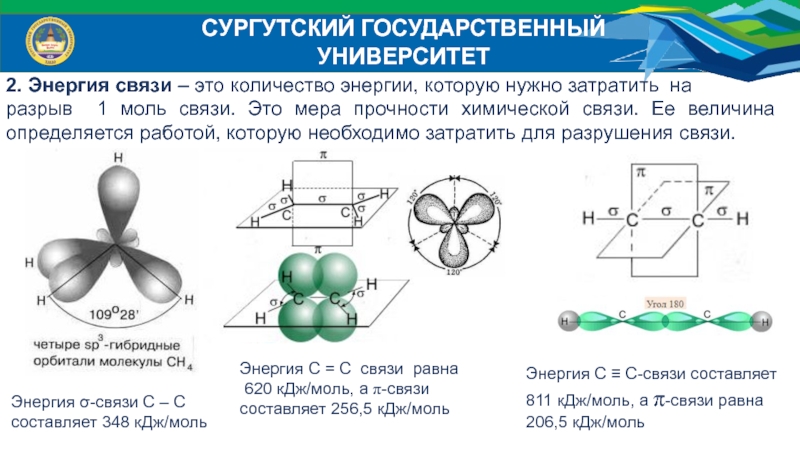
2. Энергия связи – это количество энергии, которую
нужно затратить на
разрыв 1 моль связи. Это мера прочности
химической связи. Ее величина определяется работой, которую необходимо затратить для разрушения связи.Энергия σ-связи С – С
составляет 348 кДж/моль
Энергия С = С связи равна
620 кДж/моль, а π-связи
составляет 256,5 кДж/моль
Энергия С ≡ С-связи составляет
811 кДж/моль, а π-связи равна 206,5 кДж/моль
Слайд 13СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ
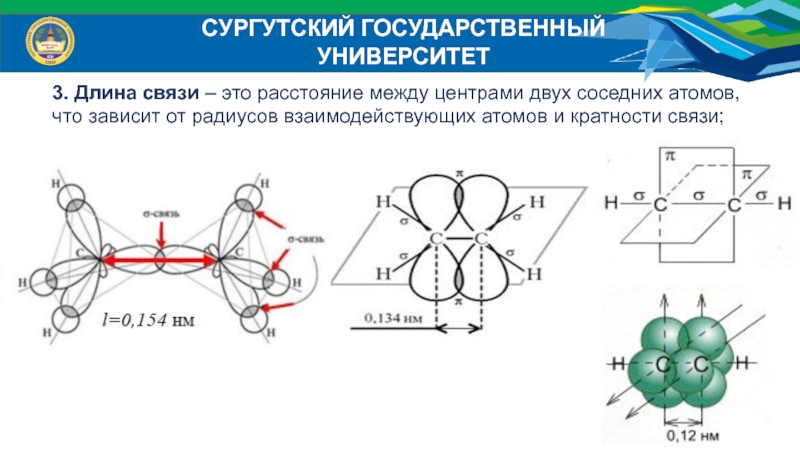
3. Длина связи – это расстояние между центрами
двух соседних атомов,
что зависит от радиусов взаимодействующих атомов и кратности
связи;Слайд 14СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ
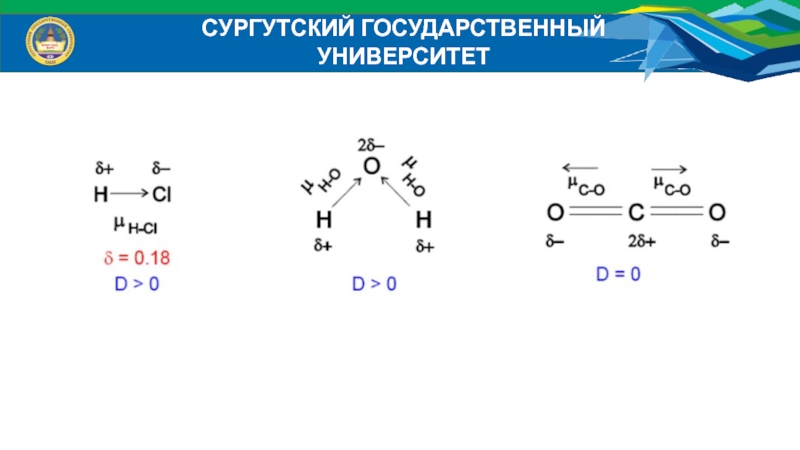
4. Полярность связи – неравномерное распределение электронной плотности
между атомами в молекуле.
Когда химическая связь образуется между
элементами с разной электроотрица-тельностью, электронная плотность между атомами смещена в сторону более
электроотрицательного атома, т.о., атом, который получает некоторый эффектив-
ный отрицательный заряд, а его партнер – некоторый положительный.
Такая связь будет поляризованной, а образованная молекула – полярной.
Возникает дипольный момент связи, находящийся на определенном расстоянии
на расстоянии длины диполя. Длина диполя и длина связи – это разные вели-
чины, поскольку центры тяжести не совпадают с центрами ядер. Диполь выражают
через электрический момент диполя (μ), который равен произведения заряда (δ) на
длину диполя (l):
Дипольный момент связи – это величина векторная, поэтому при наличии нескольких
связей в молекуле их электрические моменты (векторы) рассчитываются по
по правилу параллелограмма .
Слайд 16СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ
Вещества с ковалентной связью при обычных условиях бывают:
1.
Газами;
2. Жидкостями;
3. Твердыми телами, которые могут быть:
- аморфными (расположение
частиц в них неупорядоченное(например - стекло, смола, полимеры и т.д.);
- кристаллическими (характеризуются упорядоченной кристаллической
структурой – NaCl и т.п.). При этом может образовываться атомная
(атомная) или молекулярная ( ) кристаллические решетки.
Слайд 17СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ
При кристаллизации веществ с
ковалентной связью, образуются вещества с атомной кристаллической решеткой, в узлах
которой находятся атомы. Для таких веществ характерны прочность и твердость, высокие температуры плавления и кипения, хрупкость.Например: алмаз, графит, кремний, бор и сложные вещества: карборунд SiC, кремнезём, кварц, горный хрусталь, песок, в состав которых входит оксид кремния(IV) .
Слайд 18СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ
Молекулярную кристаллическую решётку имеют также вещества с ковалентными
полярными связями: вода — лёд, твёрдые аммиак, кислоты, оксиды неметаллов.
Большинство органических соединений тоже представляют собой молекулярные кристаллы (нафталин, сахар, глюкоза).Слайд 19СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ
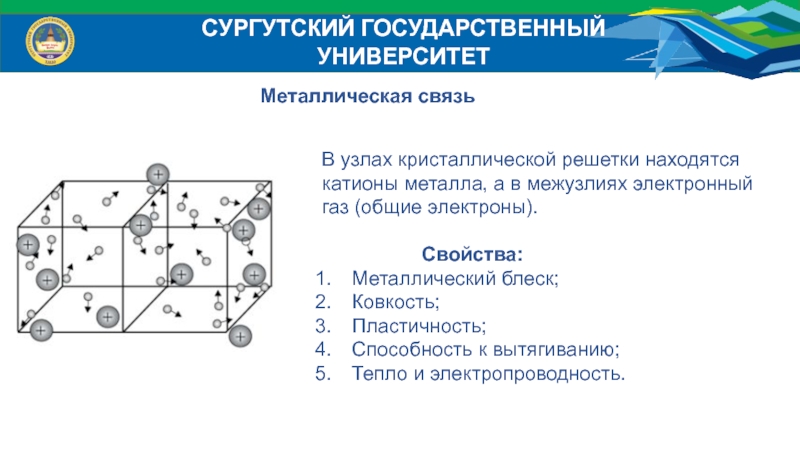
Металлическая связь
В узлах кристаллической решетки находятся
катионы металла,
а в межузлиях электронный
газ (общие электроны).
Свойства:
Металлический блеск;
Ковкость;
Пластичность;
Способность к вытягиванию;
Тепло и электропроводность.
Слайд 20СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ
Водородная химическая связь – это электростатическое притяжение
между сильно
электроотрицательными атомами (F, O, N) одной молекулы и водородом другой
молекулы.Механизм образования водородной связи близок к донорно-акцепторному:
Электростатическое притяжение элентрона к электроотрицательному атому, имеющему частичный отрицательный заряд:
Донорно-акцепторное взаимодействие между почти вакантной орбиталью атома водорода и неподеленной электронной парой электроотрицательного атома:
Слайд 21СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ
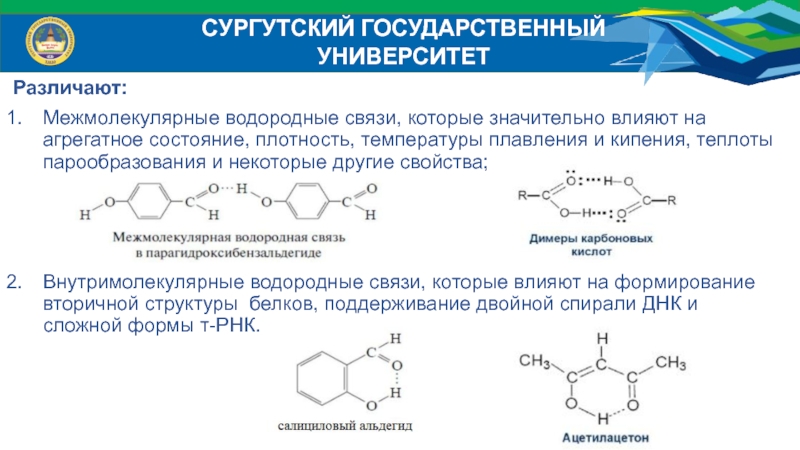
Различают:
Межмолекулярные водородные связи, которые значительно влияют на агрегатное
состояние, плотность, температуры плавления и кипения, теплоты парообразования и некоторые
другие свойства;Внутримолекулярные водородные связи, которые влияют на формирование вторичной структуры белков, поддерживание двойной спирали ДНК и сложной формы т-РНК.
Слайд 22СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ
Резких границ между разными видами химических связей нет,
все типы химической связи имеют единую природу.
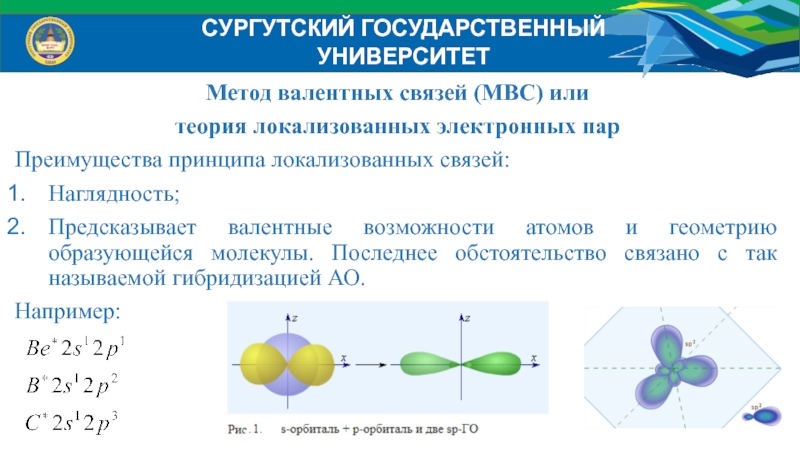
Слайд 23Метод валентных связей (МВС) или
теория локализованных электронных пар
Преимущества принципа
локализованных связей:
Наглядность;
Предсказывает валентные возможности атомов и геометрию образующейся молекулы. Последнее
обстоятельство связано с так называемой гибридизацией АО.Например:
СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ
Слайд 24Основные положения теории гибридизации:
1. Введение гибридных орбиталей служит для описания
направленных локализованных связей. Гибридные орбитали обеспечивают максимальное перекрывание АО в
направлении локализованных σ-связей;2. Число гибридных орбиталей равно числу АО, участвующих в гибридизации;
3. Гибридизуются близкие по энергии валентные АО независимо от того, заполнены они в атоме полностью, наполовину или пусты;
4. В гибридизации участвуют АО, имеющие общие признаки симметрии.
СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ
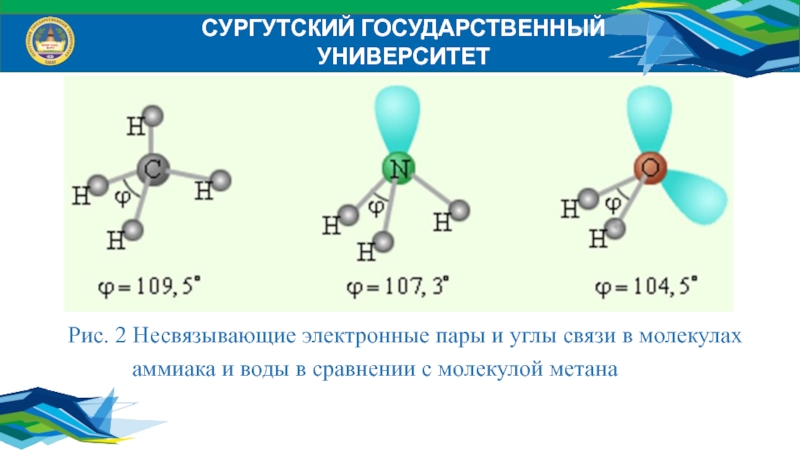
Слайд 25Рис. 2 Несвязывающие электронные пары и углы связи в молекулах
аммиака и воды в
сравнении с молекулой метанаСУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ
Слайд 27 Распределение электронов в пространстве описывается
вероятностью нахождения электрона в определенном
месте атомного пространства:Вероятность заполнения связующих орбиталей на больше, чем
разрыхляющих, т.е. возможно два варианта распределения электронной плотности:
СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ
Слайд 28СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ
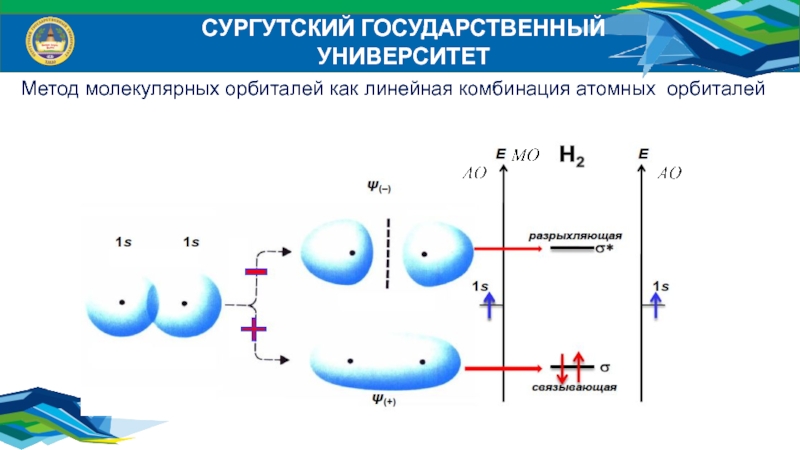
Метод молекулярных орбиталей как линейная комбинация атомных орбиталей
Слайд 29Основные положения МО ЛКАО
Молекулярные орбитали (МО) образуются при перекрывании атомных
орбиталей (АО);
Число МО равно числу АО, принимающих участие в
образовании химической связи;Каждой паре атомных орбиталей (АО) соответствует пара молекулярных орбиталей (МО): связующая и разрыхляющая соответственно;
Связующая орбиталь имеет энергию ниже, чем энергия атомной орбитали, разрыхляющая – выше:
атомные s-орбитали образуют σ-связующие и разрыхляющую
МО; АО образуют связ. и разр. МО;
АО образуют МО, соответственно связующую и разрыхляющую.
СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ
Слайд 305. Заполнение молекулярных орбиталей осуществляется парой электронов в соответствии с
принципом наименьшей энергии, принципом Паули и правилом Хунда.
6. Порядок связи
(N) в молекуле определяется по формуле:n – число электронов на связующих и разрыхляющих орбиталях;
z – число взаимодействующих атомов в молекуле;
в соответствии с их энергией и изображается в виде молекулярной диаграммы. Химическая связь между атомами образуется, если число
электронов на связующих МО больше числа электронов
на разрыхляющих МО.
СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ
Слайд 31СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ
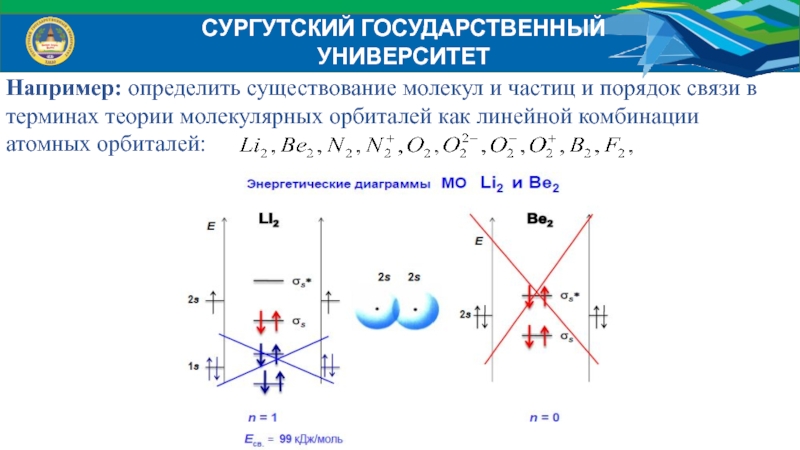
Например: определить существование молекул и частиц и порядок
связи в
терминах теории молекулярных орбиталей как линейной комбинации
атомных орбиталей:
Слайд 32СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ
Например: определить существование молекул и частиц и порядок
связи в
терминах теории молекулярных орбиталей как линейной комбинации
атомных орбиталей:
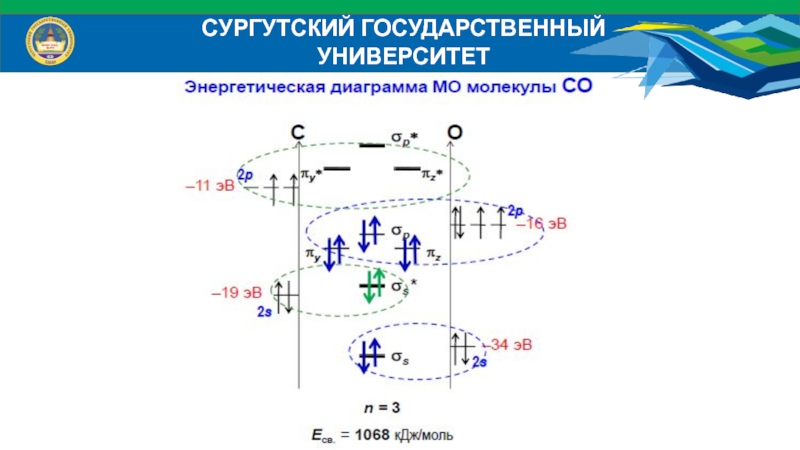
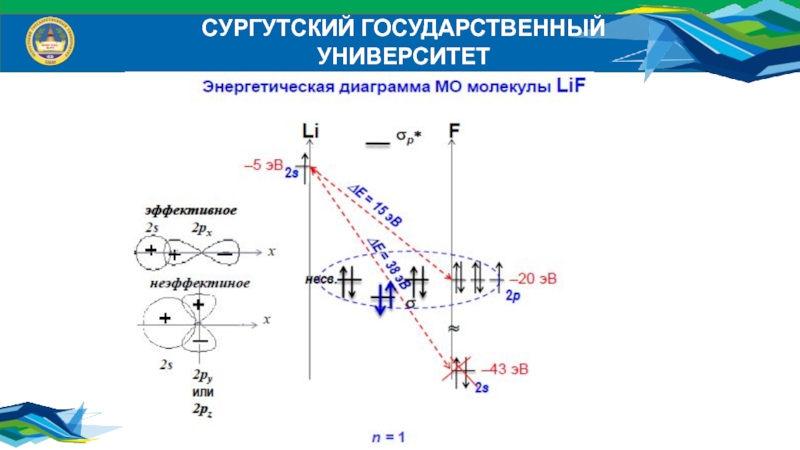
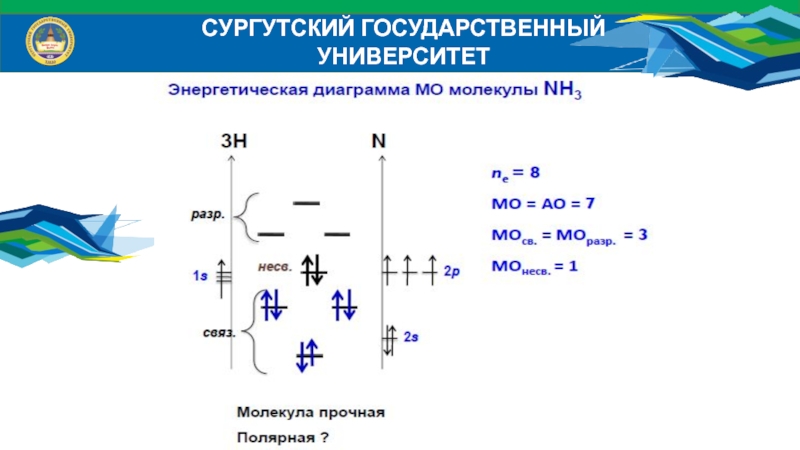
Слайд 39СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ
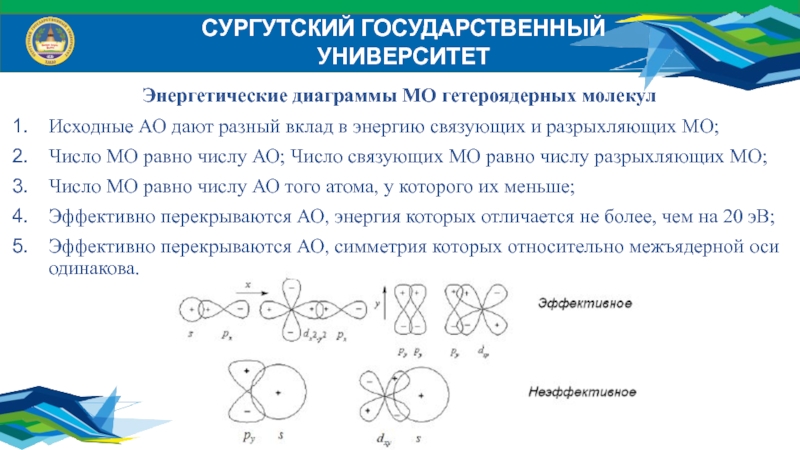
Энергетические диаграммы МО гетероядерных молекул
Исходные АО дают разный
вклад в энергию связующих и разрыхляющих МО;
Число МО равно числу
АО; Число связующих МО равно числу разрыхляющих МО;Число МО равно числу АО того атома, у которого их меньше;
Эффективно перекрываются АО, энергия которых отличается не более, чем на 20 эВ;
Эффективно перекрываются АО, симметрия которых относительно межъядерной оси одинакова.