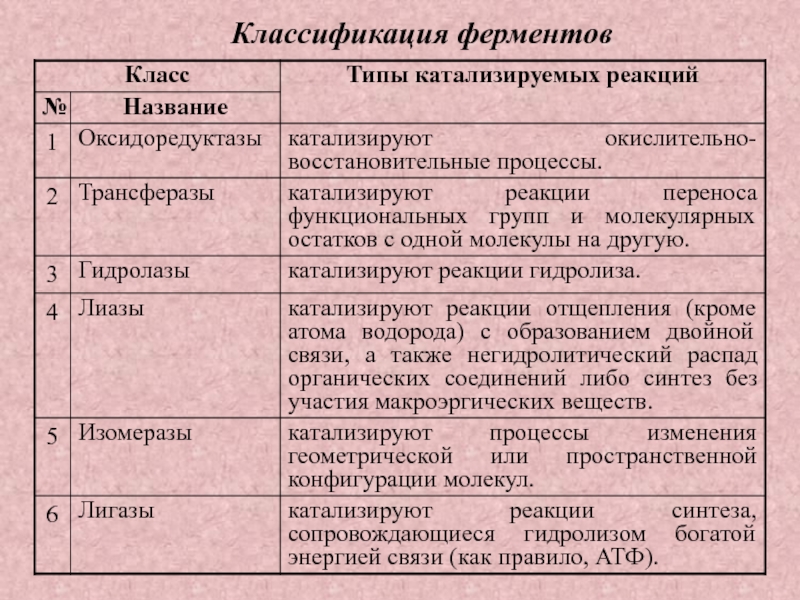
Слайд 2В 1878 гг. Кюне предложил термин энзим (от греч. en
– внутри, zyme – закваска). Оба названия свидетельствуют о том,
что первые сведения об этих веществах были получены при изучении процессов брожения.
Роль ферментов в жизнедеятельности всех живых организмов огромна. И.П. Павлов писал: «Ферменты есть, так сказать, первый акт жизненной деятельности. Все химические процессы направляются в теле именно этими веществами, они есть возбудители всех химических превращений. Все эти вещества играют огромную роль, они обусловливают собою те процессы, благодаря которым проявляется жизнь, они и есть в полном смысле возбудители жизни».
Слайд 3Раздел биохимии, изучающий биологические катализаторы белковой природы, называется энзимологией. Круг
вопросов, изучаемых энзимологией, весьма разнообразен. Он включает выделение и очистку
ферментов с целью установления их состава и молекулярной структуры; изучение условий и скорости действия ферментов, а также влияния на них разнообразных физических и химических факторов.
Слайд 4Ферменты и катализаторы неорганической природы, подчиняясь общим законам катализа, имеют
сходные признаки:
• катализируют только энергетически возможные реакции;
• не изменяют направление
реакции;
• не расходуются в процессе реакции;
• не участвуют в образовании продуктов реакции.
Однако ферменты по ряду признаков отличаются от катализаторов неорганической природы:
• ферменты – белки;
• ферменты «работают» в «мягких» условиях: при атмосферном давлении, при температуре 30 – 40°С, рН-среды близко к нейтральному;
• скорость ферментного катализа выше, чем небиологического;
• обладают высокой специфичностью по отношению к субстрату, каждый фермент катализирует единственную реакцию либо группу реакций одного типа;
• ферменты – катализаторы с регулируемой активностью;
• ферментативный процесс можно представить в виде цепи простых химических превращений вещества, четко запрограммированных во времени и в пространстве.
Слайд 5Строение ферментов
Ферменты
Сложные
(двухкомпонентные)
Состоит из апофермента (белковая часть) и кофермента (небелковая часть).
Простые
(однокомпонентные)
Состоит
только из белковой части.
Особенностью сложных ферментов является то, что отдельно
апофермент и кофермент не обладают каталитической активностью.,
Слайд 6Кофакторы ферментов – вещества, необходимые некоторым ферментам для проявления активности.
Известны две группы кофакторов:
неорганические – ионы металлов и некоторые
анионы.
органические – соединения нуклеотидной природы, производные витаминов.
Ионы металлов, выполняющих роль кофакторов в ферментативных реакциях, - это ионы калия, магния, кальция, цинка, меди, железа, молибдена.
Ферменты, активируемые катионами металлов
Слайд 7Витамины и их производные – коферменты
ФАД – флавинадениндинуклеотид; НАД –
никотинаминадениндинуклеотид;
ФМН – флавомононуклеотид; НАДФ – никотинаминадениндинуклеотидфосфат;
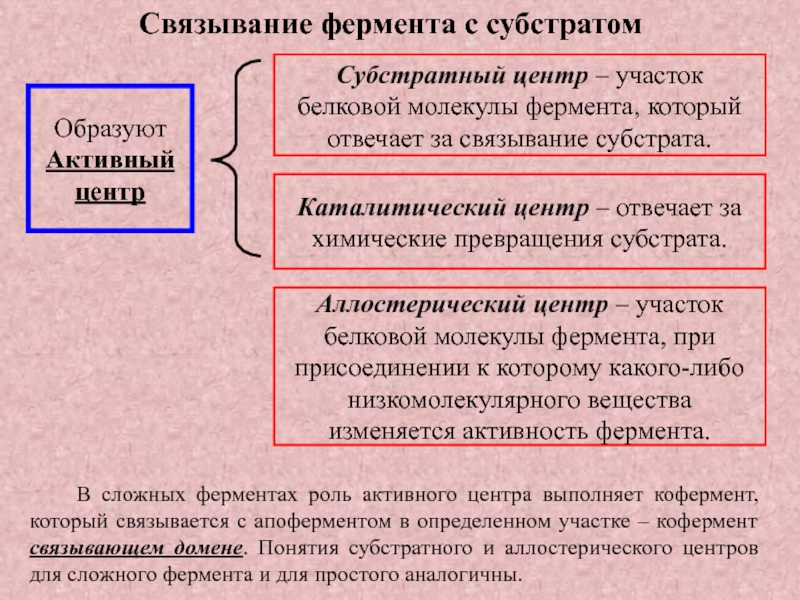
Слайд 8Субстратный центр – участок белковой молекулы фермента, который отвечает за
связывание субстрата.
Аллостерический центр – участок белковой молекулы фермента, при
присоединении к которому какого-либо низкомолекулярного вещества изменяется активность фермента.
Каталитический центр – отвечает за химические превращения субстрата.
В сложных ферментах роль активного центра выполняет кофермент, который связывается с апоферментом в определенном участке – кофермент связывающем домене. Понятия субстратного и аллостерического центров для сложного фермента и для простого аналогичны.
Связывание фермента с субстратом
Образуют
Активный
центр
Слайд 9Субстратный центр
Субстратный центр простого фермента - это участок белковой молекулы
фермента, который отвечает за связывание субстрата. Субстратный центр образно называют
«якорной площадкой», где субстрат прикрепляется к ферменту за счет различных взаимодействий между определенными боковыми радикалами аминокислотных остатков и соответствующими группами молекулы субстрата. Субстрат с ферментом связывается посредством ионных взаимодействий, водородных связей; иногда субстрат и фермент связываются ковалентно.
Слайд 10Каталитический центр
Каталитический центр простого фермента представляет собой уникальное сочетание нескольких
аминокислотных остатков, расположенных на разных участках полипептидной цепи. Образование каталитического
центра происходит одновременно с формированием третичной структуры белковой молекулы фермента. Чаще всего в состав каталитического центра входят остатки серина, цистеина, тирозина, гистидина, аргинина, аспарагиновой и глутаминовой кислот.
Слайд 11Аллостерический центр
Аллостерический центр представляет собой участок молекулы фермента, в результате
присоединения к которому какого-то низкомолекулярного вещества изменяется третичная структура белковой
молекулы фермента, что влечет за собой изменение его активности. Аллостерический центр является регуляторным центром фермента.
Слайд 12Механизм действия ферментов
Основы механизма действия ферментов были изучены в начале
XX века. В 1902 году английский химик А. Браун высказал
предположение о том, что фермент, воздействуя на субстрат, должен образовать с ним промежуточный фермент – субстратный комплекс. Одновременно и независимо от А.Брауна это же предположение высказал французский ученый В. Анри. В 1913 году Л. Михелис и М. Ментэн подтвердили и развили представления о механизме действия ферментов, который можно представить в виде схемы:
E+S[E*S]`[E*S]`[EP]E+P
где E – фермент; S – субстрат; P – продукт.
Слайд 13На первой стадии ферментативного катализа происходит образование фермент-субстратного комплекса, где
фермент и субстрат могут быть связаны ионной, ковалентной или иной
связью. Образование комплекса E*S происходит практически мгновенно.
На второй стадии субстрат под воздействием связанного с ним фермента видоизменяется и становится более доступным для соответствующей химической реакции. Эта стадия определяет скорость всего процесса.
На третьей стадии происходит химическая реакция, в результате которой образуется комплекс продукта реакции с ферментом.
Заключительным процессом является высвобождение продукта реакции из комплекса.
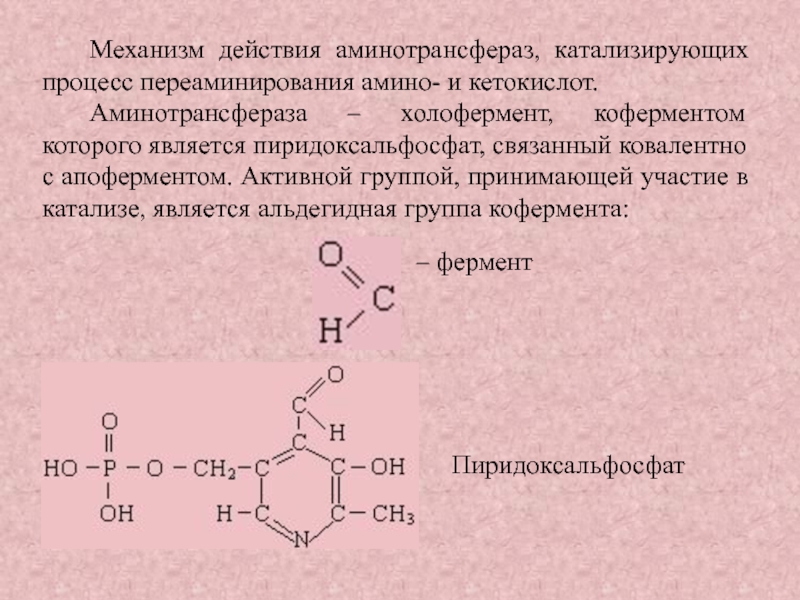
Слайд 14Механизм действия аминотрансфераз, катализирующих процесс переаминирования амино- и кетокислот.
Аминотрансфераза –
холофермент, коферментом которого является пиридоксальфосфат, связанный ковалентно с апоферментом. Активной
группой, принимающей участие в катализе, является альдегидная группа кофермента:
– фермент
Пиридоксальфосфат
Слайд 15На первой стадии ферментативного катализа происходит образование ферментсубстратного комплекса [E*S],
в котором фермент и субстрат связаны ковалентной связью:
Слайд 16На второй стадии происходит преобразование субстрата, выражающееся в таутомерной перегруппировке,
что приводит к образованию комплекса [E*S]`:
Слайд 17Третья стадия
В результате химической реакции образуется кетокислота, а фермент высвобождается
из комплекса в виде пиридоксаминфермента. Чтобы не нарушался один из
основных принципов катализа, в данном процессе принимает участие кетокислота.
Слайд 18Свойства ферментов
Ферменты обладают всеми свойствами белков. Однако по сравнению с
белками, выполняющими другие функции в клетке, ферменты имеют ряд специфических,
присущих только им свойств.
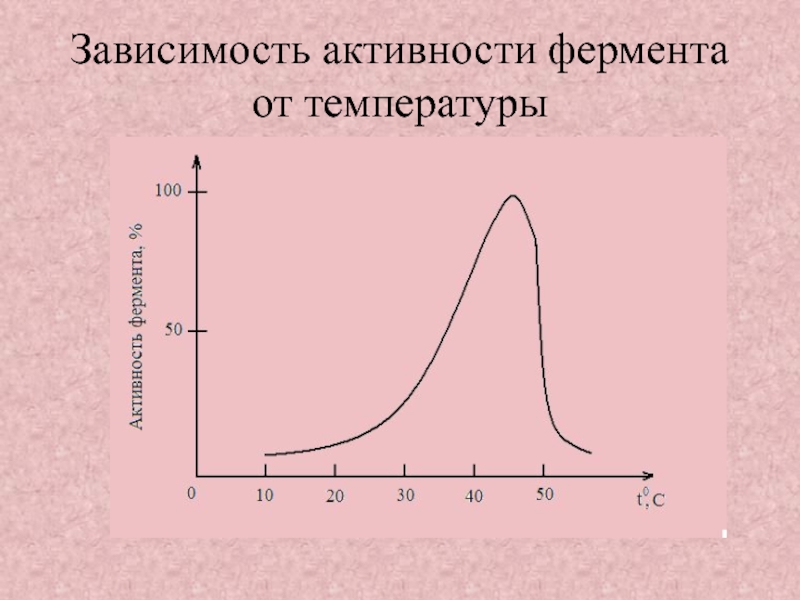
Зависимость активности фермента от температуры;
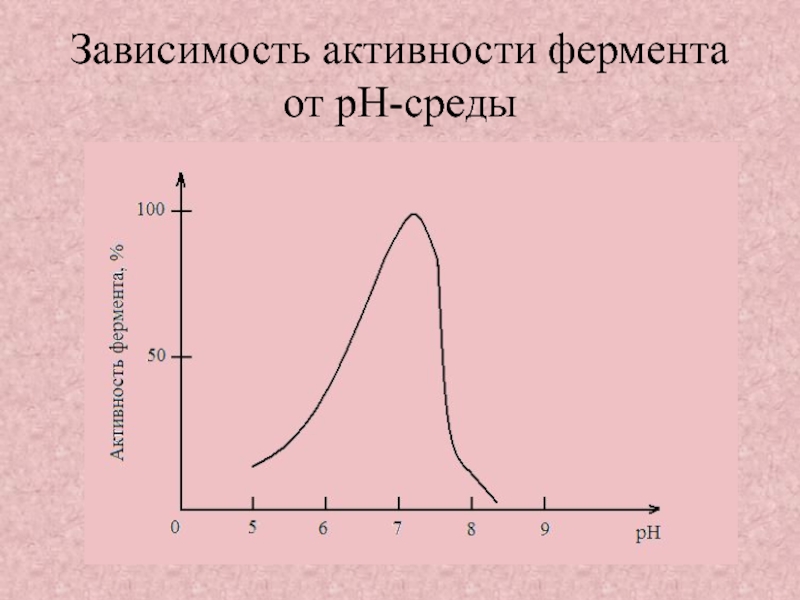
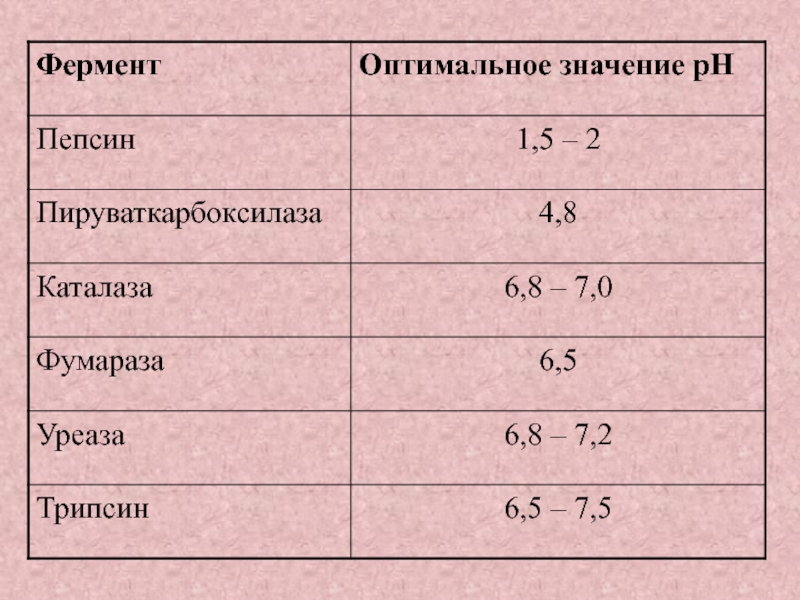
Зависимость активности фермента от pH-среды;
Специфичность;
Влияние на активность ферментов активаторов и ингибиторов.
Слайд 19Зависимость активности фермента от температуры
Слайд 20Зависимость активности фермента от pH-среды
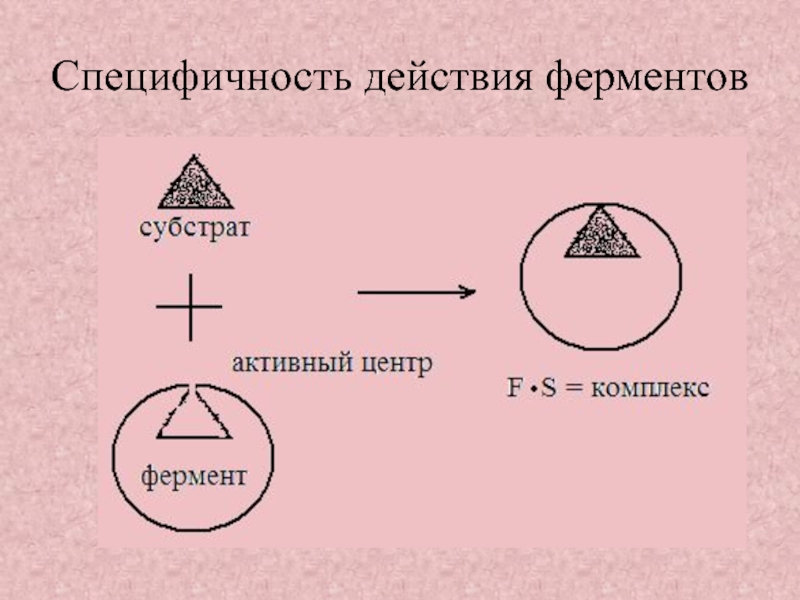
Слайд 22Специфичность действия ферментов
Слайд 23Стереохимическая субстратная специфичность фермент катализирует превращение только одного стереоизомера субстрата
Абсолютная
субстратная специфичность фермент катализирует превращение только одного субстрата
Групповая
субстратная специфичность фермент катализирует превращение группы субстратов сходной химической структуры
Специфичность – избирательность фермента по отношению к субстрату
Слайд 24Влияние на активность ферментов активаторов и ингибиторов
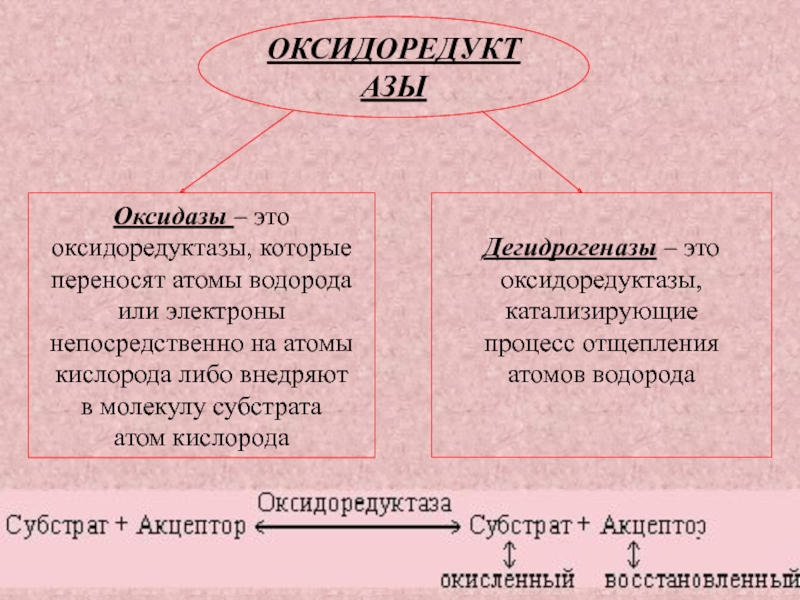
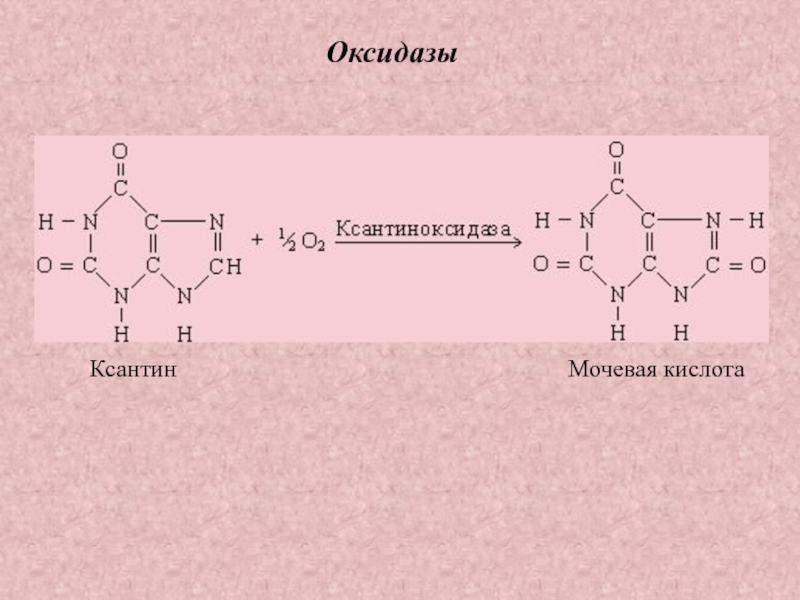
Слайд 26ОКСИДОРЕДУКТАЗЫ
Оксидазы – это
оксидоредуктазы, которые
переносят атомы водорода
или электроны
непосредственно на атомы
кислорода либо внедряют
в молекулу субстрата
атом
кислорода
Дегидрогеназы – это
оксидоредуктазы,
катализирующие
процесс отщепления
атомов водорода
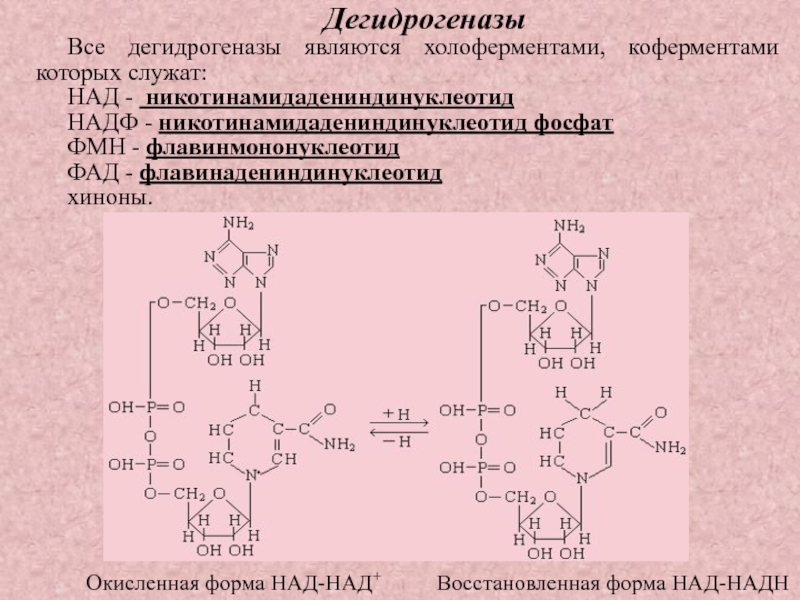
Слайд 28Дегидрогеназы
Все дегидрогеназы являются холоферментами, коферментами которых служат:
НАД - никотинамидадениндинуклеотид
НАДФ
- никотинамидадениндинуклеотид фосфат
ФМН - флавинмононуклеотид
ФАД - флавинадениндинуклеотид
хиноны.
Окисленная форма
НАД-НАД+ Восстановленная форма НАД-НАДН
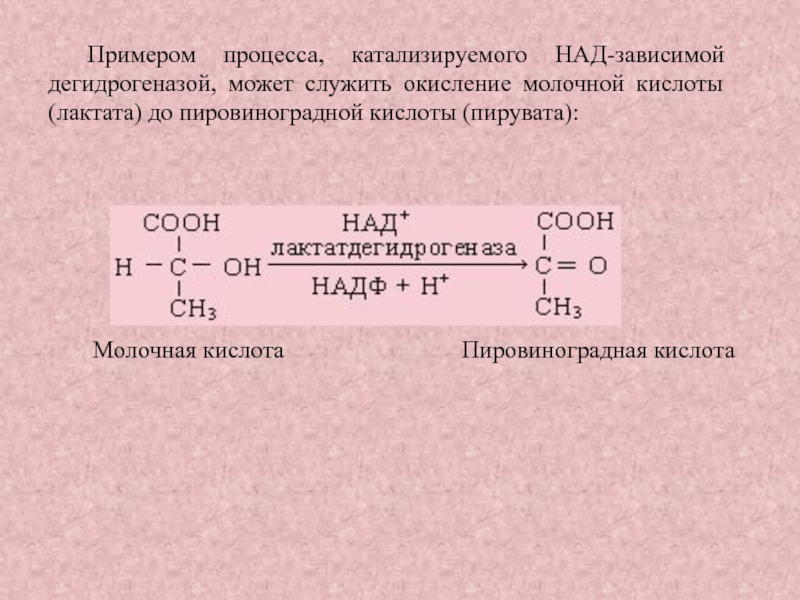
Слайд 29Примером процесса, катализируемого НАД-зависимой дегидрогеназой, может служить окисление молочной кислоты
(лактата) до пировиноградной кислоты (пирувата):
Молочная кислота
Пировиноградная кислота
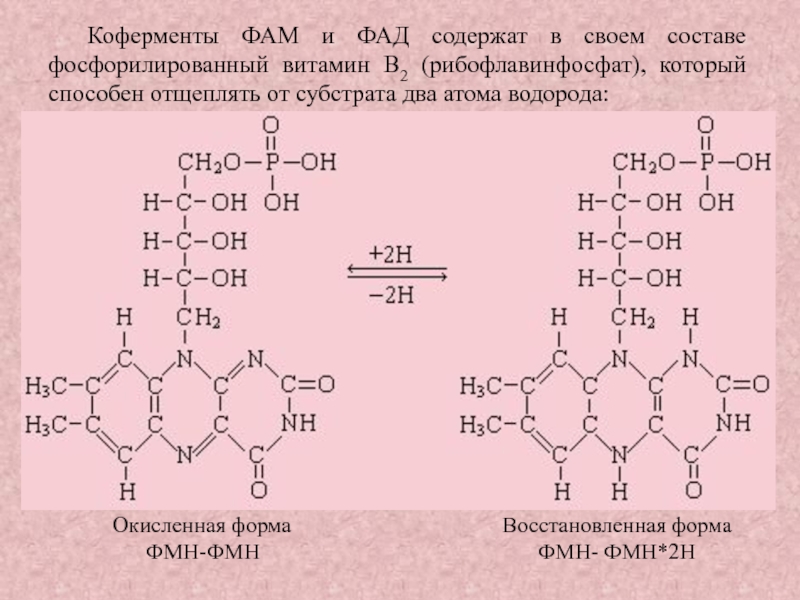
Слайд 30Коферменты ФАМ и ФАД содержат в своем составе фосфорилированный витамин
В2 (рибофлавинфосфат), который способен отщеплять от субстрата два атома водорода:
Окисленная форма Восстановленная форма
ФМН-ФМН ФМН- ФМН*2Н
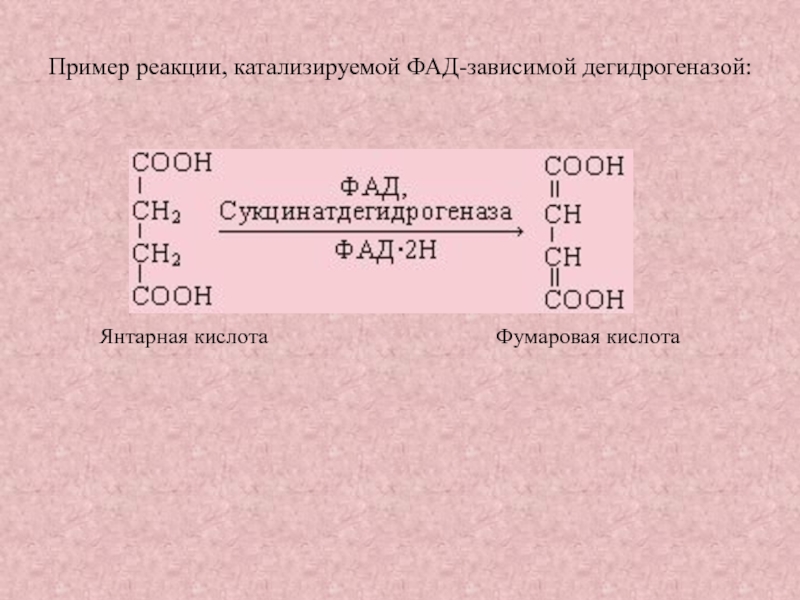
Слайд 31Пример реакции, катализируемой ФАД-зависимой дегидрогеназой:
Янтарная кислота
Фумаровая кислота
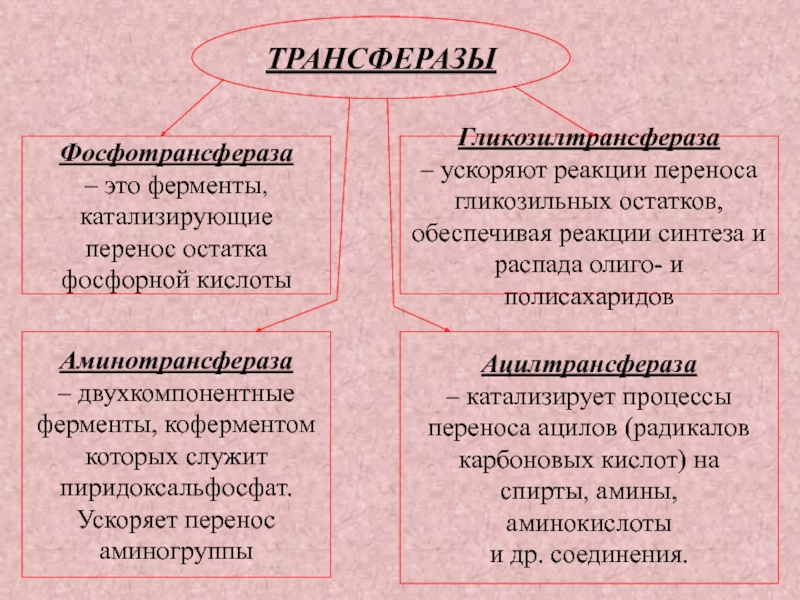
Слайд 32ТРАНСФЕРАЗЫ
Фосфотрансфераза
– это ферменты,
катализирующие
перенос остатка
фосфорной кислоты
Аминотрансфераза
–
двухкомпонентные
ферменты, коферментом
которых служит
пиридоксальфосфат.
Ускоряет перенос
аминогруппы
Гликозилтрансфераза
–
ускоряют реакции переноса
гликозильных остатков,
обеспечивая реакции синтеза и
распада олиго- и полисахаридов
Ацилтрансфераза
– катализирует процессы
переноса ацилов (радикалов
карбоновых кислот) на
спирты, амины,
аминокислоты
и др. соединения.
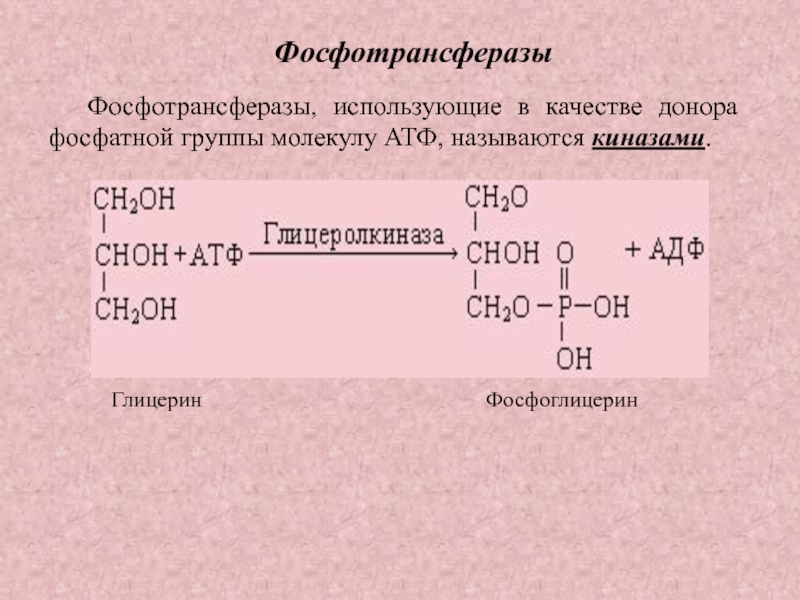
Слайд 33Фосфотрансферазы
Фосфотрансферазы, использующие в качестве донора фосфатной группы молекулу АТФ, называются
киназами.
Глицерин
Фосфоглицерин
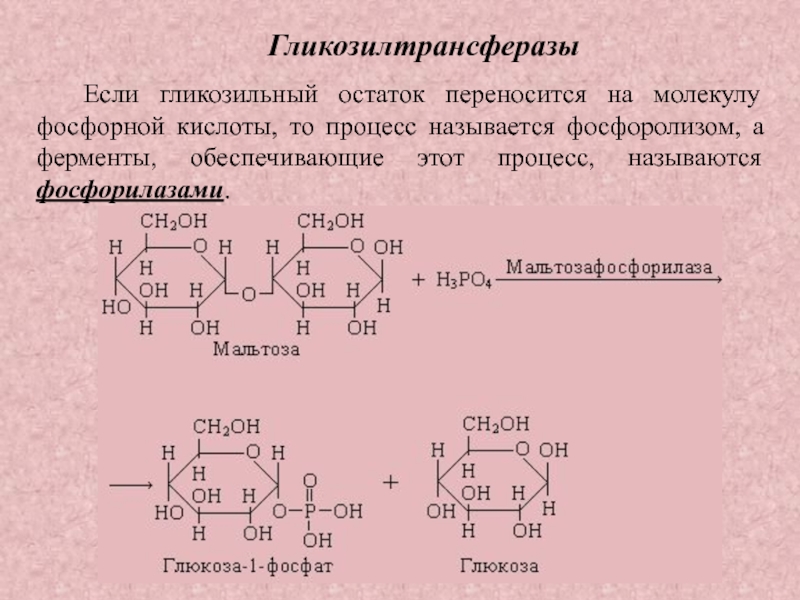
Слайд 34Гликозилтрансферазы
Если гликозильный остаток переносится на молекулу фосфорной кислоты, то процесс
называется фосфоролизом, а ферменты, обеспечивающие этот процесс, называются фосфорилазами.
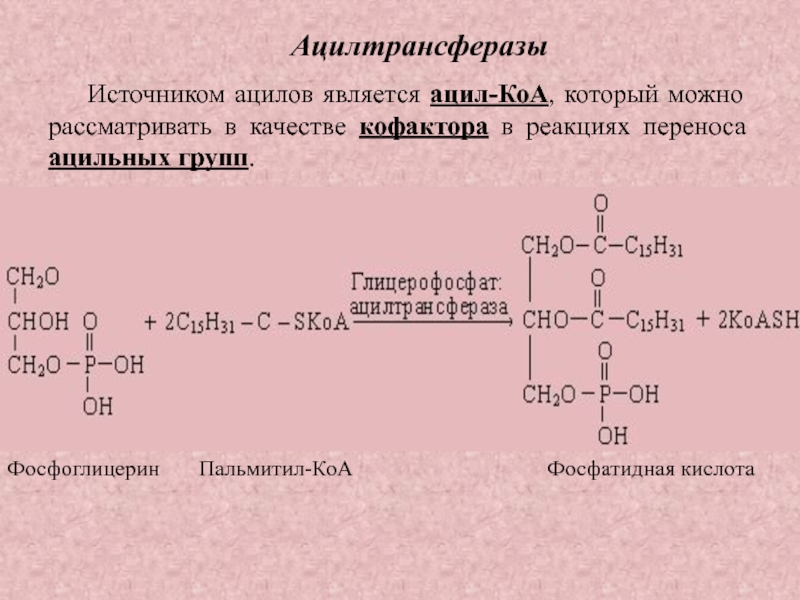
Слайд 35Ацилтрансферазы
Источником ацилов является ацил-КоА, который можно рассматривать в качестве кофактора
в реакциях переноса ацильных групп.
Фосфоглицерин Пальмитил-КоА
Фосфатидная кислота
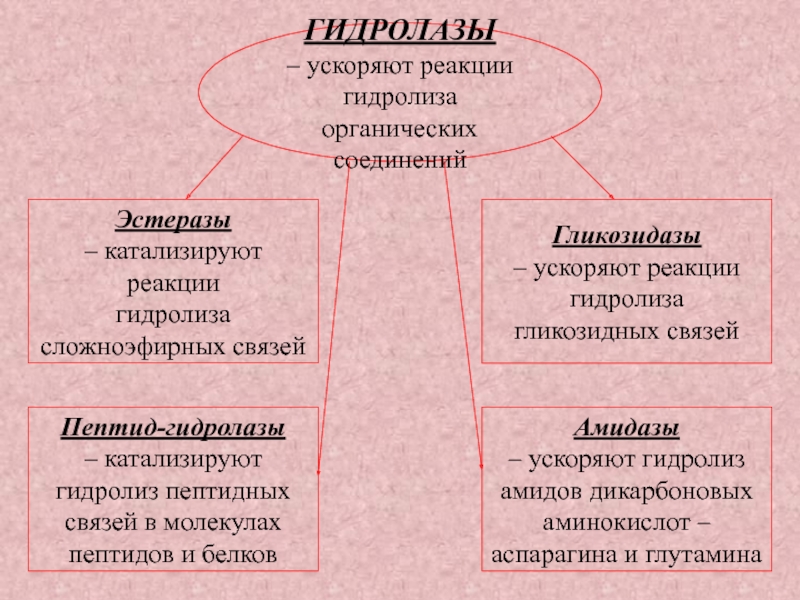
Слайд 36ГИДРОЛАЗЫ
– ускоряют реакции
гидролиза органических
соединений
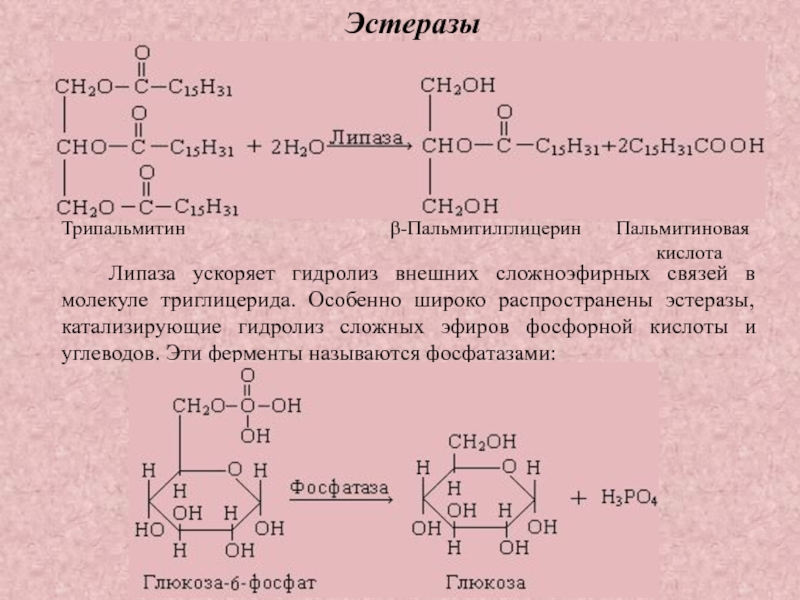
Эстеразы
– катализируют реакции
гидролиза
сложноэфирных связей
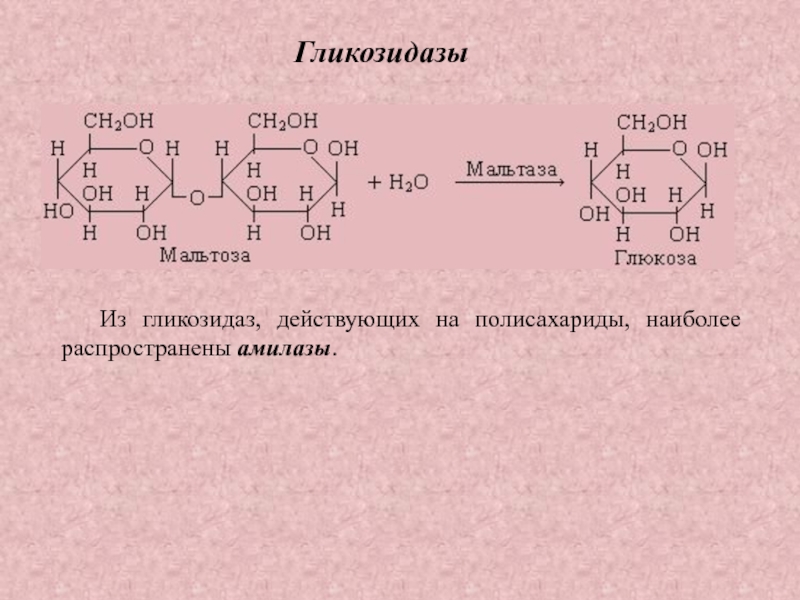
Гликозидазы
– ускоряют реакции
гидролиза
гликозидных связей
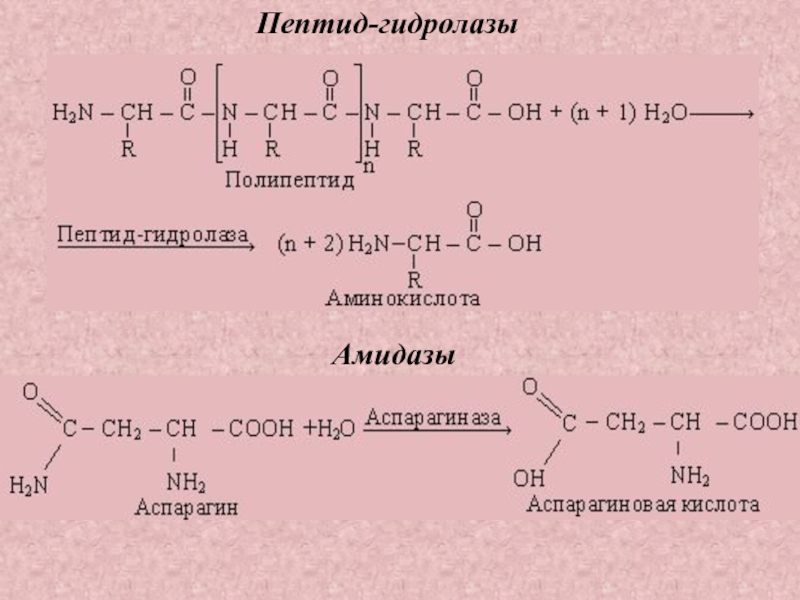
Пептид-гидролазы
–
катализируют
гидролиз пептидных
связей в молекулах
пептидов и белков
Амидазы
– ускоряют гидролиз
амидов дикарбоновых
аминокислот –
аспарагина и глутамина
Слайд 37Эстеразы
Липаза ускоряет гидролиз внешних сложноэфирных связей в молекуле триглицерида. Особенно
широко распространены эстеразы, катализирующие гидролиз сложных эфиров фосфорной кислоты и
углеводов. Эти ферменты называются фосфатазами:
Трипальмитин β-Пальмитилглицерин Пальмитиновая
кислота
Слайд 38Гликозидазы
Из гликозидаз, действующих на полисахариды, наиболее распространены амилазы.
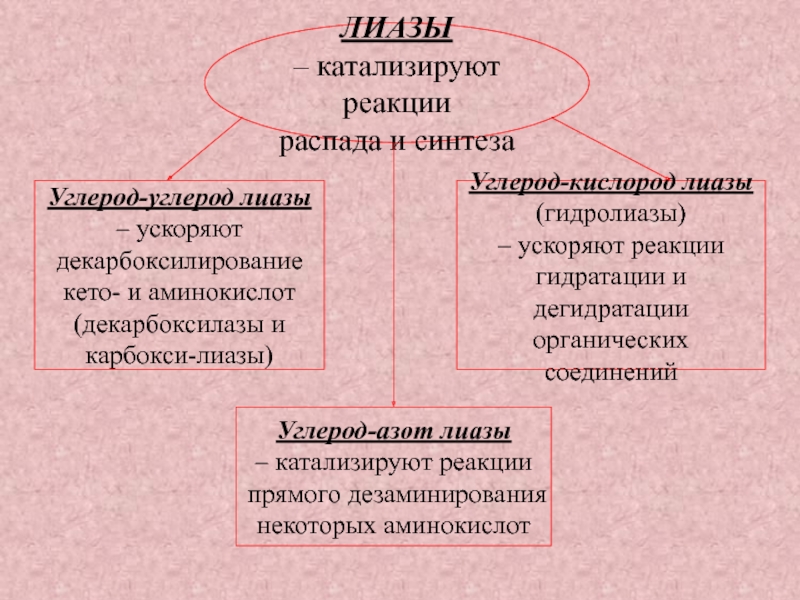
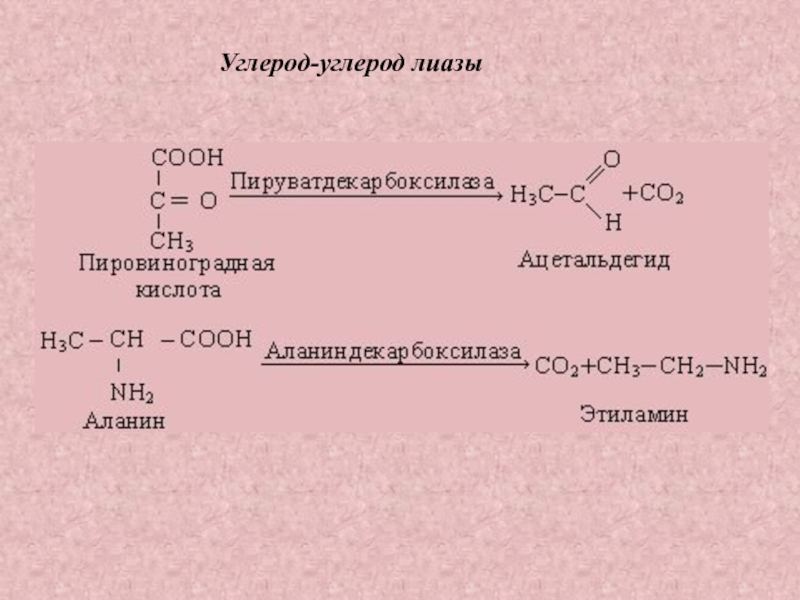
Слайд 40ЛИАЗЫ
– катализируют реакции
распада и синтеза
Углерод-углерод лиазы
– ускоряют
декарбоксилирование
кето-
и аминокислот
(декарбоксилазы и
карбокси-лиазы)
Углерод-кислород лиазы
(гидролиазы)
– ускоряют реакции
гидратации и дегидратации
органических соединений
Углерод-азот лиазы
– катализируют реакции
прямого дезаминирования
некоторых аминокислот
Слайд 42Углерод-кислород лиазы (гидролиазы)
Углерод-азот лиазы
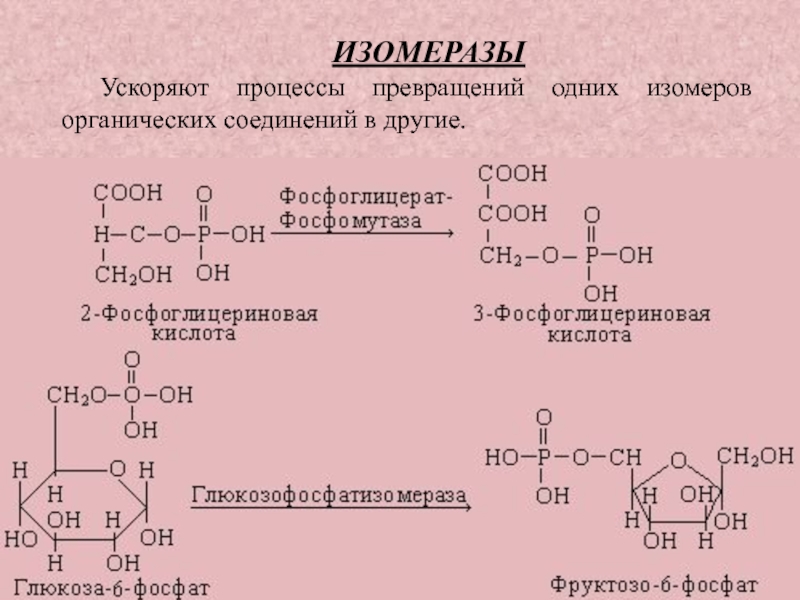
Слайд 43ИЗОМЕРАЗЫ
Ускоряют процессы превращений одних изомеров органических соединений в другие.
Слайд 44ЛИГАЗЫ (синтетазы)
Обеспечивают синтез различных органических соединений
Важной реакцией является образование ацил-коэнзима
А (КоА), которая тоже ускоряется ферментом, относящимся к рассматриваемому классу:












![Лекция 6 Ферменты На первой стадии ферментативного катализа происходит образование ферментсубстратного комплекса [E*S], в На первой стадии ферментативного катализа происходит образование ферментсубстратного комплекса [E*S], в котором фермент и субстрат связаны ковалентной](/img/tmb/3/221791/65aceb7dac67a5c70115d8f5efb3445b-800x.jpg)
![Лекция 6 Ферменты На второй стадии происходит преобразование субстрата, выражающееся в таутомерной перегруппировке, что приводит к образованию комплекса [E*S]`: На второй стадии происходит преобразование субстрата, выражающееся в таутомерной перегруппировке, что приводит к образованию комплекса [E*S]`:](/img/thumbs/a7236699d1bf95af5eaf608e2d82fd4a-800x.jpg)