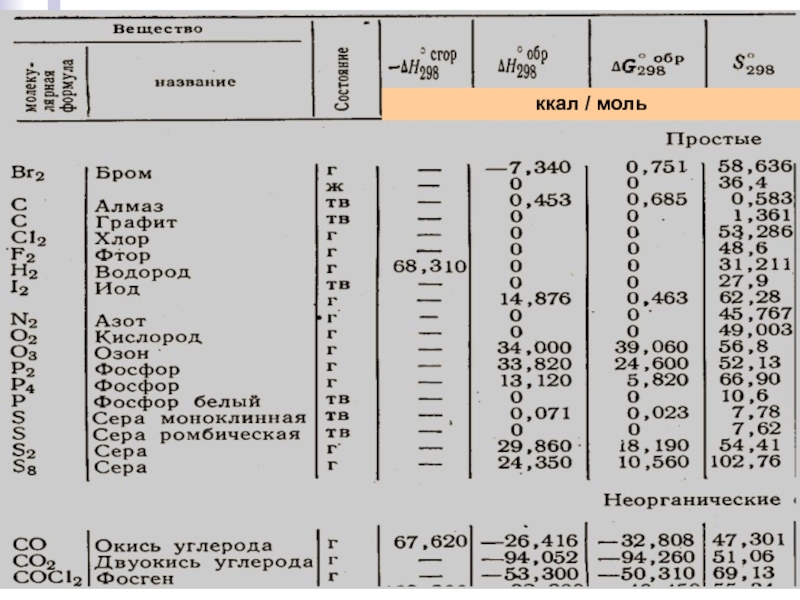
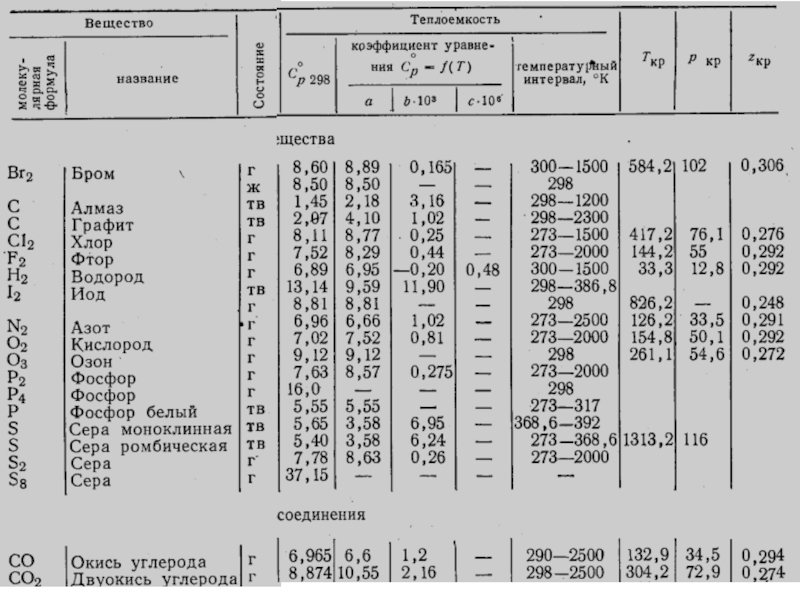
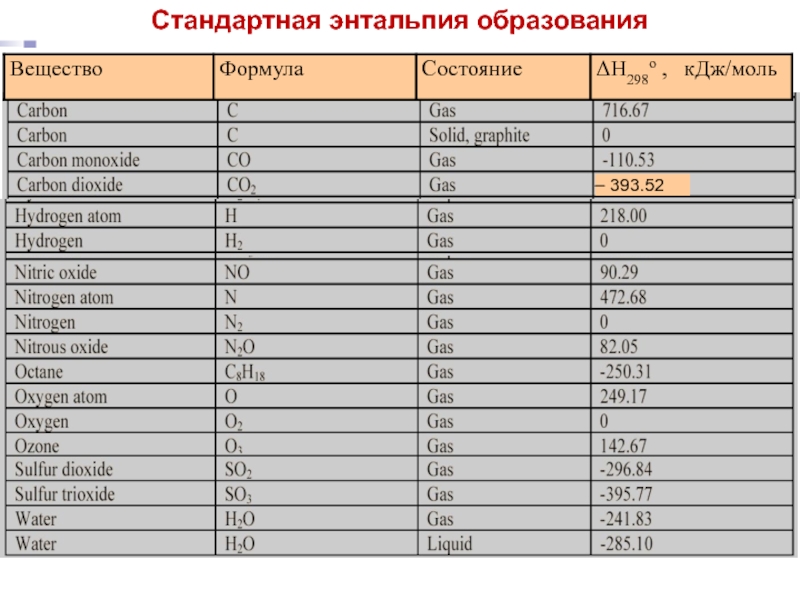
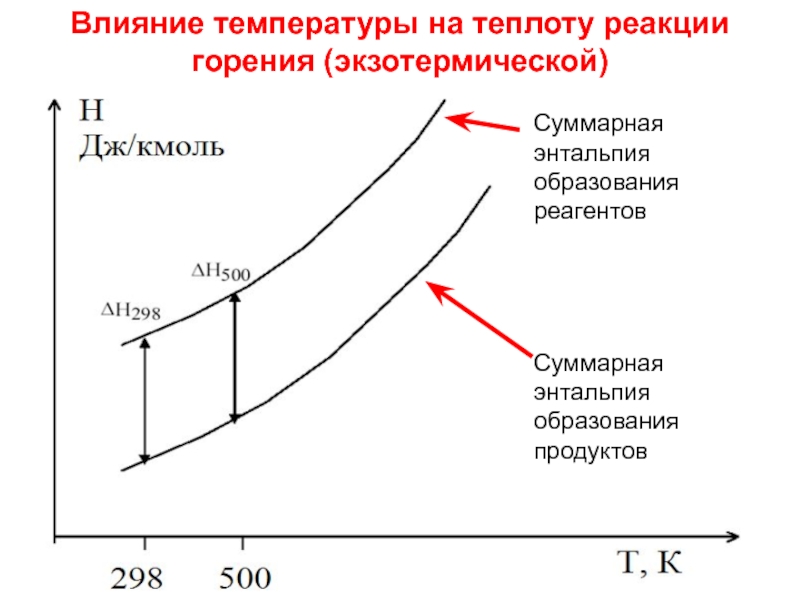
- стехиометрические коэффициенты, показывающие число молей вещества, участвующих в реакции.
Топливо Лекция
6 Процессы горения/газификации, так же как и другие химические превращения, описываются уравнениями химических реакций, имеющими вид
Уравнение химической реакции