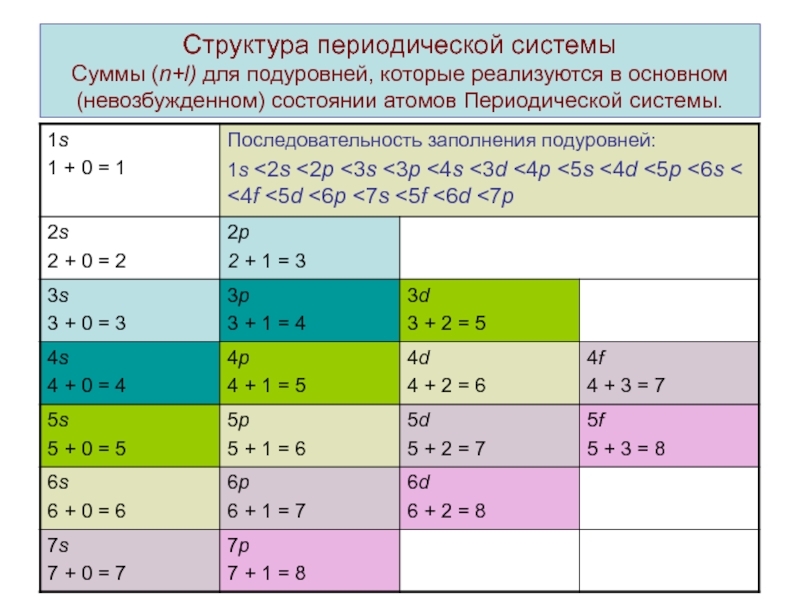
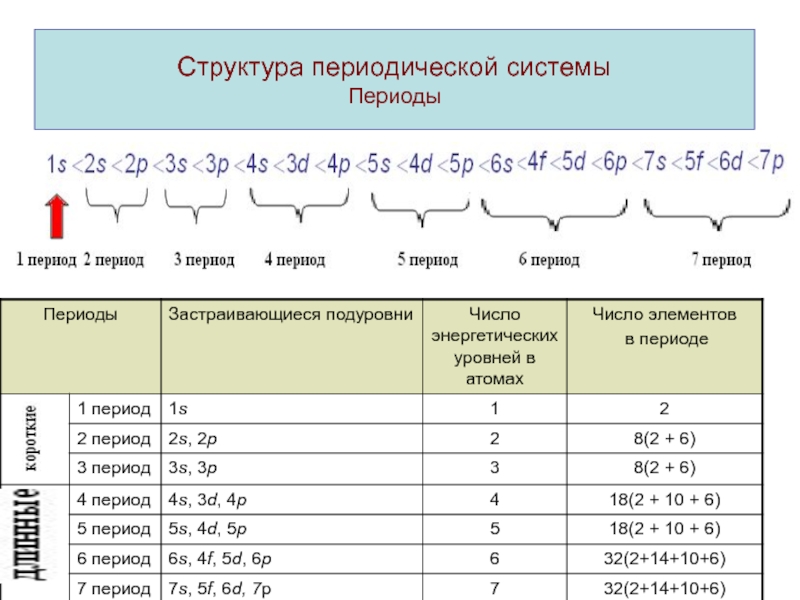
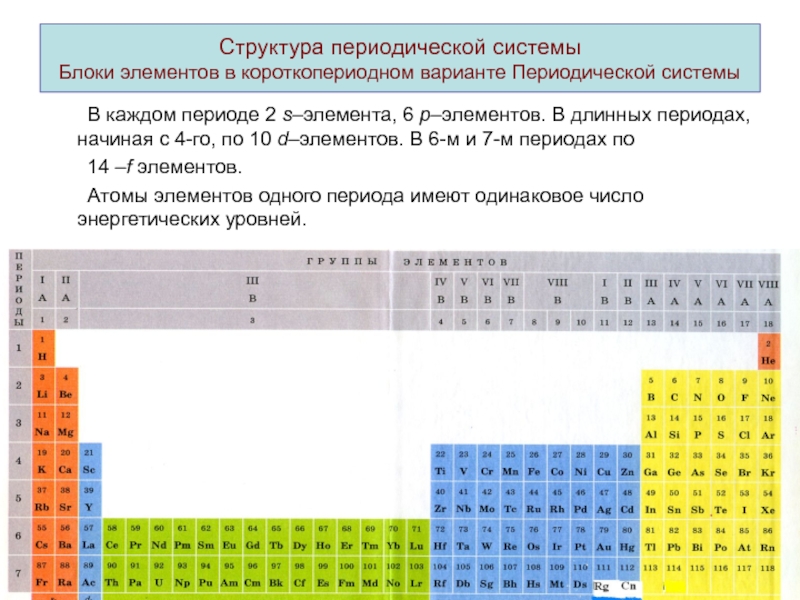
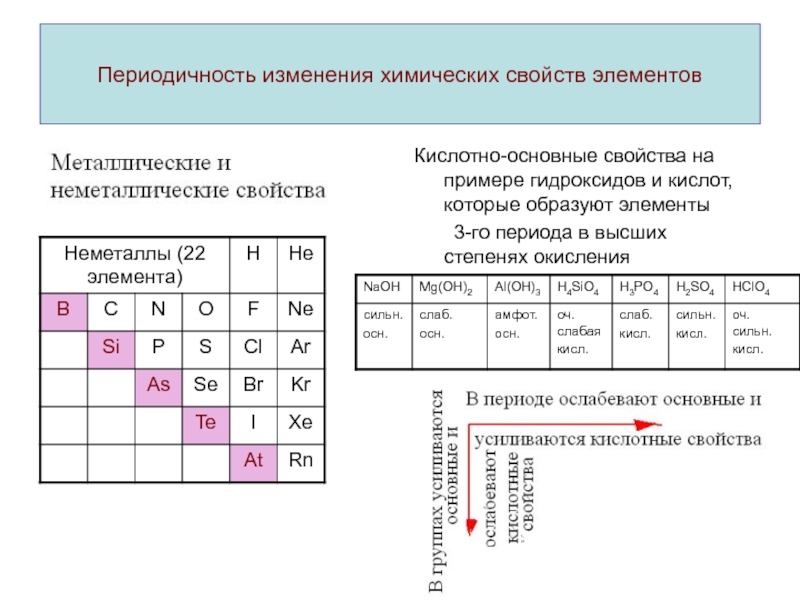
ими простых и
сложных веществ находятся в
периодической зависимости от
заряда
ядра их атомов.Этот закон находит свое отражение в периодической системе химических элементов.