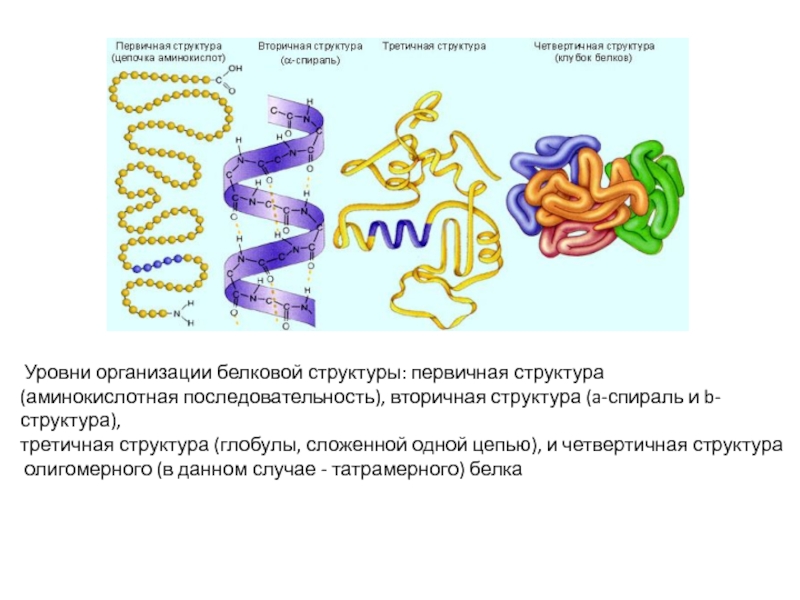
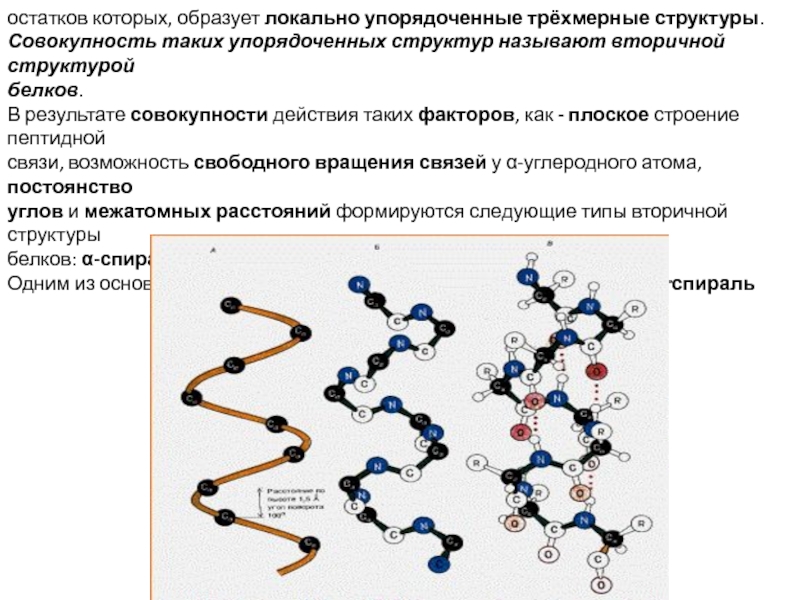
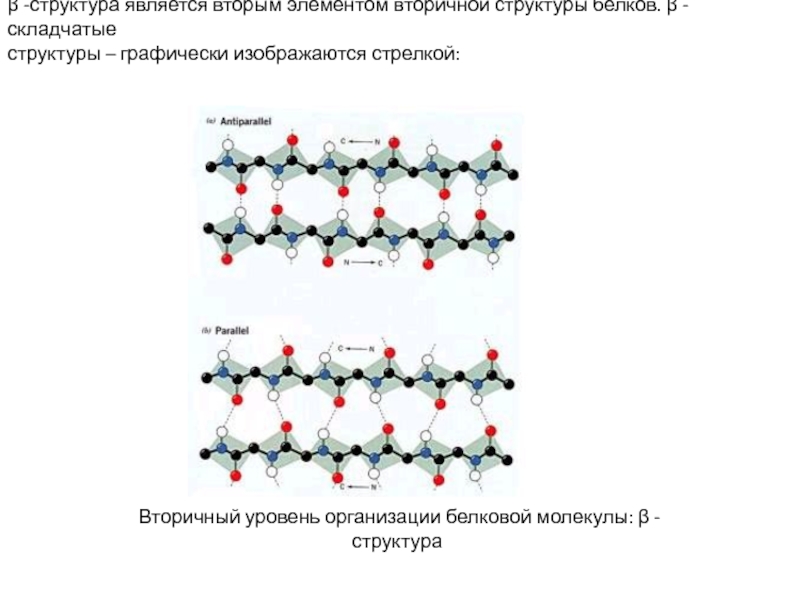
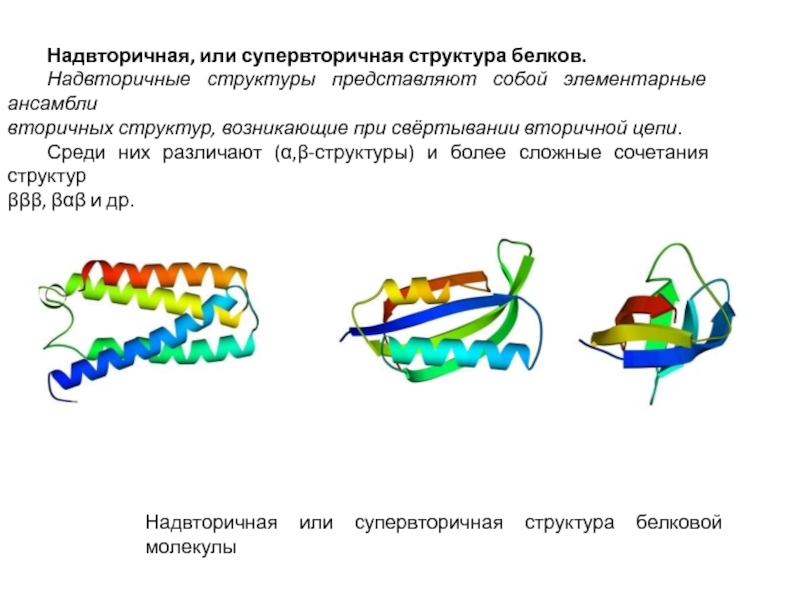
белка. Зависимость биологических свойств белков от первичной структуры. Вторичная и
надвторичная структура белка.Белки играют фундаментальную роль в формировании и поддержании структуры и функций живых организмов.
Белки принимают участие в построении клеток и тканей; осуществляют биологический катализ; регуляторные и сократительные процессы; защиту от внешних воздействий.
Каждый белок характеризуется специфической аминокислотной последовательностью и индивидуальной пространственной структурой (конформацией).
Белками являются полипетиды, которые способны образовывать и самостоятельно стабилизировать свою пространственную структуру. Эта способность приобретается благодаря наличию большого числа нековалентных взаимодействий и связана с числом аминокислотных остатков, образующих полипептидную цепочку. Как правило, белками называют полипетиды, содержащие более 50 аминокислотных остатков.
Вместе с тем, длина полипептидной цепи может достигать до нескольких тысяч остатков
аминокислот; молекулярная масса белков колеблется от 6000 до 1 миллиона и более
килодальтон.