Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Лекция № 1 ТЕМА: ОСНОВНЫЕ ПОНЯТИЯ И ЗАКОНЫ ХИМИИ
Содержание
- 1. Лекция № 1 ТЕМА: ОСНОВНЫЕ ПОНЯТИЯ И ЗАКОНЫ ХИМИИ
- 2. ПЛАН ЛЕКЦИИ:Основные понятия химии2. Основные химические законы
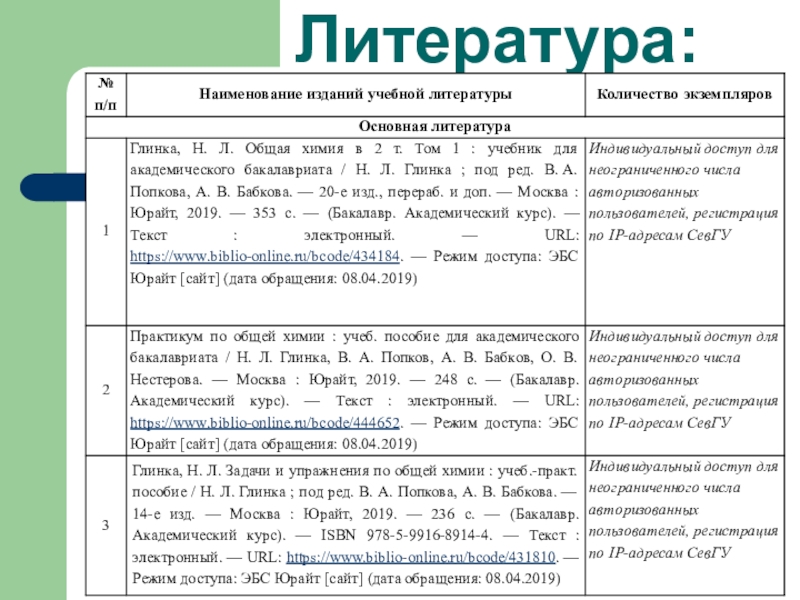
- 3. Литература:
- 4. СТРУКТУРА ДИСЦИПЛИНЫ ХИМИЯВсего 36 аудиторных часовЛ-18, Лз-18, экзамен
- 5. Химия это наука о веществах и их превращениях.1. Введение
- 6. 1. Основные понятия
- 7. Основные понятияМолекула - наименьшая частица вещества, способная к самостоятельному существованию, обладающая его основными химическими свойствами.
- 8. Aтом-это наименьшая частица химического элемента, сохраняющая все
- 9. Количество вещества (n)Количество вещества (n) – это
- 10. Молярная масса (М)Молярная масса (М) – это масса одного моль вещества
- 11. Слайд 11
- 12. Относительная атомная масса (Ar)Относительной атомной массой элемента
- 13. Относительная атомная масса (Ar)Аr показывает, во сколько
- 14. Относительная молекулярная масса (Мr)Относительной молекулярной массой (Мr)
- 15. ПРИМЕР:Относительная молекулярная масса воды будет слагаться из
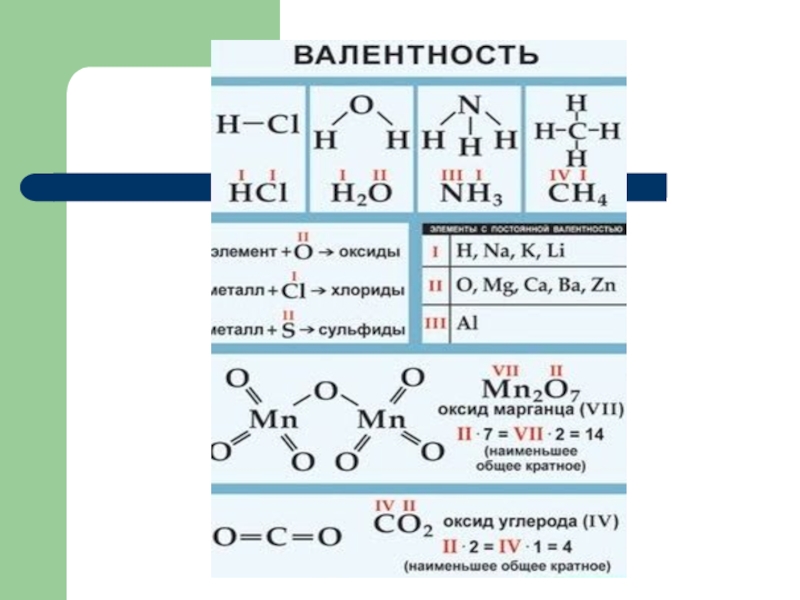
- 16. ВалентностьВалентность- способность атомов элемента присоединять определенное количество атомов другого элемента.Валентность обозначается римскими цифрами.
- 17. Слайд 17
- 18. Эквивалент (Э)Эквивалент (Э) – это реальная или
- 19. Фактор эквивалентности (f э)показывает какая часть молекулы вступает во взаимодействие fэ=эквиваленту
- 20. ПРИМЕР:
- 21. ВАЖНО!Следует различать эквивалентные массы элементов и эквивалентные массы соединений!
- 22. Расчет фактора эквивалентности
- 23. Молярная масса эквивалента (Мэ) –это масса одного моля эквивалентов.Мэ,г/моль
- 24. Эквивалентные массыЭквивалентная масса элемента = А×f(атомная масса
- 25. ПРИМЕРfэ(H3PO4)=1fэ(H3PO4)=1/2fэ(H3PO4)=1/3
- 26. Эквивалентная масса сложного бинарного соединения равна сумме эквивалентных масс образующих его элементов
- 27. ПРИМЕР:
- 28. ПРИМЕР:0,304г магния вытеснили 0,0252 г водорода. Вычислите эквивалентную массу магния.
- 29. Решение:Воспользуемся законом эквивалентов и запишем:
- 30. ПРИМЕРМышьяк образует два оксида, один содержит 65,2%
- 31. Решение:Воспользуемся законом эквивалентов:
- 32. РешениеAsxОy–100%, тогда ω(О)=100% – ω(As)=100% – 65,2%=34,8%Т.к.
- 33. РешениеФормула 1-го оксида имеет вид: As2О5
- 34. РешениеНаходим формулу второго оксида:AsxОy–100%, тогда ω(О)=100% – ω(As)=100% – 75,7%=24,3%
- 35. РешениеФормула 2-го оксида имеет вид: As2О3
- 36. 2.Основные законы химии1. Закон сохранения массы (Ломоносов
- 37. 2. Закон постоянства состава (Пруст 1801-1808):Каждое химически
- 38. ПРИМЕР:
- 39. Закон эквивалентов ( И. В. Рихтера (1792-1800 гг.)Массы реагирующих веществ прямопропорциональны их эквивалентам или их эквивалентным массам
- 40. ГАЗОВЫЕ ЗАКОНЫЗакон Авогадро (1811)В равных объемах различных газов при одинаковых условиях содержится равное число молекул
- 41. 1. Один моль газа при нормальных условиях
- 42. 2. В одном моле газа содержится 6,02×1023
- 43. Следует отметить, что состояние газа определяется температурой,
- 44. Измерения объемов газов обычно проводят при условиях,
- 45. Уравнение объединенного газового закона Гей-Люссака и Бойля-Мариотта
- 46. Уравнение Менделеева - КлапейронаЕсли условия отличаются от
- 47. Р давление газа, V объем,
- 48. ПРИМЕР:Вычислить молярную массу газа если 500мл его
- 49. Решение
- 50. Массы равных объемов двух газов должны относится друг к другу как их молярные массы
- 51. Отношение массы данного газа к массе того
- 52. ПРИМЕР:масса 1 л СО2 равна 1,98 г,
- 53. Молярная масса газа равна его плотности по
- 54. Часто молярную массу газов определяют по водороду или по воздуху:
- 55. Пример Плотность газа по воздуху равна 1,52 определить молярную массу газа.Решение
- 56. Скачать презентанцию
ПЛАН ЛЕКЦИИ:Основные понятия химии2. Основные химические законы
Слайды и текст этой презентации
Слайд 1Лекция № 1
ТЕМА:
ОСНОВНЫЕ ПОНЯТИЯ И ЗАКОНЫ ХИМИИ
Преподаватель: к.т.н., доцент
Ткаченко Элла
Владимировна
Слайд 7Основные понятия
Молекула - наименьшая частица вещества, способная к самостоятельному существованию,
обладающая его основными химическими свойствами.
Слайд 8Aтом-это наименьшая частица химического элемента, сохраняющая все его химические свойства.
Химический
элемент –это вид атомов с одинаковым зарядом ядер,
Основные понятия
Слайд 9Количество вещества (n)
Количество вещества (n) – это величина, содержащая столько
структурных единиц (молекул, атомов, ионов и т.д. ), сколько атомов
содержит в 0,012 кг углерода –12.n=m/M
n=V/Vm
n=N/NA
Слайд 12Относительная атомная масса (Ar)
Относительной атомной массой элемента (Аr) называют отношение
абсолютной массы атома к 1/12 части абсолютной массы атома изотопа
углерода 12С .Слайд 13Относительная атомная масса (Ar)
Аr показывает, во сколько раз масса атома
данного элемента больше 1/12 массы атома 12С .
Слайд 14Относительная молекулярная масса (Мr)
Относительной молекулярной массой (Мr) вещества называется масса
его молекулы, выраженная в а.е.м.
Мr численно равна сумме произведений относительных
атомных масс атомов на их число.Слайд 15ПРИМЕР:
Относительная молекулярная масса воды будет слагаться из
атомных масс двух
атомов водорода
атомной массы одного атома кислорода
Тогда:
Mr(H2O )=2×1+16=18, выраженная
в а.е.м.Слайд 16Валентность
Валентность- способность атомов элемента присоединять определенное количество атомов другого элемента.
Валентность
обозначается римскими цифрами.
Слайд 18Эквивалент (Э)
Эквивалент (Э) – это реальная или условная частица вещества,
которая в кислотно-основной реакции соединяется или замещается с одним атомом
или ионом водорода или в окислительно-восстанови-тельной реакции равноценна одному электронуСлайд 19Фактор эквивалентности
(f э)
показывает какая часть молекулы вступает во взаимодействие
fэ=эквиваленту
Слайд 24Эквивалентные массы
Эквивалентная масса элемента = А×f
(атомная масса × фактор эквивалентности)
Эквивалентная
масса вещества =М×f
(молярная масса × фактор эквивалентности)
Слайд 26Эквивалентная масса сложного бинарного соединения равна сумме эквивалентных масс образующих
его элементов
Слайд 30ПРИМЕР
Мышьяк образует два оксида, один содержит 65,2% As, а дру-гой
- 75,7% As.
Вычислить Мэ мышьяка, его валентность и составить формулы
оксидов. Слайд 32Решение
AsxОy–100%, тогда
ω(О)=100% – ω(As)=100% – 65,2%=34,8%
Т.к. дано бинарное соединение,
то в формулу закона эквивалентов можно подставлять %, получим:
Слайд 34Решение
Находим формулу второго оксида:
AsxОy–100%, тогда
ω(О)=100% – ω(As)=100% – 75,7%=24,3%
Слайд 362.Основные законы химии
1. Закон сохранения массы (Ломоносов М.В. 1756-1759): Масса
веществ, вступающих в реакцию, равна массе веществ, образующихся в результате
реакции.Слайд 372. Закон постоянства состава (Пруст 1801-1808):
Каждое химически чистое соединение, независимо
от метода его получения, обладает определенным весовым составом
Слайд 39Закон эквивалентов
( И. В. Рихтера (1792-1800 гг.)
Массы реагирующих веществ прямопропорциональны их
эквивалентам или их эквивалентным массам
Слайд 40ГАЗОВЫЕ ЗАКОНЫ
Закон Авогадро (1811)
В равных объемах различных газов при одинаковых
условиях содержится равное число молекул
Слайд 411. Один моль газа при нормальных условиях (н.у.) занимает объем
22,4 л
Пример:
1 моль Н2 имеет объем 22,4л
1 моль
O2 имеет объем 22,4л Нормальные условия:
To=273K и Р=101,3 кПа
или 0°С и Р=760 мм. рт. ст.
Следствия
Слайд 422. В одном моле газа содержится 6,02×1023 структурных единиц (атомов,
молекул, ионов и т.д.)
Пример:
1 моль Н2 - 2 г -
6,02×1023 молекул -22,4л 1 моль Cl2 - 70 г - 6,02×1023 молекул -22,4 л
Следствия
Слайд 43Следует отметить, что состояние газа определяется температурой, давлением, объемом.
Принято
обозначать при н.у. P0, V0, T0.
Слайд 44Измерения объемов газов обычно проводят при условиях, отличающихся от нормальных.
Для
приведения объема газа к нормальным условиям можно пользоваться уравнением Клапейрона.
Слайд 46Уравнение Менделеева - Клапейрона
Если условия отличаются от нормальных, мольный объём
имеет другое значение, для расчетов которого можно воспользоваться уравнением Менделеева
Клапейрона:Слайд 47Р давление газа,
V объем,
m масса
газа,
М молярная масса,
Т температура (К),
R
универсальная газовая постоянная Уравнение Менделеева - Клапейрона