Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Лекция № 4
Содержание
- 1. Лекция № 4
- 2. Скорость химической реакцииСкорость химической реакции – это
- 3. Скорость химической реакции Для примера рассмотрим реакцию между
- 4. Скорость химической реакции Если приготовить газовые смеси с
- 5. Средняя скорость химической реакции Если мы знаем концентрацию
- 6. Истинная скорость химической реакции Значение средней скорости зависит
- 7. Механизм реакции Механизм реакции –
- 8. Механизм реакции. Вторая элементарная стадияЗатем быстро образуется промежуточное cоединение
- 9. Механизм реакции. Третья элементарная стадия После
- 10. Механизм реакции. Четвертая элементарная стадия Наконец активированный комплекс очень быстро распадается
- 11. Механизм химической реакции Изучение механизмов химических реакций позволяет
- 12. Закон действующих масс Для любой элементарной стадии справедлив
- 13. Закон действующих масс В общем виде уравнение реакции
- 14. Закон действующих масс Чаще всего элементарная стадия заключается
- 15. Константа скорости химической реакцииВеличина k, входящая в
- 16. Факторы, влияющие на скорость химической реакции 1)
- 17. Влияние температуры При небольшом изменении температуры справедливо правило
- 18. Влияние температуры В широком интервале температур справедливо справедливо
- 19. Энергия активации
- 20. Химическое равновесие Многие химические реакции являются обратимыми. Например,
- 21. Химическое равновесие По мере накопления продукта реакции –
- 22. Химическое равновесие Прямая и обратная реакции в совокупности
- 23. Химическое равновесие В этот момент скорость прямой реакции
- 24. Закон действующих масс для химического равновесия В состоянии
- 25. Закон действующих масс для химического равновесияНапишите выражение ЗДМ для реакции синтеза аммиакаN2 + 3H2⇄2NH3
- 26. Принцип Ле Шателье Если на систему, находящуюся в
- 27. Принцип Ле ШательеИзменение концентрацийУвеличение концентрации хотя бы
- 28. Принцип Ле ШательеИзменение температурыПри повышении температуры равновесие
- 29. Скачать презентанцию
Слайды и текст этой презентации
Слайд 2Скорость химической реакции
Скорость химической реакции – это изменение концентрации реагента
или продукта реакции за единицу времени.
Слайд 3Скорость химической реакции
Для примера рассмотрим реакцию между оксидами углерода(II) СО
и азота(IV) NO2
СO + NO2
CO2 + NOбесцв. бурый бесцв. бесцв.
При комнатной температуре эта реакция не идет.
При температуре 200 ºС интенсивность окраски будет постепенно уменьшаться, по мере расходования NO2.
Чем меньше концентрация диоксида азота в газовой смеси, тем меньше интенсивность окраски.
Диоксид азота – бурый газ
«Лисий хвост» - выброс диоксида азота в промышленности
Диоксид азота – бурый газ
Слайд 4Скорость химической реакции
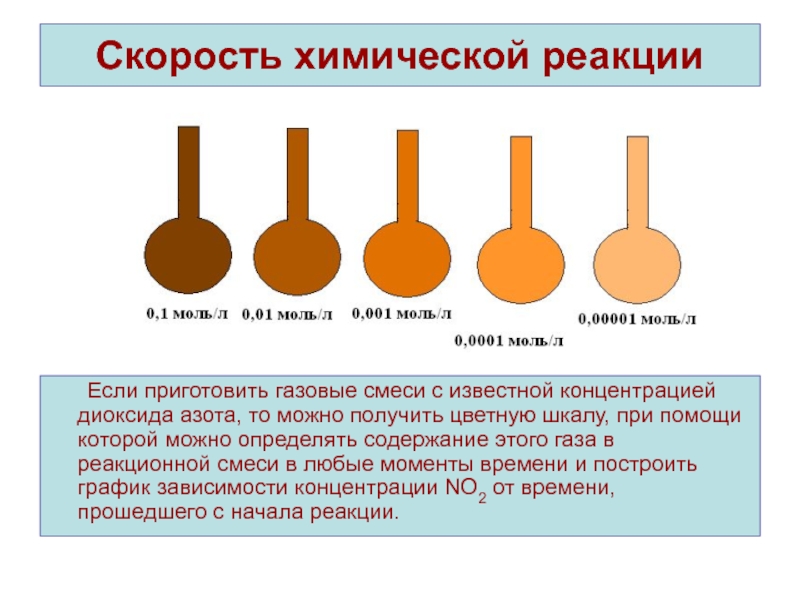
Если приготовить газовые смеси с известной концентрацией диоксида
азота, то можно получить цветную шкалу, при помощи которой можно
определять содержание этого газа в реакционной смеси в любые моменты времени и построить график зависимости концентрации NO2 от времени, прошедшего с начала реакции.Слайд 5Средняя скорость химической реакции
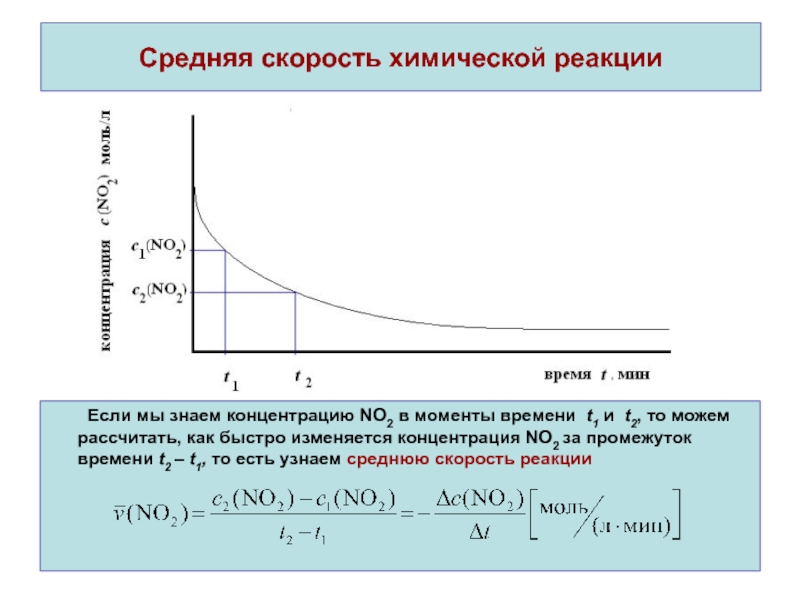
Если мы знаем концентрацию NO2 в моменты
времени t1 и t2, то можем рассчитать, как быстро изменяется
концентрация NO2 за промежуток времени t2 – t1, то есть узнаем среднюю скорость реакцииСлайд 6Истинная скорость химической реакции
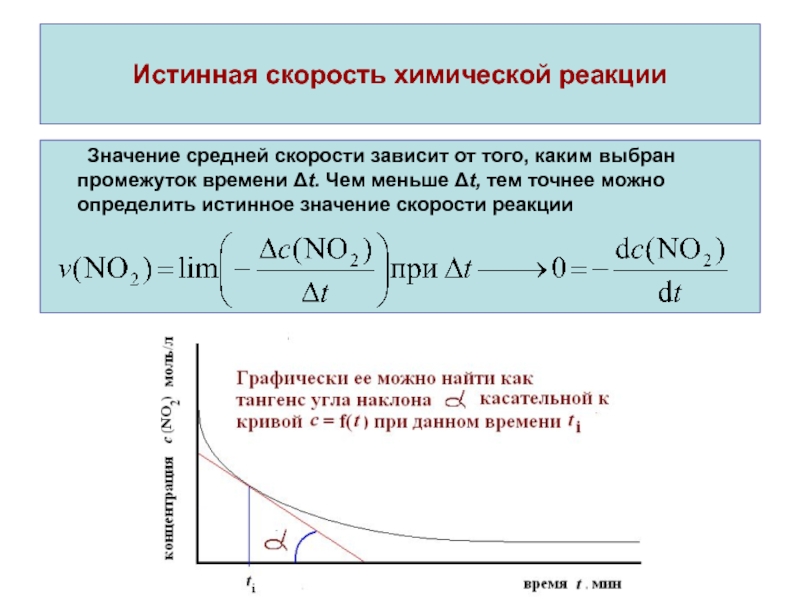
Значение средней скорости зависит от того, каким
выбран промежуток времени Δt. Чем меньше Δt, тем точнее можно
определить истинное значение скорости реакцииСлайд 7
Механизм реакции
Механизм реакции – это полная последовательность всех ее элементарных
стадий.
Уравнение реакции
H2 + I2 ⇄ 2HI
отражает лишь её стехиометрию, но
не её механизм. На самом деле сначала происходит первая элементарная стадия: быстрый распад молекулы иода на атомы
Слайд 9
Механизм реакции.
Третья элементарная стадия
После этого происходит медленная стадия образования активированного
комплекса
+ I
активированный комплекс
Слайд 10Механизм реакции.
Четвертая элементарная стадия
Наконец активированный комплекс очень быстро распадается
Слайд 11Механизм химической реакции
Изучение механизмов химических реакций позволяет найти способы управления
скоростями химических реакций. Например, ускорять промышленные процессы минеральных удобрений и
замедлять нежелательные процессы при хранении сельскохозяйственной продукции Хранение овощей и фруктов, плодов в регулируемой газовой среде (РГС)
Слайд 12Закон действующих масс
Для любой элементарной стадии справедлив закон действующих масс
(сокращенно ЗДМ):
Скорость элементарной стадии реакции прямо пропорциональна произведению концентраций реагентов
в степенях, равных стехиометрическим коэффициентам в уравнении реакции для этой элементарной стадии.Слайд 13Закон действующих масс
В общем виде уравнение реакции для элементарной стадии
можно записать так:
аА + bB Продукты
где –
a и b - стехиометрические коэффициенты; A и B - реагирующие вещества (реагенты).При такой записи уравнения реакции для элементарной стадии ЗДМ для нее можно записать так:
v = kca(A)cb(B)
Слайд 14Закон действующих масс
Чаще всего элементарная стадия заключается во взаимодействии двух
разных или двух одинаковых частиц (молекул, ионов, радикалов). Например, в
медленной стадии реакции синтеза иодоводорода участвуют две разных частицы, уравнение ЗДМ для нее выглядит так:v = kc(H2I)c(I)
Для простой одностадийной реакции взаимодействия двух молекул диоксида азота
2NO2 = N2O4
уравнение ЗДМ выглядит так:
v = kc2(NO2)
Слайд 15Константа скорости химической реакции
Величина k, входящая в уравнение
v =
kca(A)cb(B)
называется константа скорости химической реакции.
Константа скорости равна скорости реакции,
если концентрации всех реагирующих веществ равны между собой и равны 1 моль/л.Слайд 16Факторы, влияющие на скорость химической реакции
1) химическая природа реагентов;
2) концентрация реагентов (см. ЗДМ);
3) температура;
4) наличие катализатора.
Слайд 17Влияние температуры
При небольшом изменении температуры справедливо правило Вант-Гоффа:
При повышении температуры
на каждые 10º скорость реакции увеличивается в 2 - 4
раза.γ – температурный коэффициент (γ = 2 – 4)
Слайд 18Влияние температуры
В широком интервале температур справедливо справедливо уравнение Аррениуса:
k –
константа скорости реакции;
А – множитель, который показывает долю молекул,
имеющих
при столкновении необходимую для протекания реакции взаимную ориентацию;
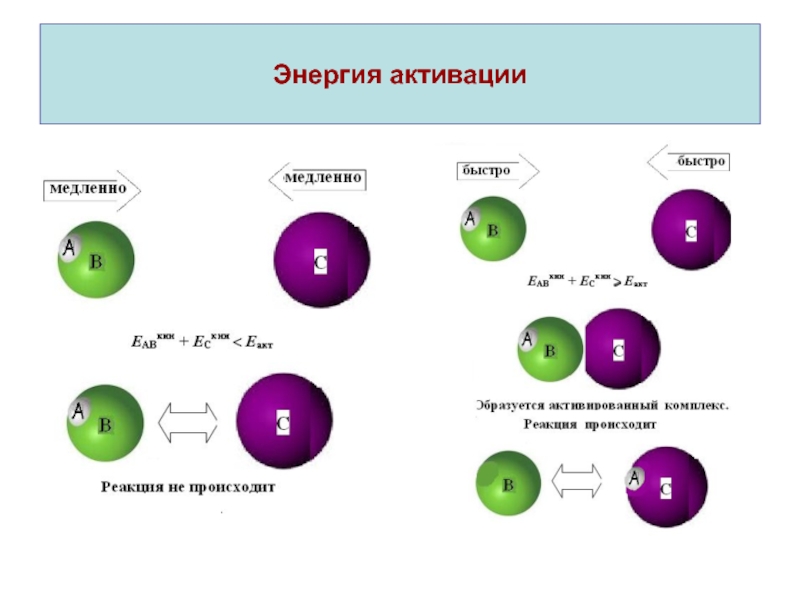
Еакт – энергия активации, соответствующая минимальной энергии
столкновений, которую должны иметь реагирующие
молекулы;
е – основание натурального логарифма;
R – универсальная газовая постоянная;
Т – абсолютная температура.
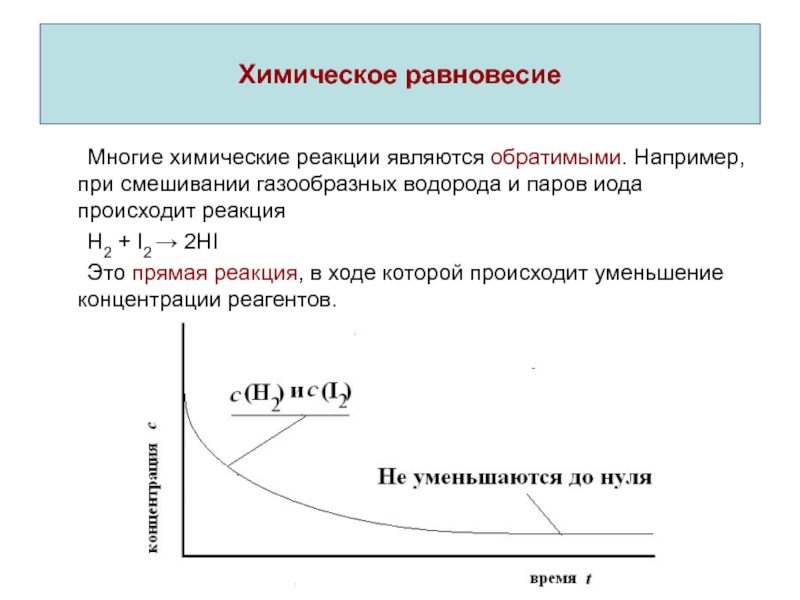
Слайд 20Химическое равновесие
Многие химические реакции являются обратимыми. Например, при смешивании газообразных
водорода и паров иода происходит реакция
H2 + I2 2HI
Это
прямая реакция, в ходе которой происходит уменьшение концентрации реагентов.Слайд 21Химическое равновесие
По мере накопления продукта реакции – иодоводорода HI –
он начинает разлагаться
2HI H2 + I2
Это обратная реакция.
Слайд 22Химическое равновесие
Прямая и обратная реакции в совокупности образуют обратимую реакцию
H2
+ I2 ⇄ 2HI
⇄ - знак обратимости реакции.
Прямая и обратная
реакции продолжаются неограниченно долго. Однако наступает момент, когда прекращаются все видимые изменения.Слайд 23Химическое равновесие
В этот момент скорость прямой реакции становится равной скорости
обратной реакции. Химическое равновесие является динамическим.
Система достигает состояния химического равновесия.
В равновесии концентрации всех веществ в реакционной смеси остаются постоянными. Эти концентрации называют равновесными и часто обозначают химическими формулами веществ, взятыми в квадратные скобки. Например:[H2], [I2], [HI]
Слайд 24Закон действующих масс для химического равновесия
В состоянии равновесия отношение (--)
произведения () концентраций продуктов реакции, взятых в степенях, равных их
стехиометрическим коэффициентам, к произведению () концентраций реагентов, также взятых в степенях, равных их стехиометрическим коэффициентам, является постоянной величиной, которая называется константа равновесия.Например, для реакции синтеза иодоводорода
H2 + I2 ⇄ 2HI
Слайд 25Закон действующих масс для химического равновесия
Напишите выражение ЗДМ для реакции
синтеза аммиака
N2 + 3H2⇄2NH3
Слайд 26Принцип Ле Шателье
Если на систему, находящуюся в состоянии равновесия, произвести
внешнее воздействие, то равновесие смещается в сторону той из двух
противоположных реакций, которая ослабляет это воздействие. Анри Луи Ле Шателье
(Henri-Louis Le Châtelier)
Слайд 27Принцип Ле Шателье
Изменение концентраций
Увеличение концентрации хотя бы одного из реагентов
приводит к смещению равновесия в сторону образования продуктов, а при
добавлении продуктов равновесие смещается в сторону реагентов. Например, если увеличить концентрацию водорода в системеH2 + I2 ⇄ 2HI
то равновесие сместится ?
вправо, в сторону продуктов
Изменение давления
При увеличении давления равновесие смещается в сторону той реакции, которая приводит к уменьшению количества вещества.
Например, в системе
2NO2 ⇄N2O4
при повышении давления равновесие сместится?
Вправо, в сторону продуктов
При изменении концентраций и давления константа равновесия не изменяется
Слайд 28Принцип Ле Шателье
Изменение температуры
При повышении температуры равновесие смещается в сторону
эндотермической реакции (ΔHреакции 0), при понижении температуры – в
сторону экзотермической реакции (ΔHреакции 0). Например, при повышении температуры в системеN2 + 3H2 ⇄ 2NH3; ΔHреакции = - 92,4 кДж
равновесие смещается?
влево, в сторону реагентов.
Константа равновесия зависит от температуры.
(НЕ) Влияние катализатора
В обратимой реакции катализатор в равной мере увеличивает скорость и прямой и обратной реакций и не оказывает влияния на положение равновесия и константу равновесия.