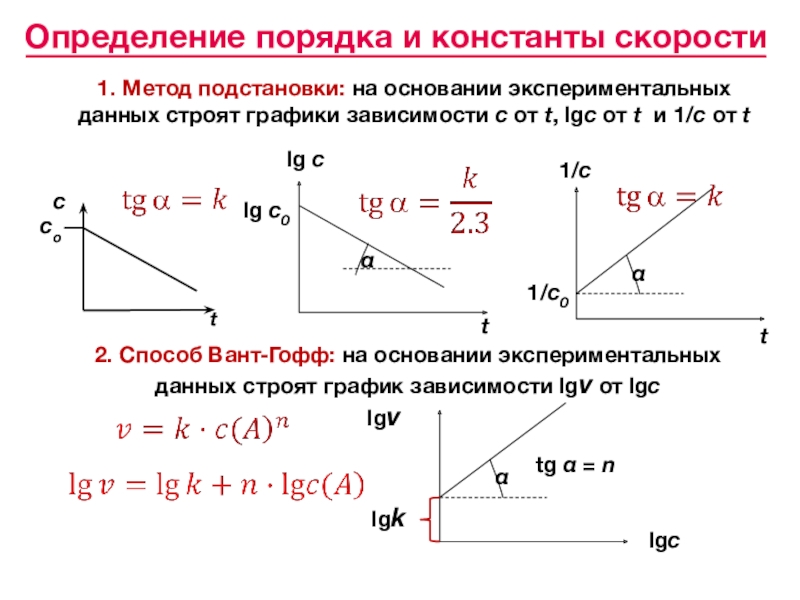
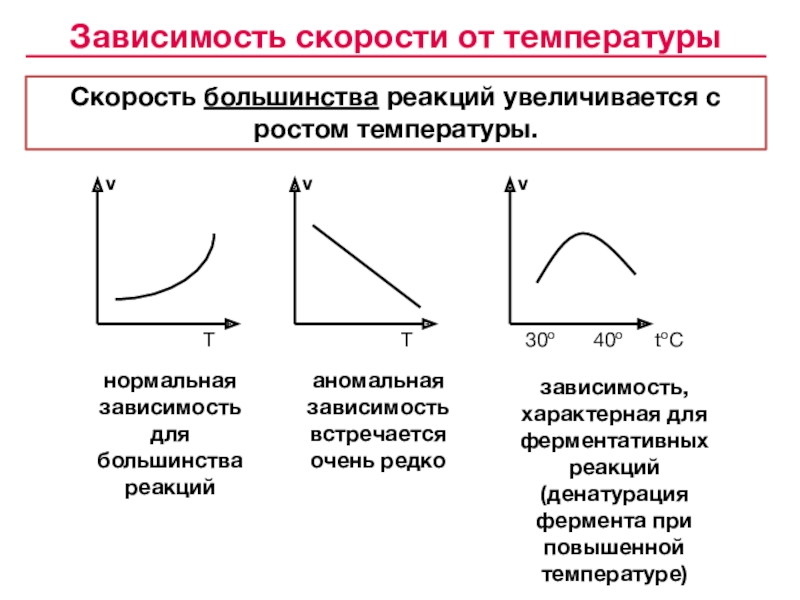
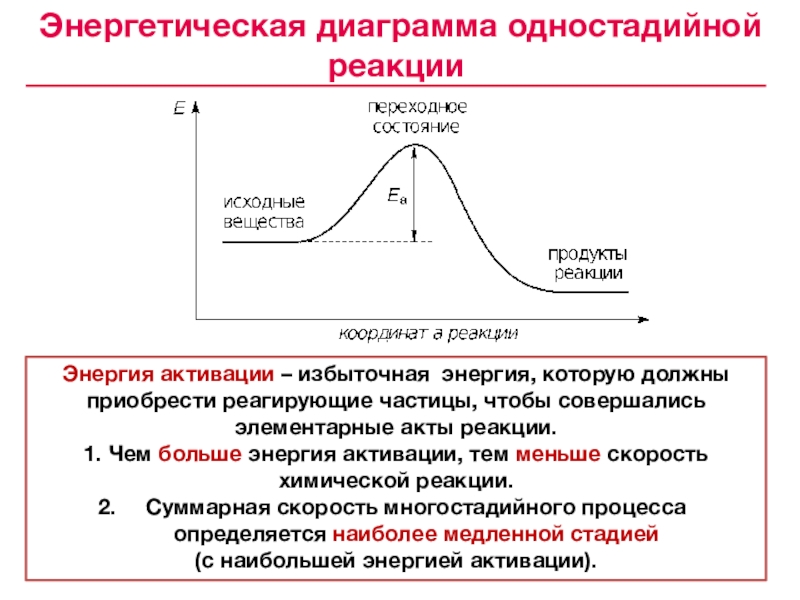
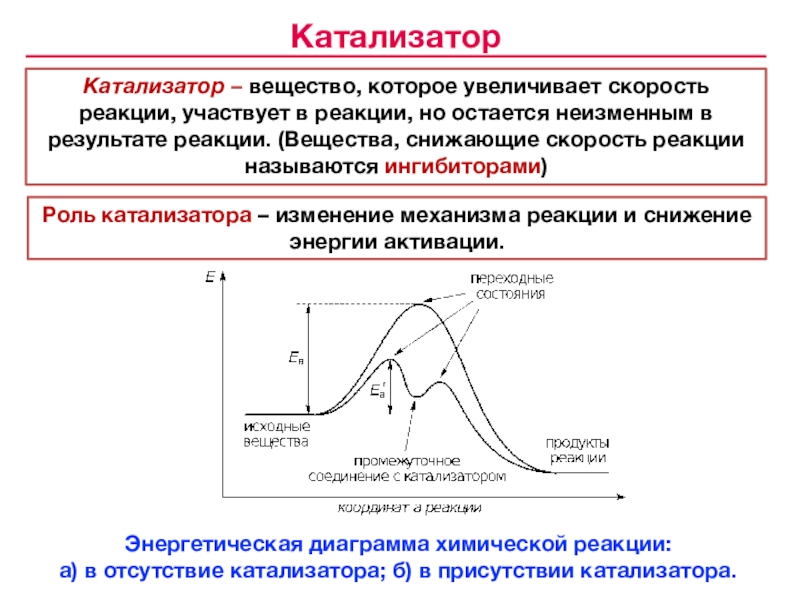
«Всякая система, находящаяся в устойчивом химическом равновесии, будучи подвержена влиянию
внешнего воздействия, которое направлено на изменение ее температуры или конденсации (давления, концентрации, числа молекул в единице объема), оказываемого повсеместно либо только в некоторых ее частях, способна подвергаться лишь таким внутренним изменениям, которые, если они осуществляются самопроизвольно, должны привести к изменению температуры либо концентрации в направлении, противоположном тем, которые происходят в результате внешнего воздействия»
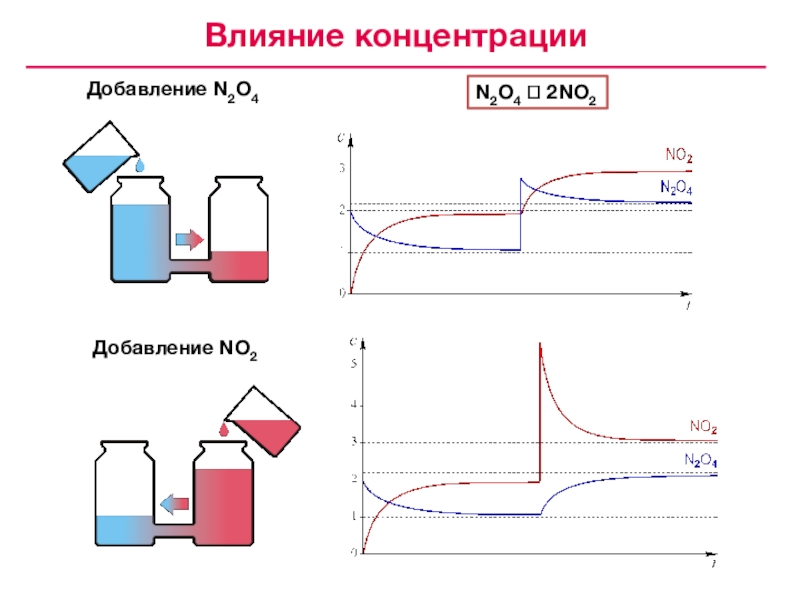
Принцип Ле Шателье – если на систему, находящуюся в состоянии химического равновесия, оказывается внешнее воздействие, положение равновесия смещается в такую сторону, чтобы противодействовать эффекту этого воздействия
Принцип Ле Шателье – Брауна





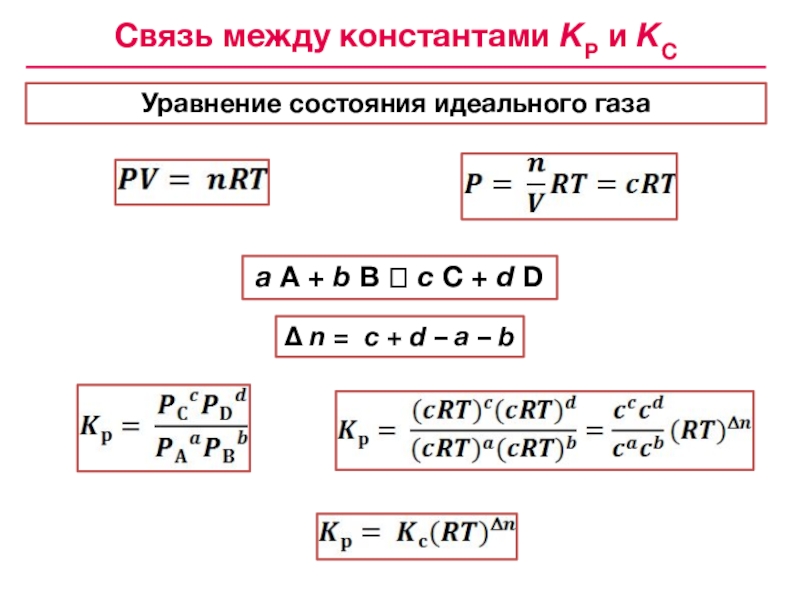

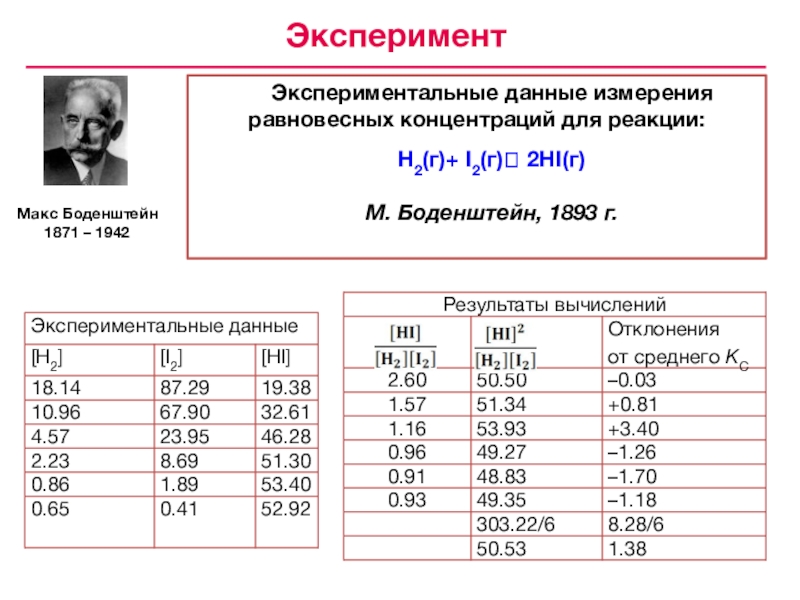





![Лекция № 4 Химическое равновесие. Химическая кинетика [HI]2 = 50.53 • 10–6[HI] = 7.1 • 10–3 моль/лВычисление концентраций [HI]2 = 50.53 • 10–6[HI] = 7.1 • 10–3 моль/лВычисление концентраций реагентов и продуктов в условиях равновесияH2](/img/tmb/7/643798/05c28b28fc33b59231c5eb1d56a89940-800x.jpg)











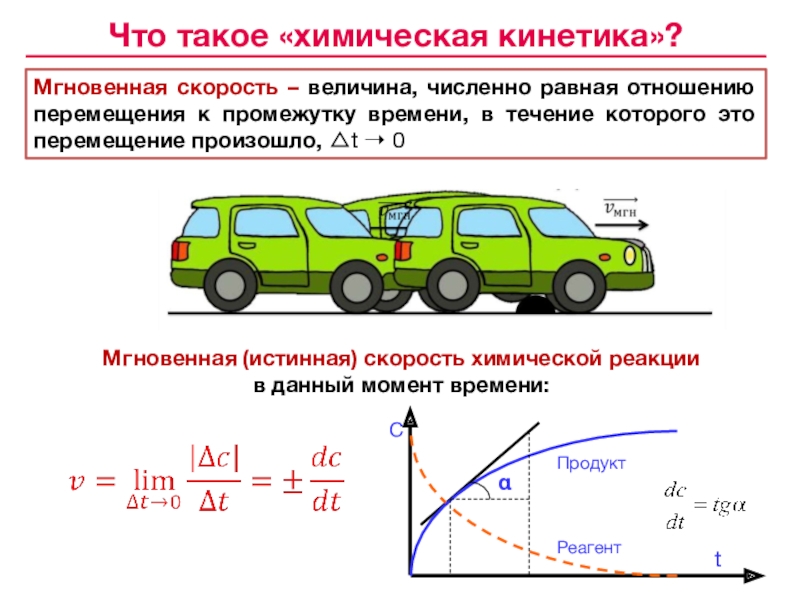


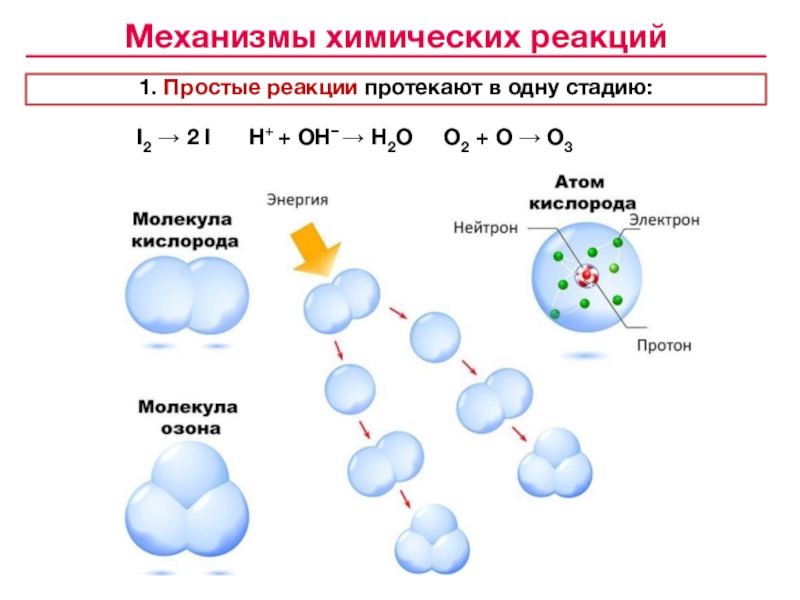
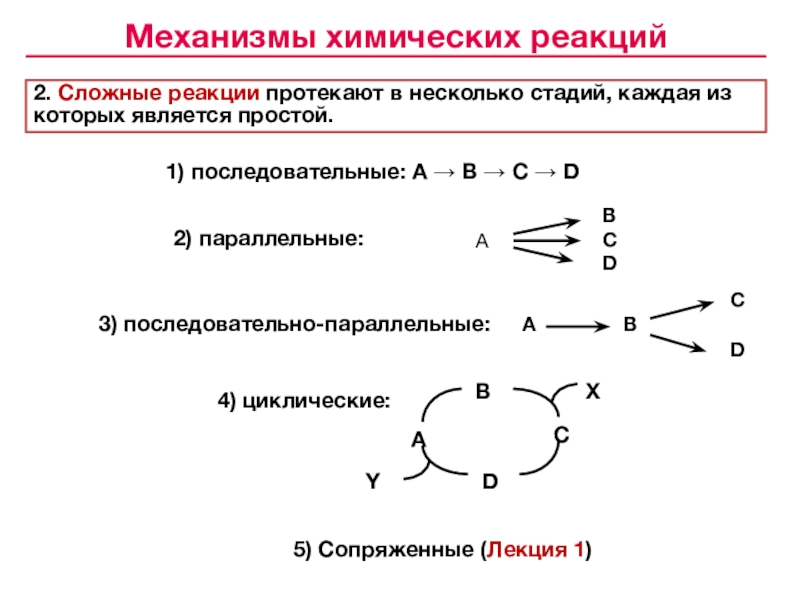
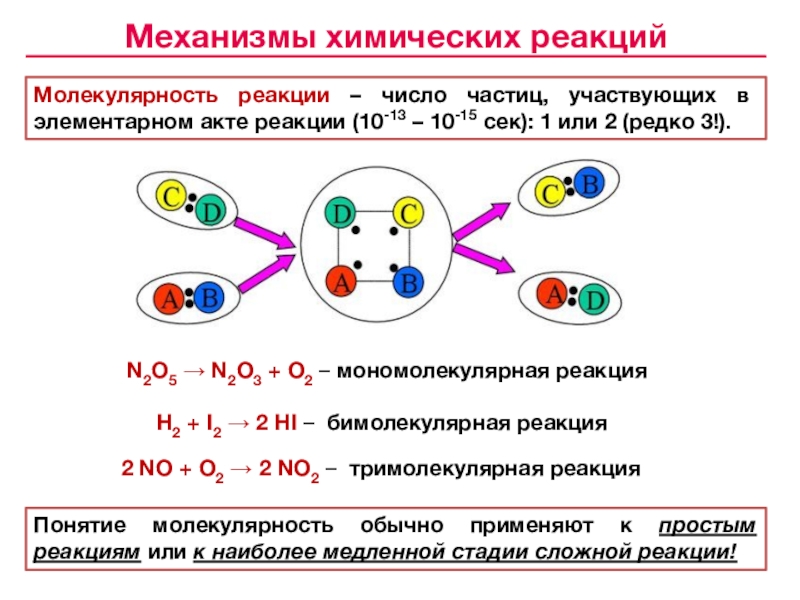
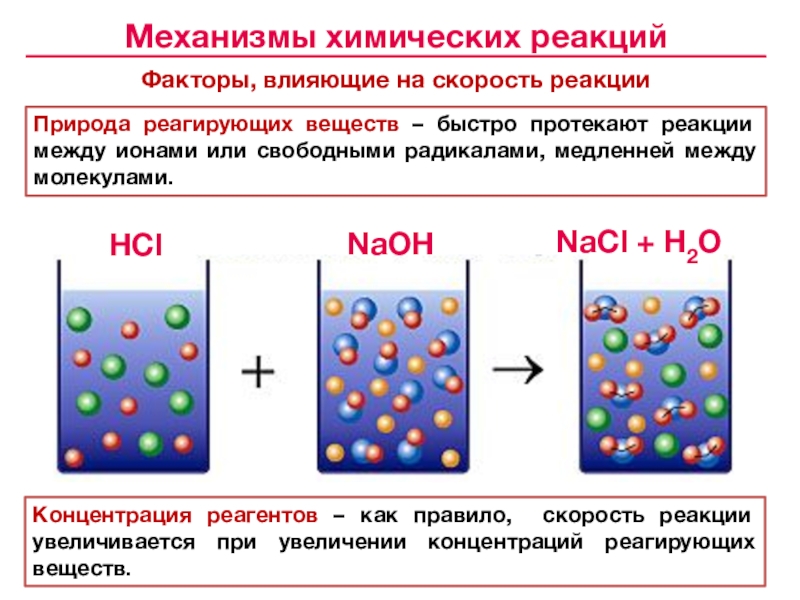

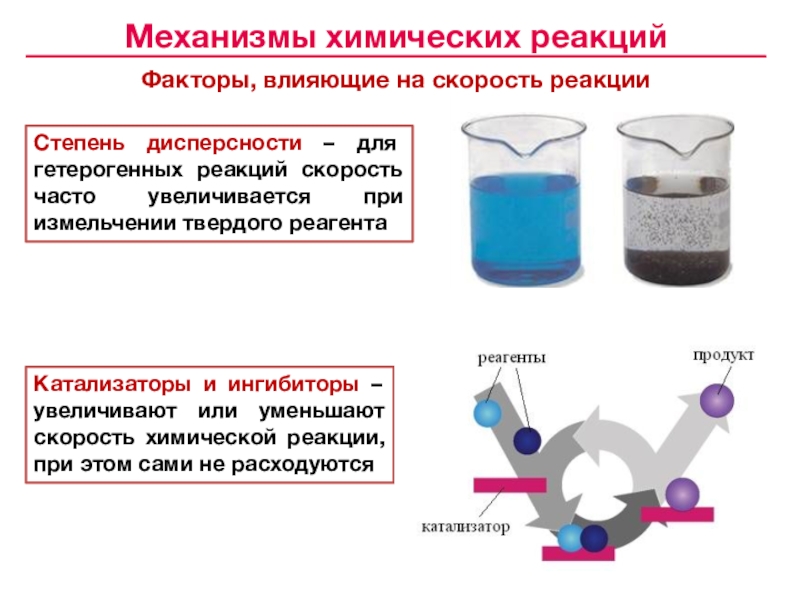




![Лекция № 4 Химическое равновесие. Химическая кинетика Реакции первого порядка:кинетические уравнения:размерность k [c– 1]с с0 t1/2 Реакции первого порядка:кинетические уравнения:размерность k [c– 1]с с0 t1/2 tс0 /2 αtlg сПервого](/img/tmb/7/643798/c74202c606ce3f52617f784aef433aea-800x.jpg)

![Лекция № 4 Химическое равновесие. Химическая кинетика Реакции второго порядка:кинетические уравнения:размерность k: [л/(моль·с)] αt1/с1/с0Время полупревращения или Реакции второго порядка:кинетические уравнения:размерность k: [л/(моль·с)] αt1/с1/с0Время полупревращения или](/img/tmb/7/643798/c72262ddc400038b48ed25902378883b-800x.jpg)