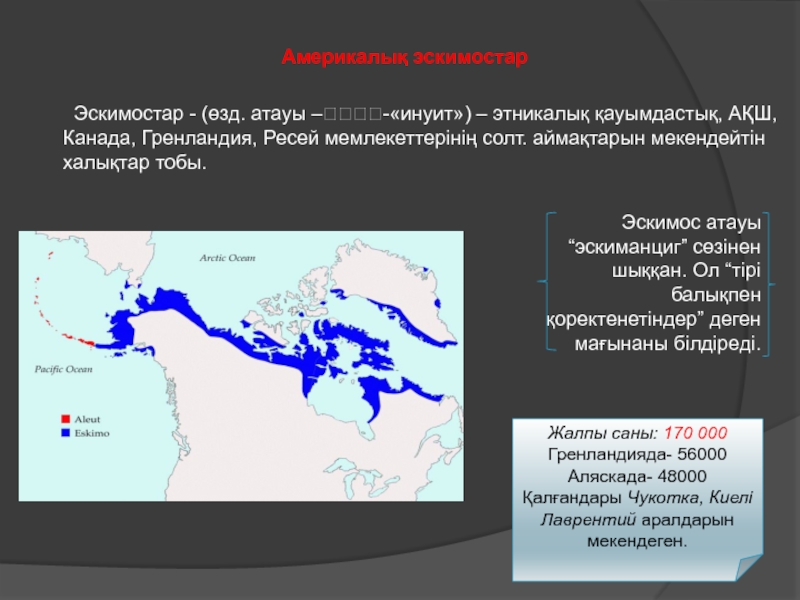
Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Лекция №15 по химии
Содержание
- 1. Лекция №15 по химии
- 2. План лекцииХром. Строение атома. Кислотно-основные свойства.Амфотерность Cr(OH)3.Окислительно-восстановительные
- 3. Хром. Строение атома. Степени окисления. Кислотно-основные свойства0
- 4. Окислительно-восстановительные свойства соединений хромаХромиты чаще всего –
- 5. Амфотерность гидроксида хрома (III). Хромиты. Их восстановительные
- 6. Хромовая и дихромовая кислоты. Их соли. Роль
- 7. Переход хромат - иона в дихромат-ион
- 8. Биологическое значение хрома и марганцаСоединения хрома (YI)
- 9. Скачать презентанцию
План лекцииХром. Строение атома. Кислотно-основные свойства.Амфотерность Cr(OH)3.Окислительно-восстановительные свойства соединений хрома.Хромовая и дихромовая кислоты. Их соли. Роль в ОВР.Переход хромат - иона в дихромат-ион и обратно.
Слайды и текст этой презентации
Слайд 2План лекции
Хром. Строение атома. Кислотно-основные свойства.
Амфотерность Cr(OH)3.
Окислительно-восстановительные свойства соединений хрома.
Хромовая
и дихромовая кислоты. Их соли. Роль в ОВР.
иона в дихромат-ион и обратно.Слайд 3Хром. Строение атома. Степени окисления. Кислотно-основные свойства
0
+2
+3 +6Cr CrO осн. окс. Cr2O3 амф.окс. CrO3 кисл.окс.
Cr(OH)2 Cr(OH)3 H2CrO4
H3CrO3 H2Cr2O7
слаб. осн. амф. гидр. кис. ср. силы
Вывод: кислотно - основной характер оксидов и гидроксидов хрома меняется с увеличением степени окисления: основные свойства ослабевают и через амфотерные переходят в кислотные .
Слайд 4Окислительно-восстановительные свойства соединений хрома
Хромиты чаще всего – восстановители:
+ ок-ль + OH-
Хроматы
и дихроматы – только окислители:+ вос-ль + H+ соли Cr3+
Слайд 5Амфотерность гидроксида хрома (III). Хромиты. Их восстановительные свойства.
Сr(OH)3 +3 HCl→
CrCl3 + 3 H2O
Сr(OH)3 +3 H+
→ Cr 3+ + 3 H2O Сr(OH)3 +3 KOH→ K3CrO3 + 3 H2O
Сr(OH)3 +3 ОН- → CrO3 3- + 3 H2O
В ОВР хромиты обладают ОВД,
но чаще они – восстановители:
KCrO2 + Br2 + KOH → K2CrO4 + KBr +H2O
вос-ль о-ль щел. ср.
Слайд 6Хромовая и дихромовая кислоты. Их соли. Роль в ОВР.
Н2СrO4 –хромовая
кислота
К2СrO4 -хромат калия
Н2Сr2О7 – дихромовая кислота
К2Сr2О7 –дихромат калия.
В ОВР
хроматы и дихроматы только окислители:К2Сr2O7 + HCl →CrCl3 +Cl2 +KCl +H2O
Слайд 7Переход хромат - иона в
дихромат-ион и обратно.
2К2CrO4 + H2SO4
→K2Cr2O7 + K2SO4 +H2O
2CrO4 2- + 2H
+ → Cr2O7 2- + H2O Вывод: в кислой среде устойчив только дихромат-ион Cr2O7 2- .
К2Cr2O7 + 2KOH → 2К2CrO4 +H2O
Cr2O7 2-+ 2OH - → 2CrO4 2- +H2O
Вывод: в щелочной среде устойчив только хромат-ион CrO4 2-.