Слайд 1Лекция №3
«Химическая связь»
Составил:
Ташкинов Ю.А.
Макеевка, 2019
ГОУ ВПО «Донбасская Национальная академия строительства
и архитектуры»,
кафедра «Прикладная химия»
Курс лекций по дисциплине «Химия»
для студентов
1 курса
Направление подготовки – 23.03.03 «Эксплуатация
транспортно-технологических машин и комплексов»
Слайд 2План занятия
Характеристики химических связей
Типы химических связей
Методы описания химической связи
Гибридизация атомных
орбиталей. Пространственная форма молекулы
Слайд 3Фундаментальной основой химической связи явилась теория химического строения А.М. Бутлерова
(1861 г.): свойства соединений зависят от природы и числа составляющих
их частиц и химического строения.
Под химической связью понимаются различные виды взаимодействий, обуславливающие устойчивое существование двух- и многоатомных соединений: молекул, ионов, кристаллических и иных веществ.
Учение о химической связи - основа теоретической химии.
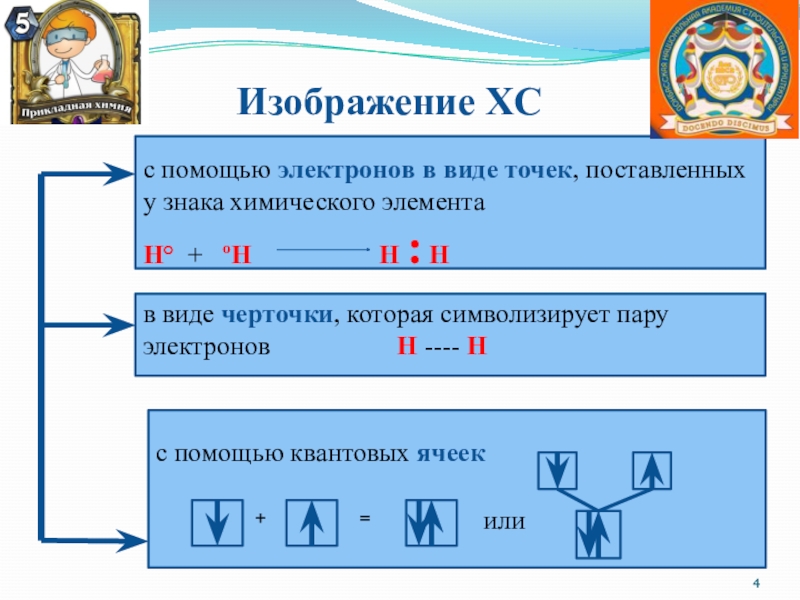
Слайд 4 Изображение ХС
с помощью электронов
в виде точек, поставленных у знака химического элемента
Н° +
ºН Н : Н
в виде черточки, которая символизирует пару электронов Н ---- Н
с помощью квантовых ячеек
+
=
или
Слайд 5Валентность – способность атомов одного элемента соединяться с определенным количеством
атомов другого элемента (для количественного определения за единицу приняли валентность
водорода).
Степень окисления – это условный электрический заряд, который имел бы атом, если бы все валентные электроны в молекуле перешли бы к более электроотрицательному атому, а электронные пары, принадлежащие одинаковым атомам, были бы поделены между ними.
Слайд 6 К основным чертам химической связи можно отнести:
а) снижение общей энергии
двух- или многоатомной системы по сравнению с суммарной энергией изолированных
частиц, из которых эта система образована;
б) перераспределение электронной плотности в области химической связи по сравнению с простым наложением электронных плотностей несвязанных атомов, сближенных на расстояние связи.
По своей природе химическая связь представляет собой взаимодействие между положительно заряженными ядрами и отрицательно заряженными электронами, а так же электронов друг с другом.
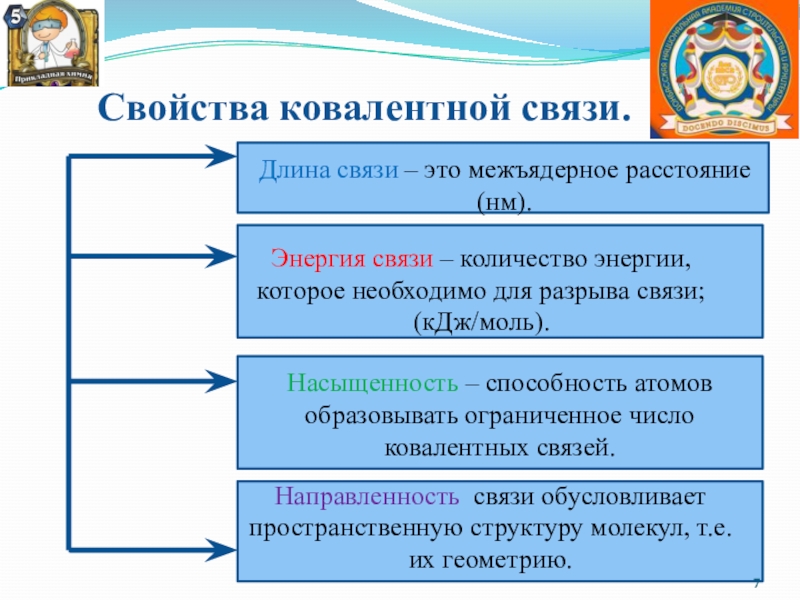
Слайд 7 Свойства ковалентной связи.
Длина связи – это межъядерное расстояние
(нм).
Энергия связи –
количество энергии, которое необходимо для разрыва связи; (кДж/моль).
Насыщенность – способность атомов образовывать ограниченное число ковалентных связей.
Направленность связи обусловливает пространственную структуру молекул, т.е. их геометрию.
Слайд 8 Длина химической связи (l св) - расстояние между ядрами
атомов в соед-ях
В однотипных соед-ях длина связи закономерно
изменяется:
HF – HCl – HBr – HI
длина связи возрастает
Характеристики ХС
Слайд 9Энергия связи (Есв) – это энергия, выделяющаяся при образовании хим.
связи или расходуемая на её разрыв
Взаимосвязь Есв и lсв:
Молекула
HF HCl HBr HI
lсв, нм 0,092 0,128 0,142 0,162
Есв 566 432 366 298
кДж/моль
Слайд 10Валентный угол образован воображаемыми линиями, соединяющими центры взаимодействующих атомов
O
Cl — Be — Cl
H H
α = 180O α = 104,5O
Слайд 11Дипольный момент – колич-ная характеристика полярности связи (измеряется в дебаях)
μ = qlдип
q– заряд полюса [Кл]
lдип – длина диполя [м]
Дебай
(D):1D = 3,33.10-3 Клм
[Клм ]
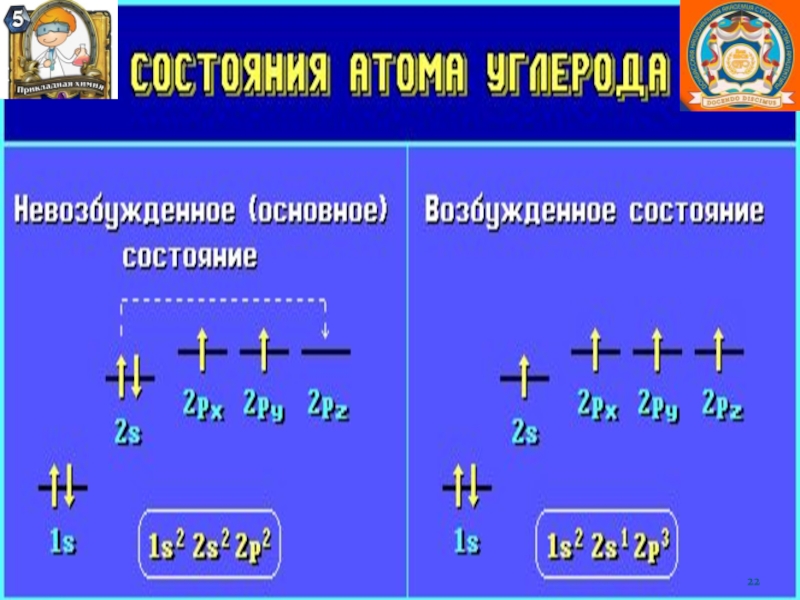
Слайд 12Правило октета. В результате образования химической связи атомы могут приобретать
такую же электронную конфигурацию, как у благородных газов, которые (за
исключением гелия) имеют на внешней оболочке восемь (октет) электронов. Стремление к созданию такой устойчивой электронной конфигурации получило название правило октета. Это справедливо как для ионной, так и ковалентной связей.
Слайд 14Типы ХС
Δ χ=0 эВ – неполярная связь КНПС
Δ χ
– малополярная КС (МКПС)
Δ χ≈0,5÷1,0 эВ – среднеполярная срПКС
Δ χ≈1,0÷2,0
эВ – сильнополярная СКПС
Δ χ>2,0 эВ – ионная связь
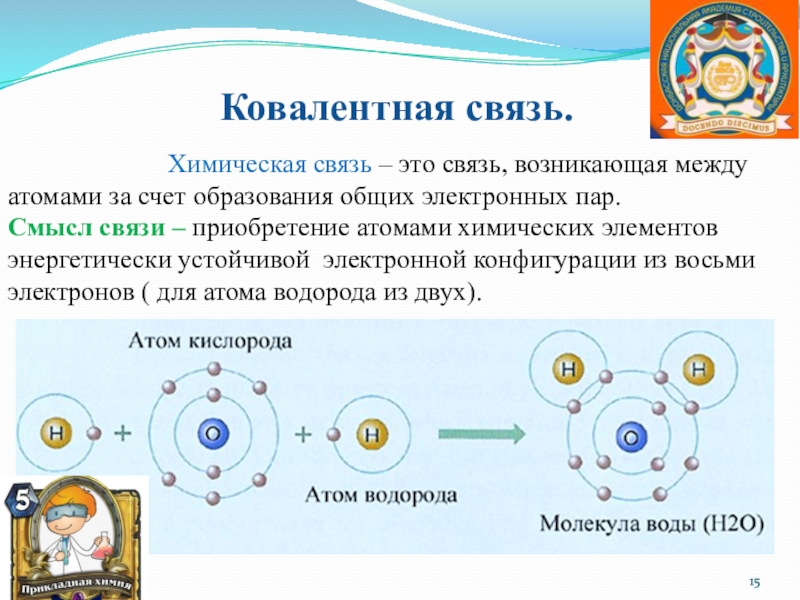
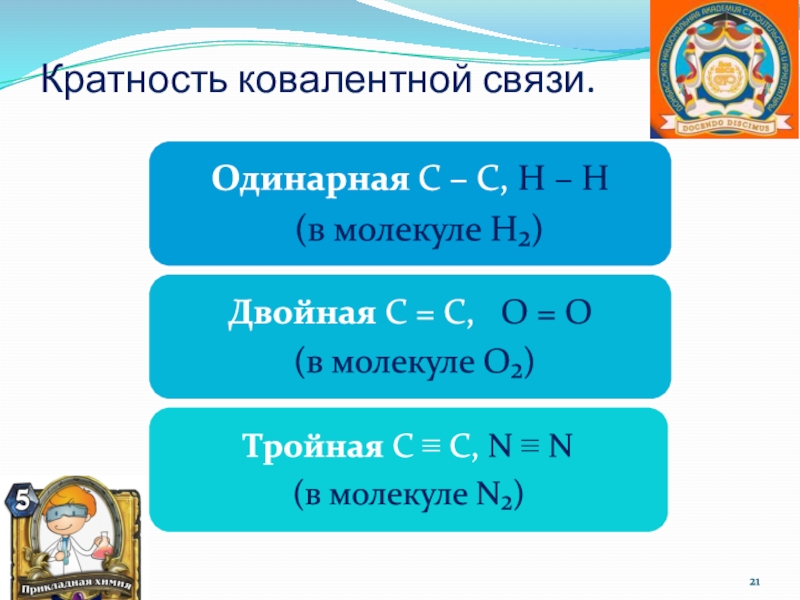
Слайд 15 Ковалентная связь.
Химическая связь – это связь, возникающая между атомами за счет образования общих электронных пар.
Смысл связи – приобретение атомами химических элементов энергетически устойчивой электронной конфигурации из восьми электронов ( для атома водорода из двух).
ковалентной связи.
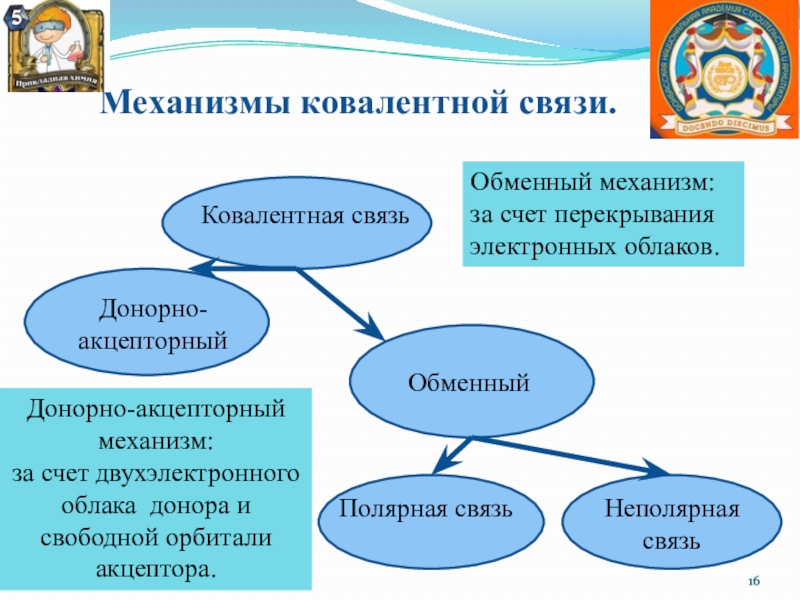
Ковалентная связь
Донорно-акцепторный
Обменный
Полярная связь
Неполярная связь
Обменный механизм:
за счет перекрывания электронных
облаков.
Донорно-акцепторный механизм:
за счет двухэлектронного облака донора и свободной орбитали акцептора.
Слайд 17Если в атоме больше свободных валентных электронов, чем 1, то
такие образования – σ-связи, остальные облака перекрываются вне
линии связи, но в плоскостях, проходящих через линию связи
Способы перекрывания электронных облаков.
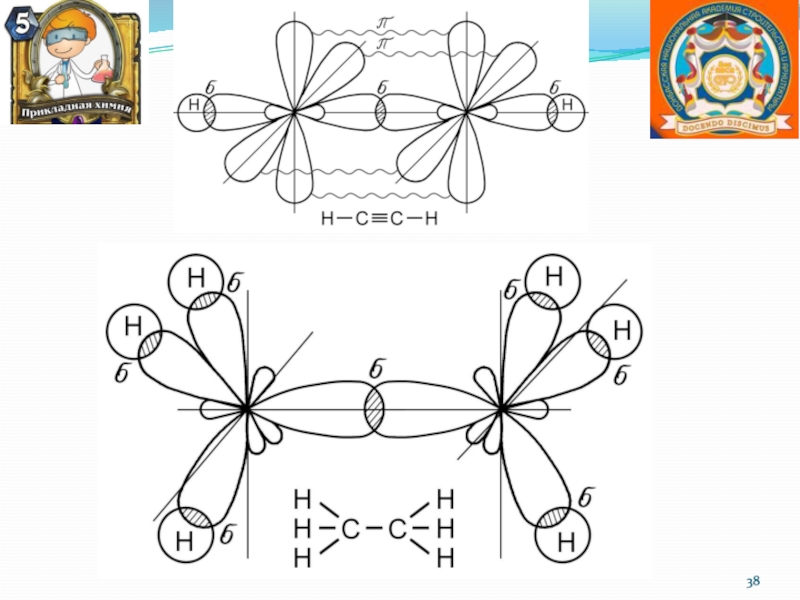
σ– связь – перекрывание электронных облаков вдоль оси, соединяющей центры атомов.
π – связь, возникающая между атомами, когда перекрывание электронных облаков происходит по обе стороны от линии, соединяющей ядра обоих атомов.
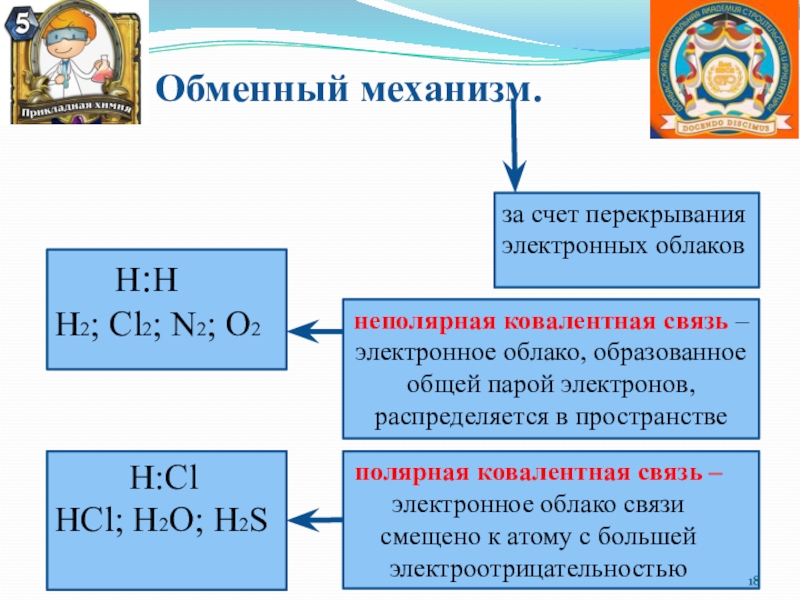
Слайд 18 Обменный механизм.
за счет перекрывания электронных
облаков
Н:Н
Н2; Cl2; N2; O2
неполярная ковалентная
связь – электронное облако, образованное общей парой электронов, распределяется в пространстве
Н:Cl
HCl; H2O; H2S
полярная ковалентная связь – электронное облако связи смещено к атому с большей электроотрицательностью
Слайд 20Свойства ковалентной связи
Насыщаемость –это способность атомов участвовать в образовании ограниченного
числа ковалентных связей.
Направленность –взаимная ориентация электронных облаков.
Поляризуемость –определяется величиной электроотрицательности
атомов
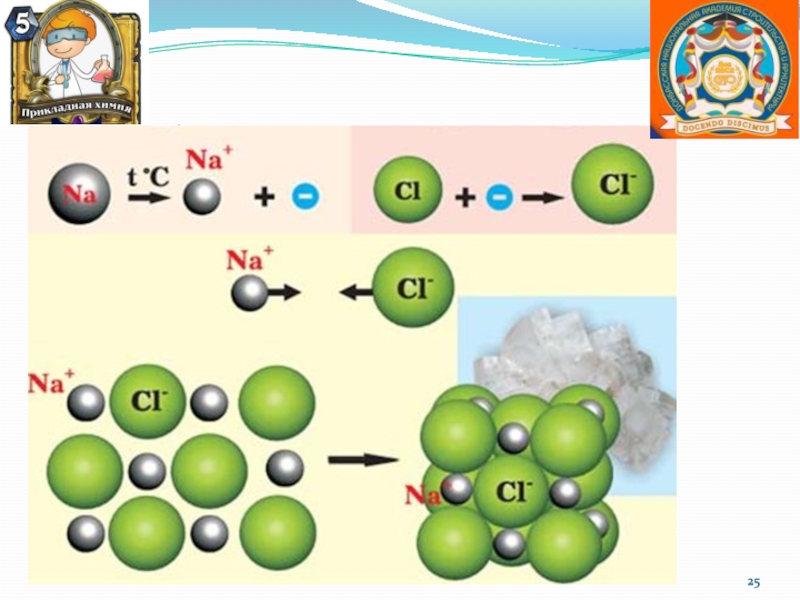
Слайд 23Ионная химическая связь
Ионная или электровалентная связь – химическая связь между
ионами, осуществляемая электростатическим притяжением.
Образуется между атомами, которые сильно различаются по
электроотрицательности.
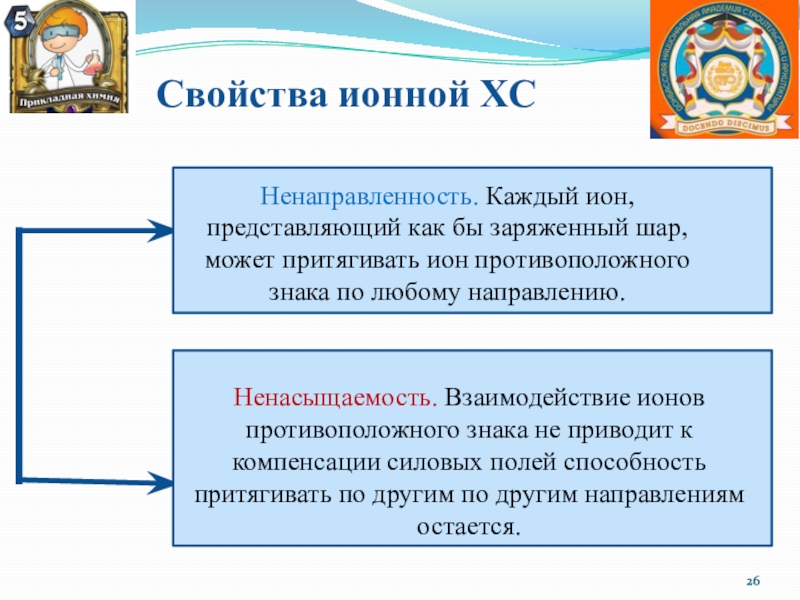
Слайд 26Свойства ионной ХС
Ненаправленность. Каждый ион, представляющий как бы заряженный шар,
может притягивать ион противоположного знака по любому направлению.
Ненасыщаемость. Взаимодействие ионов
противоположного знака не приводит к компенсации силовых полей способность притягивать по другим по другим направлениям остается.
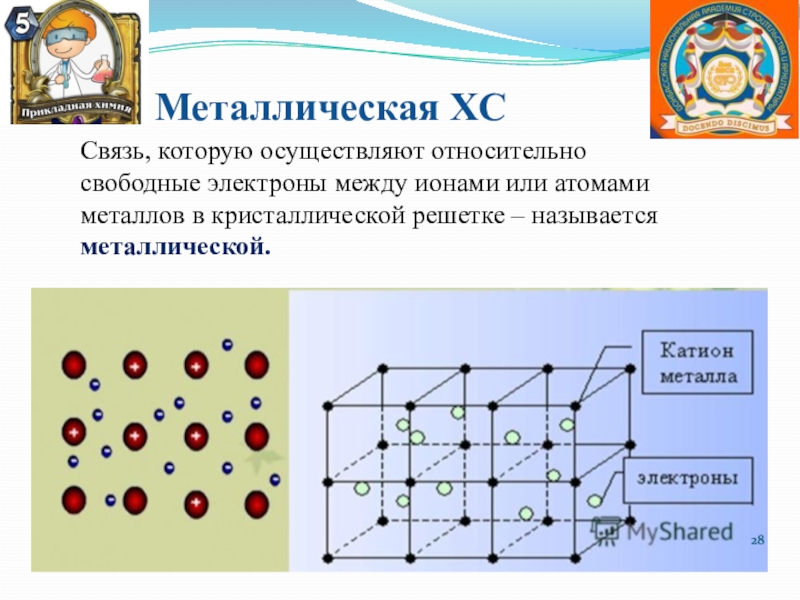
Слайд 28Металлическая ХС
Связь, которую осуществляют относительно свободные электроны между ионами или
атомами металлов в кристаллической решетке – называется металлической.
Слайд 29Особенности металлической связи.
Металлическую связь образуют элементы, атомы которых на внешнем
уровне имеют мало валентных электронов по сравнению с общим числом
внешних энергетически близких орбиталей.
Валентные электроны из-за небольшой энергии ионизации слабо удерживаются в атоме.
Электроны, осуществляющие связь, обобществлены («электронный газ») и перемещаются по всему куску металла, в целом электронейтрального.
Металлическая связь характерна для металлов твердом и жидком состоянии.
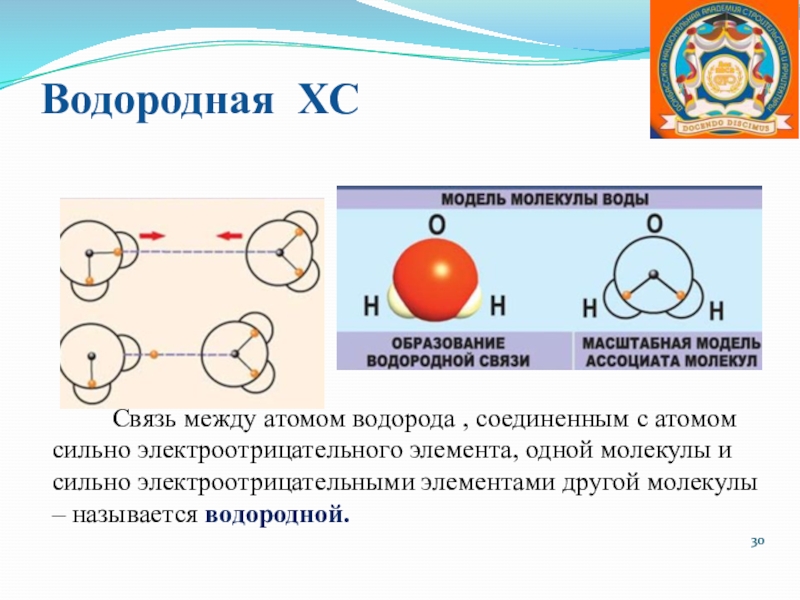
Слайд 30Водородная ХС
Связь между атомом водорода
, соединенным с атомом сильно электроотрицательного элемента, одной молекулы и
сильно электроотрицательными элементами другой молекулы – называется водородной.
Слайд 31Оосбенности водородной связи
Связь относится к межмолекулярной; возможно образование внутримолекулярной водородной
связи.
Водородная связь вторая по образованию в веществе, поэтому более слабая.
Тем
не менее она ответственна за ассоциацию молекул.
Водородная связь оказывает влияние на свойства вещества, т.к. нужна дополнительная энергия для разрыва водородной связи.
Слайд 33Метод валентных связей (ВС)
Связанные между собой атомы в молекуле удерживаются
вместе при помощи одной или нескольких общих эл-ных пар
Химическая
связь между двумя атомами локализована в месте перекрывания атомных орбиталей (локализованная двухцентровая связь)
Слайд 34Основные положения метода ВС
Ков. связь образуют два электрона с противоположными
спинами, принадлежащие двум атомам
При образовании связи происходит перекрывание АО и
увеличение электронной плотности между ними, что приводит к уменьшению энергии
Связь реализуется в направлении наибольшего перекрывания АО
Слайд 35Пример
если в соединение входит кислород, то два других элемента соединяются
только через кислород
водород образует только одну связь ( одна –
)
кислород – только две связи
где одна – обозначаем σ связь, а остальные – π-связи








![Лекция №3 Химическая связь Дипольный момент – колич-ная характеристика полярности связи (измеряется в дебаях) μ Дипольный момент – колич-ная характеристика полярности связи (измеряется в дебаях) μ = qlдипq– заряд полюса [Кл]lдип –](/img/tmb/7/603023/be9c35ad7a2890737392d60da08d2e18-800x.jpg)