Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Лекция №3 XИМИЧЕСКАЯ КИНЕТИКА И РАВНОВЕСИЕ
Содержание
- 1. Лекция №3 XИМИЧЕСКАЯ КИНЕТИКА И РАВНОВЕСИЕ
- 2. Зачем изучают химическую кинетику?гомогенныегетерогенныеРеакции2Н2 + О2 =
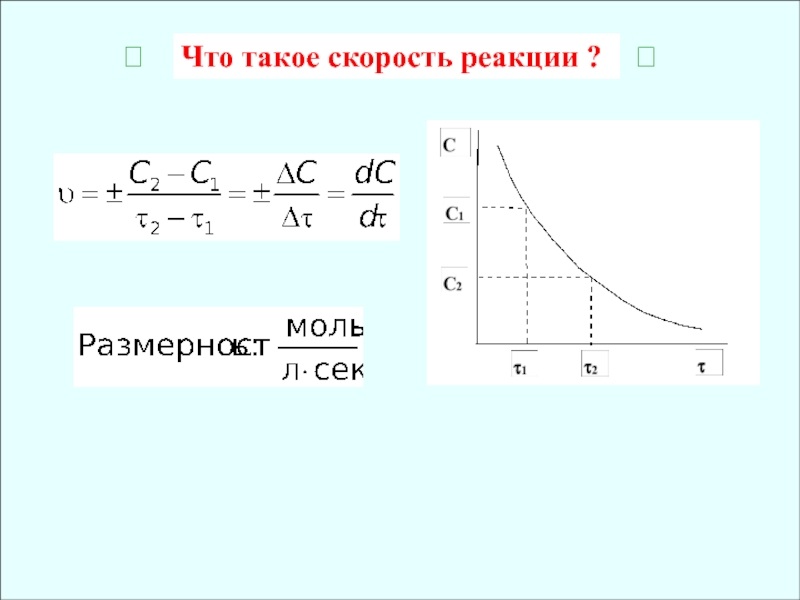
- 3. Что такое скорость реакции ?
- 4. ФАКТОРЫ, ВЛИЯЮЩИЕ НА СКОРОСТЬ РЕАКЦИИ Концентрация реагирующих
- 5. Закон действующих массСа А + б В
- 6. Природа реагирующих веществН2 + F2 =
- 7. Что такое энергия активации ?2Н2 + О2
- 8. Катализатор изменяет энергию активации2NH3 = N2 +
- 9. Химические реакции, которые при одних и тех
- 10. аА + bВ сС + dD
- 11. Выход реакцииЕсли Кравн>>1, то выход реакции великЕсли Кравн
- 12. Кс и КрР V = — RTmMP
- 13. ПРИНЦИП ЛЕ ШАТЕЛЬЕ 2SO2 + O2
- 14. СИНТЕЗ АММИАКАN2(г) + 3H2(г) 2NH3(г) + 91,8 кДжВыход аммиака в зависимости от внешних условий
- 15. Посмотрите дополнительный материал
- 16. Лекция № 3ХИМИЧЕСКАЯ КИНЕТИКА И РАВНОВЕСИЕ
- 17. ВыщелачиваниеВыщелачивание - это процесс перевода химического соединения
- 18. Чан для выщелачивания с механическим перемешиванием (агитатор)1
- 19. Схема пачука с аэролифтным перемещением жидкости1 –
- 20. Серия реакторов для работы в непрерывном режиме1
- 21. Cхема автоклава для выщелачивания руды (бокситов)1 –
- 22. Разделение пульпы после выщелачивания на раствор и
- 23. Примеры реальных технологических процессов выщелачивания.1. Выщелачивание вольфрама
- 24. Промышленный синтез аммиакаАммиак NH3 – практически самое
- 25. Реакция обратимая, экзотермическая. Исходя из принципа Ле
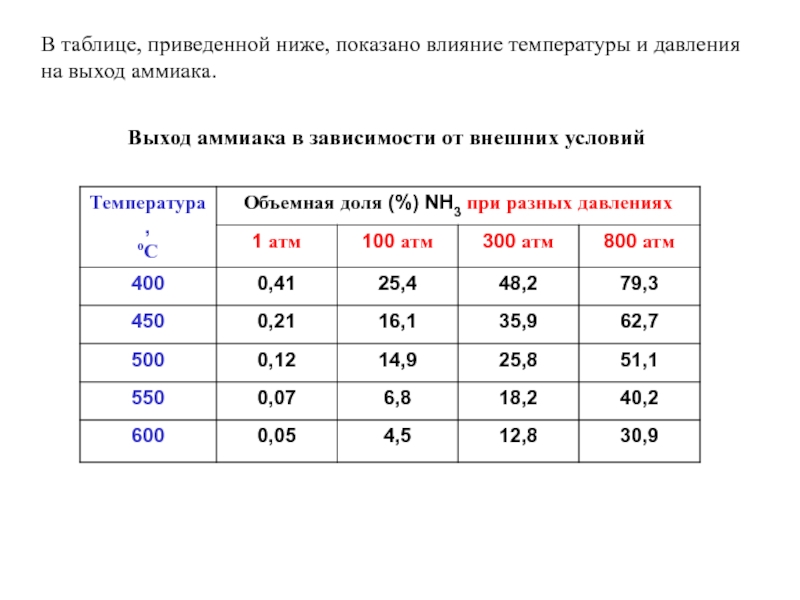
- 26. В таблице, приведенной ниже, показано влияние температуры
- 27. Таким образом, оптимальными параметрами процесса получения аммиака
- 28. Скачать презентанцию
Слайды и текст этой презентации
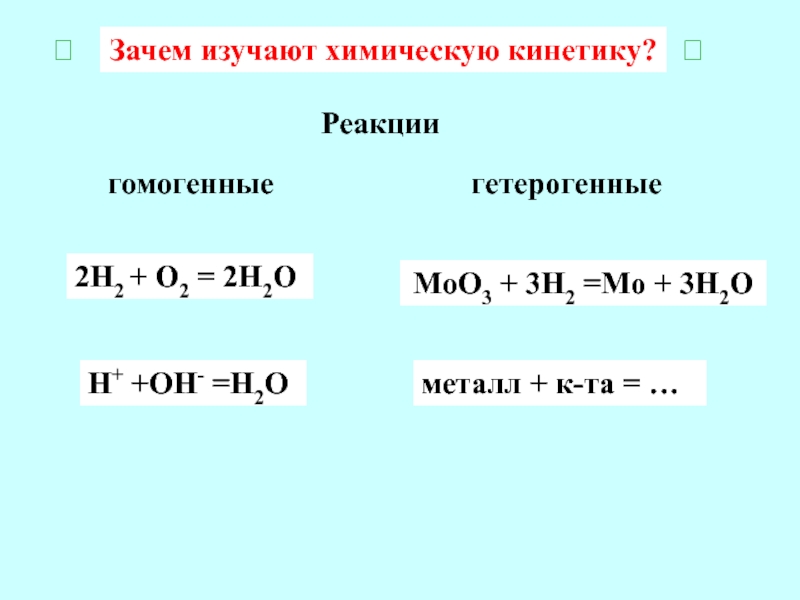
Слайд 2Зачем изучают химическую кинетику?
гомогенные
гетерогенные
Реакции
2Н2 + О2 = 2Н2О
Н+ +ОН- =Н2О
MoO3
+ 3H2 =Mo + 3H2O
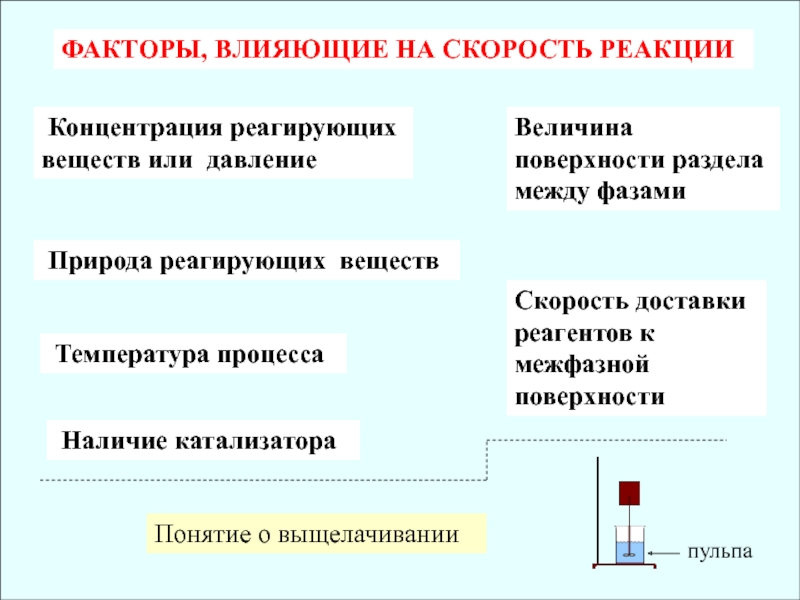
Слайд 4ФАКТОРЫ, ВЛИЯЮЩИЕ НА СКОРОСТЬ РЕАКЦИИ
Концентрация реагирующих веществ или давление
Природа реагирующих веществ
Температура процесса
Наличие катализатора
Величина поверхности раздела между
фазамиСкорость доставки реагентов к межфазной поверхности
Понятие о выщелачивании
пульпа
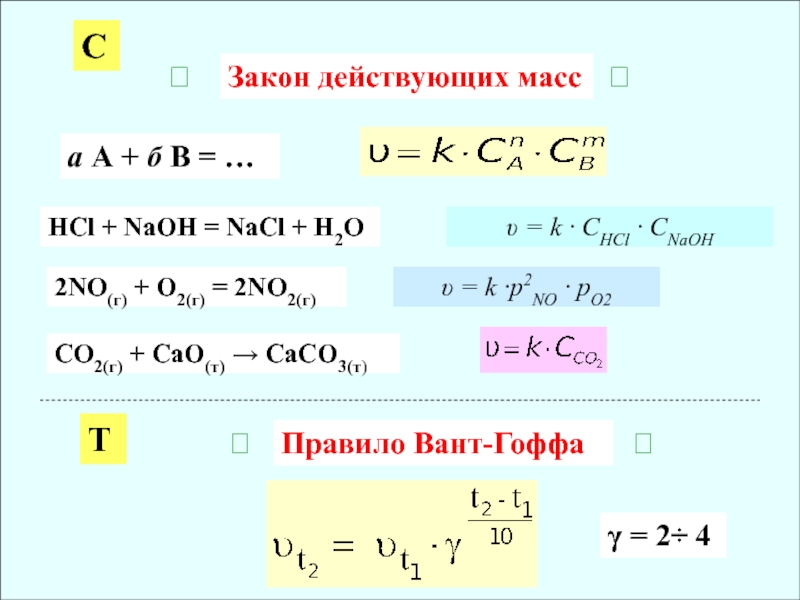
Слайд 5Закон действующих масс
С
а А + б В = …
2NO(г) +
O2(г) = 2NO2(г)
= k ·p2NO · pO2
HCl + NaOH
= NaCl + H2O = k · CHCl · CNaOH
CO2(г) + CaO(т) CaCO3(т)
Правило Вант-Гоффа
T
γ = 2÷ 4
Слайд 6 Природа реагирующих веществ
Н2 + F2 = 2HF
при комнатной температуре,
со взрывом
H2 + Cl2 = 2HCl
на свету, или нагреть, или
пропустить электрический разрядН2 + Br2 = 2HBr
начинается при температуре 200-300С
Н2 + I2 = 2HI
при нагревании до 500-700С
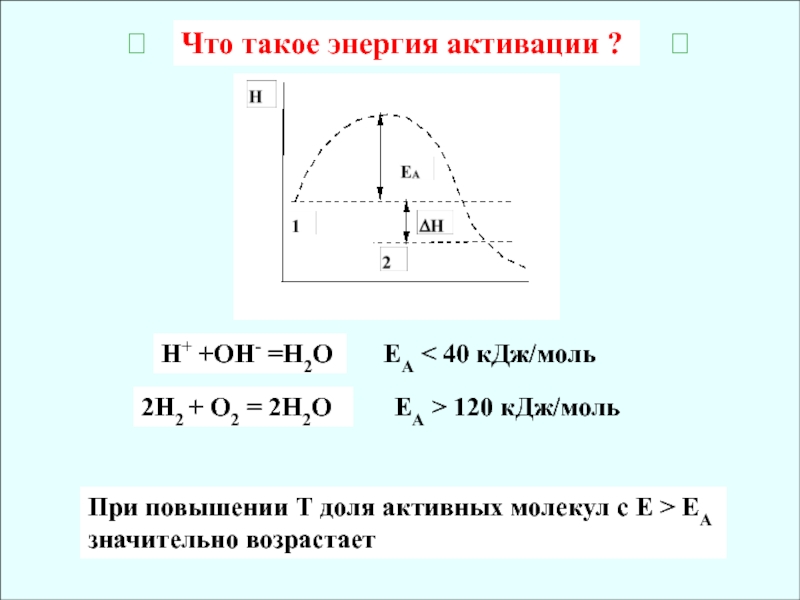
Слайд 7Что такое энергия активации ?
2Н2 + О2 = 2Н2О
ЕА
40 кДж/моль
ЕА > 120 кДж/моль
Н+ +ОН- =Н2О
При повышении Т доля
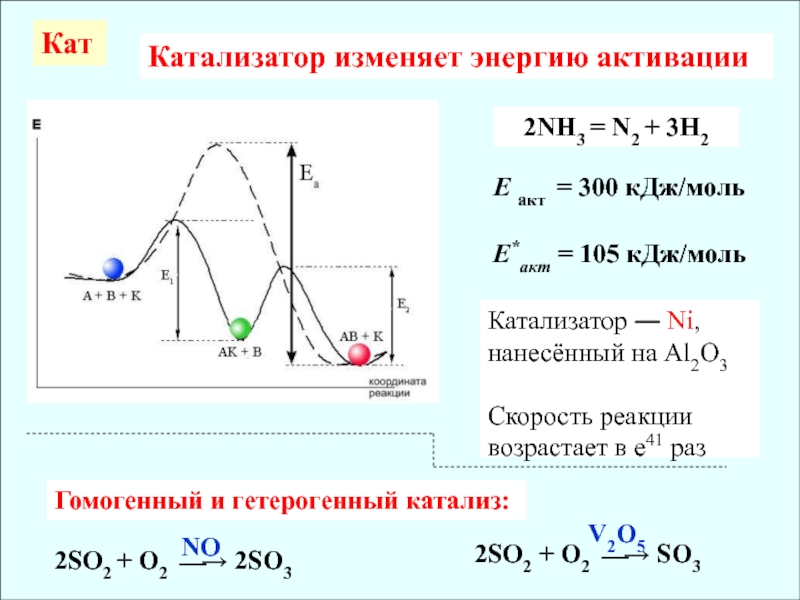
активных молекул с E > EA значительно возрастаетСлайд 8Катализатор изменяет энергию активации
2NH3 = N2 + 3H2
Е акт =
300 кДж/моль
Е*акт = 105 кДж/моль
Катализатор ― Ni, нанесённый на Al2O3
Скорость
реакции возрастает в е41 разКат
Гомогенный и гетерогенный катализ:
2SO2 + O2 2SO3
2SO2 + O2 SO3
NO
V2O5
Слайд 9Химические реакции, которые при одних и тех же условиях могут
идти в противоположных направлениях, называются обратимыми
Например: Н2 + I2
2HI (при t = 200oC реакция обратима)Состояние реакции, при котором скорости уравниваются называется химическим равновесием
Химическое равновесие. Обратимые реакции
Слайд 10аА + bВ сС + dD
[C]c [D]d
K = k1
/ k2 = —————[A]a [B]b
K не зависит от С, но зависит от Т
Математическое выражение закона действующих масс при химическом равновесии
Слайд 11Выход реакции
Если Кравн>>1, то выход реакции велик
Если Кравн
выход реакции мал
Cu(т) + 2Ag+(водн) Сu2+(водн) + 2Ag(т)
К =
——[Сu2+]
[Ag+]2
= 2 · 1015
AgI(т) Ag+ + I-
K = [Ag+] [I-] = 1· 10-16
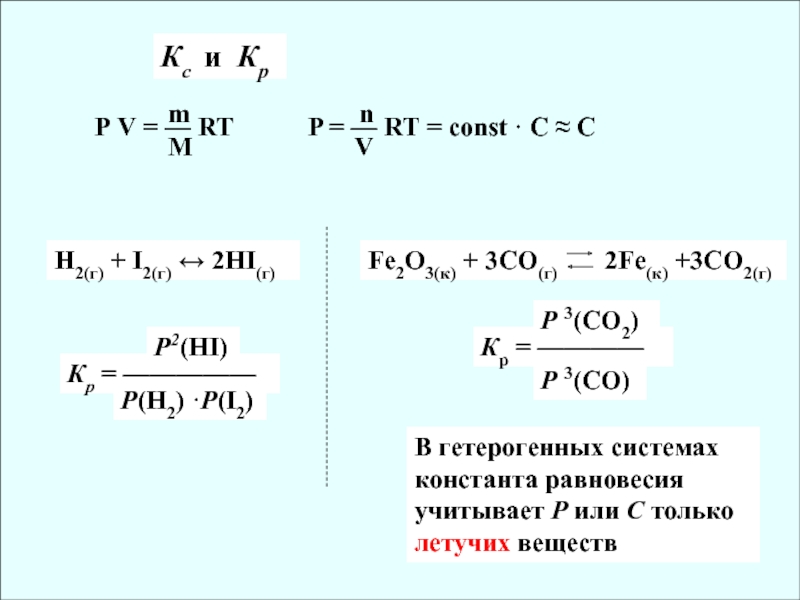
Слайд 12Кс и Кр
Р V = — RT
m
M
P = — RT
= const · C C
n
V
Н2(г) + I2(г) 2HI(г)
Fe2O3(к)
+ 3CO(г) 2Fe(к) +3CO2(г)В гетерогенных системах константа равновесия учитывает Р или С только летучих веществ
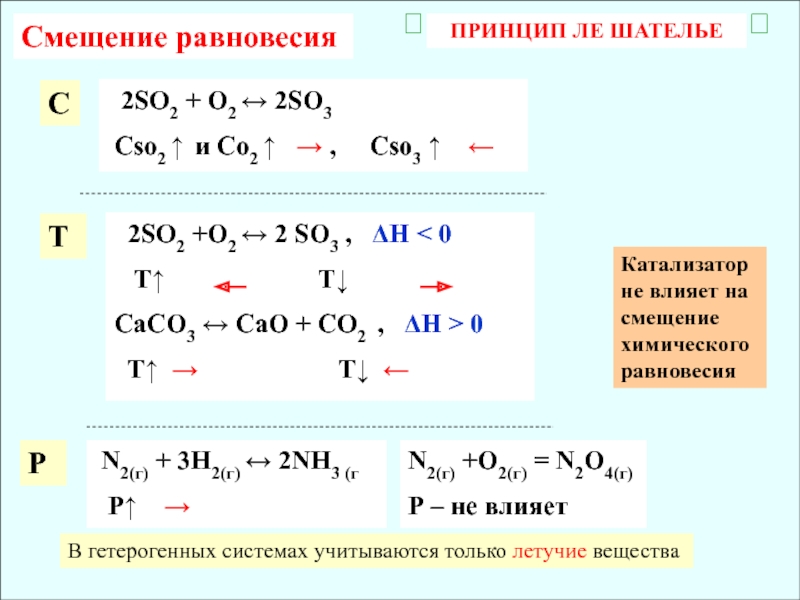
Слайд 13ПРИНЦИП ЛЕ ШАТЕЛЬЕ
2SO2 + O2 2SO3
Сso2
и Со2 , Сso3
2SO2 +O2 2 SO3 , H < 0
T T
СаСО3 СаО + СО2 , Н 0
T T
N2(г) + 3Н2(г) 2NН3 (г
Р
С
Т
P
N2(г) +O2(г) = N2O4(г)
Р – не влияет
Смещение равновесия
В гетерогенных системах учитываются только летучие вещества
Катализатор не влияет на смещение химического равновесия
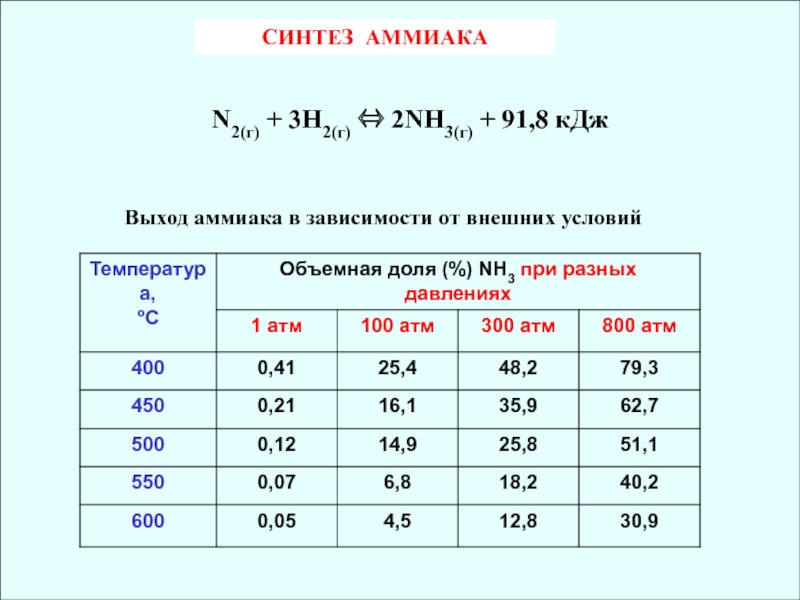
Слайд 14СИНТЕЗ АММИАКА
N2(г) + 3H2(г) 2NH3(г) + 91,8 кДж
Выход аммиака
в зависимости от внешних условий
Слайд 15Посмотрите дополнительный материал
на сайте кафедры - лекция № 3
Процесс выщелачивания
Промышленный синтез аммиака
*
Слайд 17Выщелачивание
Выщелачивание - это процесс перевода химического соединения основного металла из
руд или концентратов в раствор с помощью селективного (избирательно) действующего
растворителя. В качестве растворителей используют воду, водные растворы минеральных кислот (H2SO4; HCl; HNO3), щелочей (NaOH; NH4OH) или солей (Na2CO3 и др.).Цель выщелачивания – подбор оптимальных условий (температура, концентрация растворов), при которых извлекаемый металл растворялся бы с максимальной полнотой и скоростью, а пустая порода и сопутствующие элементы либо вообще не растворялись, либо степень их перехода в раствор была бы невелика.
Факторы, влияющие на скорость выщелачивания (или параметры процесса): температура, скорость перемешивания, поверхность твердой фазы и пр.
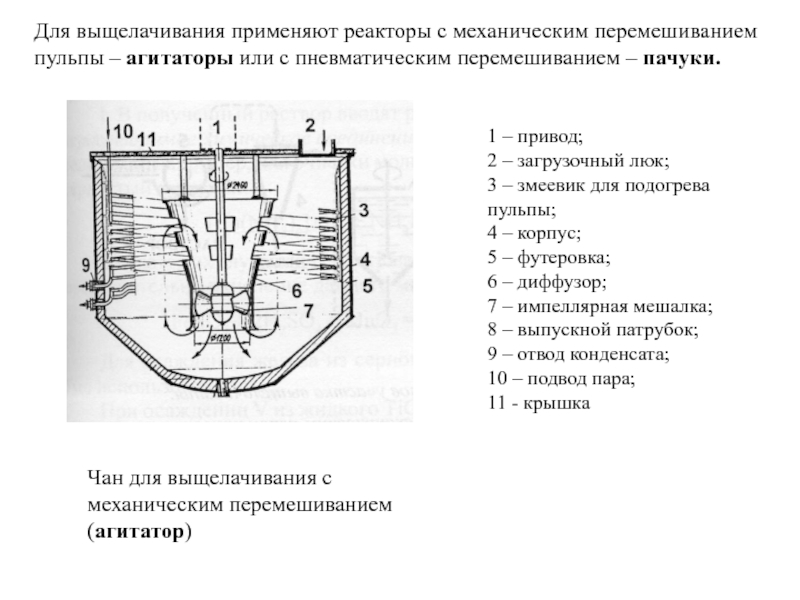
Слайд 18Чан для выщелачивания с механическим перемешиванием (агитатор)
1 – привод;
2 – загрузочный люк; 3 – змеевик для подогрева пульпы; 4 – корпус; 5 – футеровка; 6 – диффузор; 7 – импеллярная мешалка; 8 – выпускной патрубок; 9 – отвод конденсата; 10 – подвод пара; 11 - крышка
Для выщелачивания применяют реакторы с механическим перемешиванием пульпы – агитаторы или с пневматическим перемешиванием – пачуки.
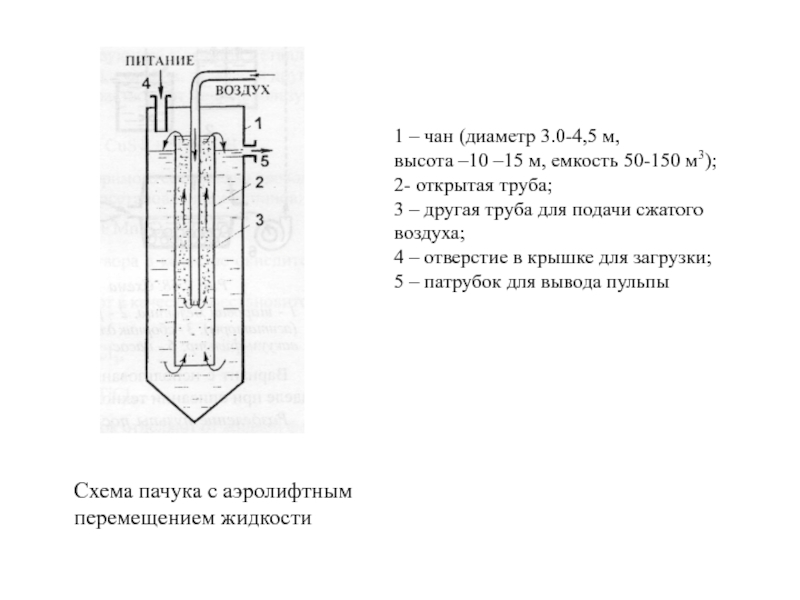
Слайд 19Схема пачука с аэролифтным перемещением жидкости
1 – чан (диаметр 3.0-4,5
м, высота –10
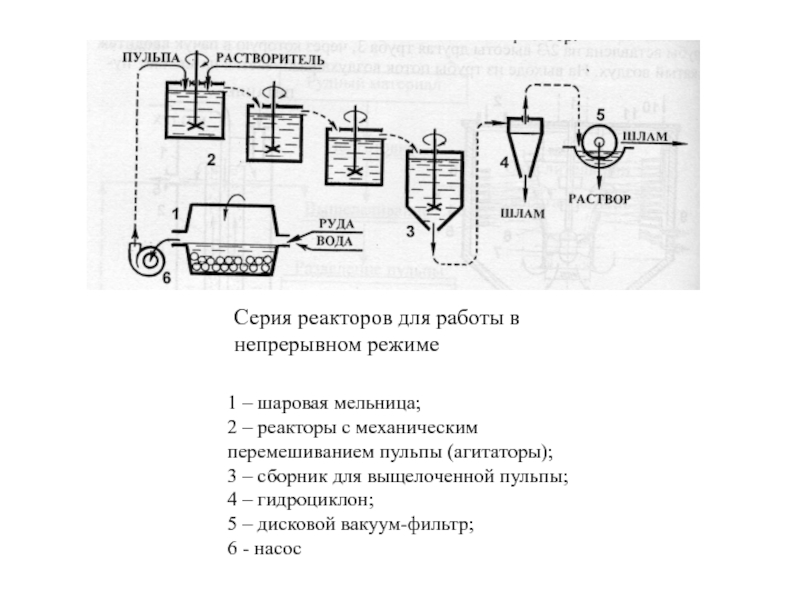
–15 м, емкость 50-150 м3); 2- открытая труба; 3 – другая труба для подачи сжатого воздуха; 4 – отверстие в крышке для загрузки; 5 – патрубок для вывода пульпыСлайд 20Серия реакторов для работы в непрерывном режиме
1 – шаровая мельница;
2 – реакторы с механическим перемешиванием пульпы (агитаторы); 3 – сборник для выщелоченной пульпы; 4 – гидроциклон; 5 – дисковой вакуум-фильтр; 6 - насос
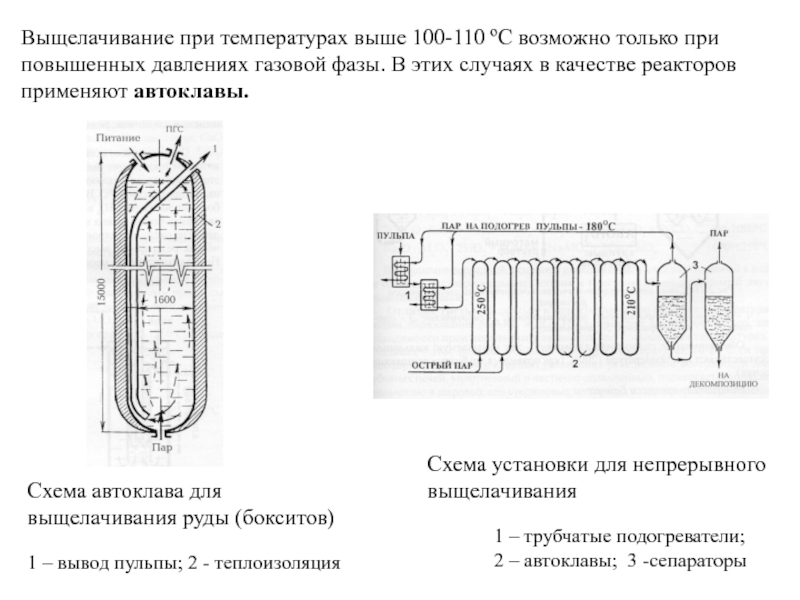
Слайд 21Cхема автоклава для выщелачивания руды (бокситов)
1 – вывод пульпы; 2
- теплоизоляция
Схема установки для непрерывного выщелачивания
1 – трубчатые подогреватели;
2 – автоклавы; 3 -сепараторыВыщелачивание при температурах выше 100-110 ºС возможно только при повышенных давлениях газовой фазы. В этих случаях в качестве реакторов применяют автоклавы.
Слайд 22Разделение пульпы после выщелачивания на раствор и твердый осадок производят
с помощью различных аппаратов: отстойников-сгустителей, гидроциклонов, фильтров, а также центрифугированием.
Твердую
фазу – шлам – после разделения промывают и направляют либо в отвал, либо на извлечение сопутствующих элементов. Жидкую фазу – раствор – вначале подвергают очистке от нежелательных элементов, перешедших в раствор из руды, а затем направляют на извлечение из нее основного элемента.
Выщелачивание – один из основных процессов в гидрометаллургических схемах переработки рудного сырья.
Исследование кинетики процессов выщелачивания необходимо для определения энергии активации, установления лимитирующей стадии процесса и на основании этого определение оптимальных параметров.
Слайд 23Примеры реальных технологических процессов выщелачивания.
1. Выщелачивание вольфрама из шеелита СaWO4
растворами соды в автоклавах.
СaWO4(тв) +
Na2CO3(раст) = Na2WO4(раств) + CaCO3(тв)Оптимальные параметры процесса: температура 200-225 С, расход соды - в 2,5-2,7 раза больше от стехиометрически необходимого количества, энергия активации составляет 75-92 кДж/моль.
2. Выщелачивание минералов бокситовых руд растворами едкого натра.
Al(OH)3 + NaOH = NaAl(OH)4
Температура выщелачивания: 100-105 C, концентрация растворов NaOH – 200-250 г/л, давление – атмосферное.
AlOOH +NaOH + H2O = NaAl(OH)4
Температура – 200-220 С, концентрация щелочи 290-300 г/л, выщелачивание в автоклавах.
Величина энергии активации указывает на лимитирующую стадию процесса. Установлено, что если энергия активации составляет 8÷20 кДж/моль, то скорость реакции лимитируется процессами диффузии. Если энергия активации составляет 40-300 кДж/моль, то процесс лимитируется собственной химической реакцией
Слайд 24Промышленный синтез аммиака
Аммиак NH3 – практически самое важное водородное соединение
азота, так как лежит в основе получения азотных минеральных удобрений.
Азот, как известно, является необходимым элементом для роста растений.Основным сырьем в производстве аммиака являются атмосферный воздух и природный газ. Азот получают путем сжижения воздуха (в состав воздуха входит 79 % азота), а водород или водородосодержащий газ получают из природного газа.
Аммиак в обычных условиях представляет собой бесцветный газ с резким запахом, легко сжижается, хорошо растворим в воде c образованием гидратов. В жидком состоянии аммиак – бесцветная подвижная жидкость, не проводящая электрического тока.
Промышленный синтез аммиака из элементов осуществляется по уравнению:
N2(г) + 3H2(г) 2NH3(г) + 91,8 кДж ()
Так называемый процесс Габера – по имени немецкого химика Ф.Габера, разработавшего физико-химические основы этого метода и получившего за это Нобелевскую премию по химии в 1918 г.
Слайд 25Реакция обратимая, экзотермическая. Исходя из принципа Ле Шателье ясно, что
чем ниже температура, тем больше равновесие будет сдвигаться в сторону
образования аммиака, т.е. вправо. Поэтому, можно предположить, что следует максимально понижать температуру. Однако, при низких температурах реакция протекает очень медленно (практически не идет). Поэтому, на практике процесс проводят при температуре 400-450 ºС.Но даже при такой высокой температуре для достижения высокой скорости реакции требуется присутствие специального катализатора. В качестве катализатора используется губчатое железо, активированное оксидами калия и алюминия.
Cогласно принципу Ле Шателье, процесс выгодно проводить, повышая давление. Однако, оборудование, рассчитанное на очень высокое давление, дорого и процесс становится экономически менее выгодным. Поэтому, на практике держат «среднее» давление 250 атм.



![Лекция №3
XИМИЧЕСКАЯ КИНЕТИКА
И РАВНОВЕСИЕ аА + bВ сС + dD аА + bВ сС + dD [C]c](/img/tmb/4/349291/32ed1a46c3f6f992159b89986570b554-800x.jpg)