Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Метаболизм углеводов (дополнение)
Содержание
- 1. Метаболизм углеводов (дополнение)
- 2. Вопросы из билетов по темеМоносахариды, олигосахариды. Полисахариды.
- 3. Структура темыУглеводы с точки зрения химии: структура,
- 4. Углеводы: химия и функции
- 5. По химической структуре:Многоатомные спирты, содержащие альдегидную (альдозы,
- 6. Пример: разные способы охарактеризовать глюкозу (с точки
- 7. Наиболее важные углеводы
- 8. Важные моносахариды: рибоза, дезоксирибозаРибоза, дезоксирибоза: входит в
- 9. Важные моносахариды: глюкозаГлюкоза: основной источник энергии предшественник всех других углеводов входит в состав гликопротеинов
- 10. Важные моносахариды: фруктозаФруктоза источник энергии может превращаться в глюкозу
- 11. Важные моносахариды: галактозаГалактоза источник энергии входит в состав лактозы – молочного сахара входит в состав гликопротеинов
- 12. Важные моносахариды: маннозаМаннозавходит в состав гликопротеинов
- 13. Важные моносахариды: ксилозаКсилоза входит в состав гликопротеинов (гепарансульфат, хондроитинсульфат)
- 14. Важные дисахариды: мальтозаМальтоза глюкоза + глюкоза образуется
- 15. Важные дисахариды: лактозаЛактоза (молочный сахар) галактоза +
- 16. Важные дисахариды: сахарозасахароза глюкоза + фруктоза содержится в растениях гидролизуется ферментом сахаразой только в кишечнике
- 17. Важные полисахариды: гликоген и крахмалГликоген (крахмал у
- 18. Переваривание углеводовСахараза, мальтаза и лактаза – ферменты
- 19. АТФ и энергия
- 20. АТФ: источник энергии для биохимических процессовПо химической
- 21. Распад и синтез АТФРаспад АТФ в процессах,
- 22. Существует всего 2 способа синтеза АТФ (т.е.
- 23. Окислительно-восстановительные реакции (ОВР)
- 24. Общая схема ОВР: восстановленный субстрат отдает электроны
- 25. ОВР (окислительно-восстановительные реакции в биохимии)В качестве одного
- 26. Примеры ОВРокислениевосстановлениеСамый восстановленныйСамый окисленный
- 27. Конкретный пример (из ЦТК)Сукцинат окисляется до фумарата
- 28. гликолиз
- 29. Схема:Функцииэнергетическая промежуточные метаболиты гликолиза используются в синтезе аминокислот и липидовВнутриклеточная локализация: цитозольТканевая локализация: все тканиглюкозапируватАТФНАДН…
- 30. 1-ю реакцию могут катализировать 2 фермента, в
- 31. Гликолитическая оксидоредукция, или почему есть аэробный и
- 32. глюконеогенез
- 33. Глюконеогенез - синтез глюкозы из неуглеводных предшественников
- 34. На схеме показана последовательность гликолиза (сверху вниз)
- 35. Окислительное декарбоксилирование пирувата
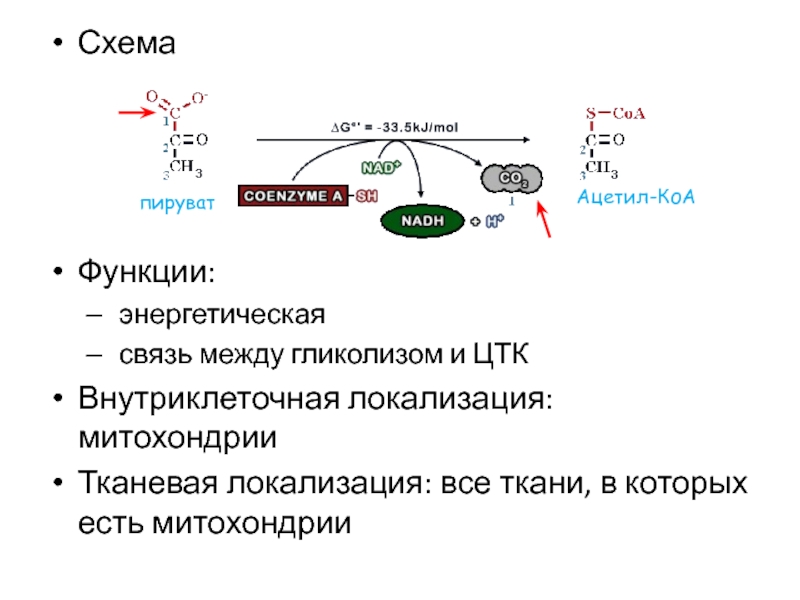
- 36. СхемаФункции: энергетическая связь между гликолизом и ЦТКВнутриклеточная локализация: митохондрииТканевая локализация: все ткани, в которых есть митохондриипируватАцетил-КоА
- 37. В результате реакции от пирувата отщепляется карбоксильная
- 38. Цикл кребса (цикл трикарбоновых кислот)
- 39. Схема:Функции:ЭнергетическаяСвязь метаболизма аминокислот, углеводов и липидовВнутриклеточная локализация:
- 40. Метаболиты и ферменты ЦТК2 атома С входят
- 41. Дыхательная цепь и окислительное фосфорилирование
- 42. Схема:Функция: энергетическая (большая часть АТФ синтезируется этим
- 43. Общая схема синтеза АТФ (хемиосмотическая гипотеза Митчелла)НАДНФАДН2Дыхательная
- 44. Цепь переноса электронов и АТФсинтазаВ реальности дыхательная
- 45. Подробное описание работы дыхательной цепиКомплекс I окисляет
- 46. Гликоген: структура, синтез, распад
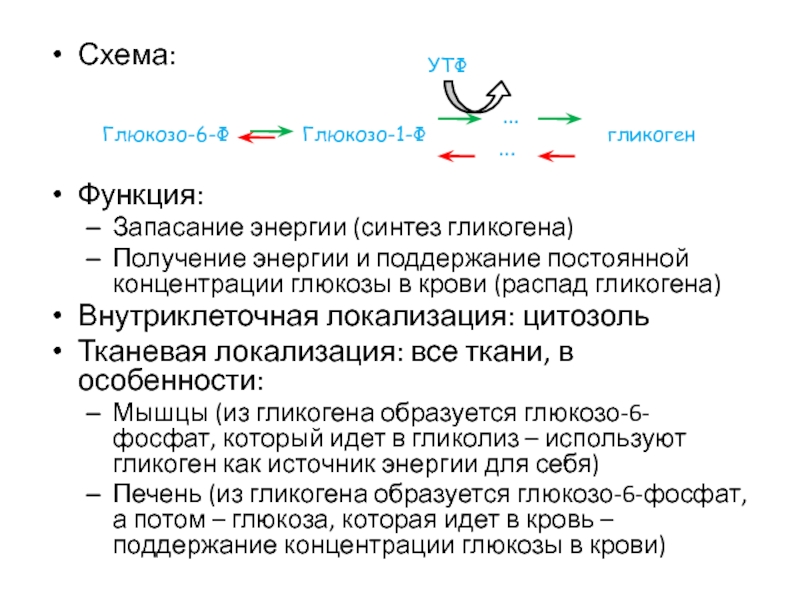
- 47. Схема:Функция:Запасание энергии (синтез гликогена)Получение энергии и поддержание
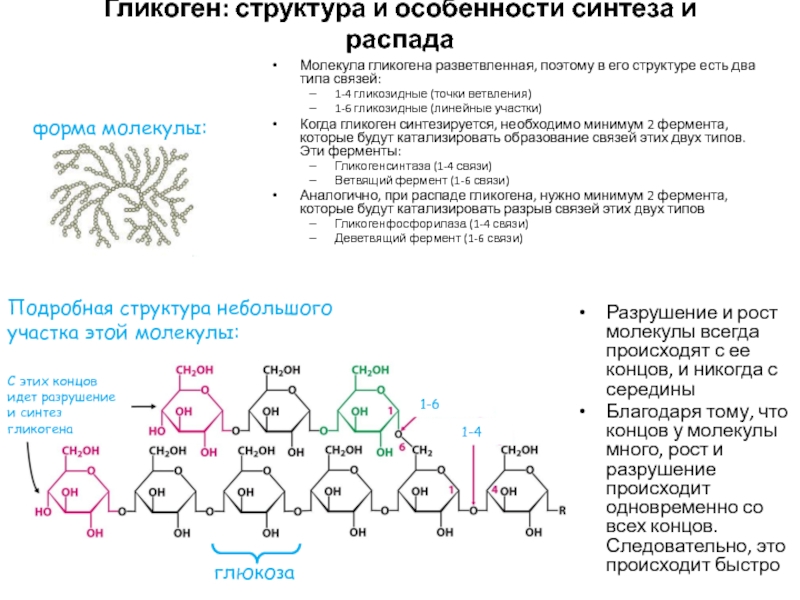
- 48. Гликоген: структура и особенности синтеза и распадаМолекула
- 49. В пространстве молекула гликогена похожа на сферу
- 50. Этапы синтеза гликогенаВ клетке всегда существуют небольшие
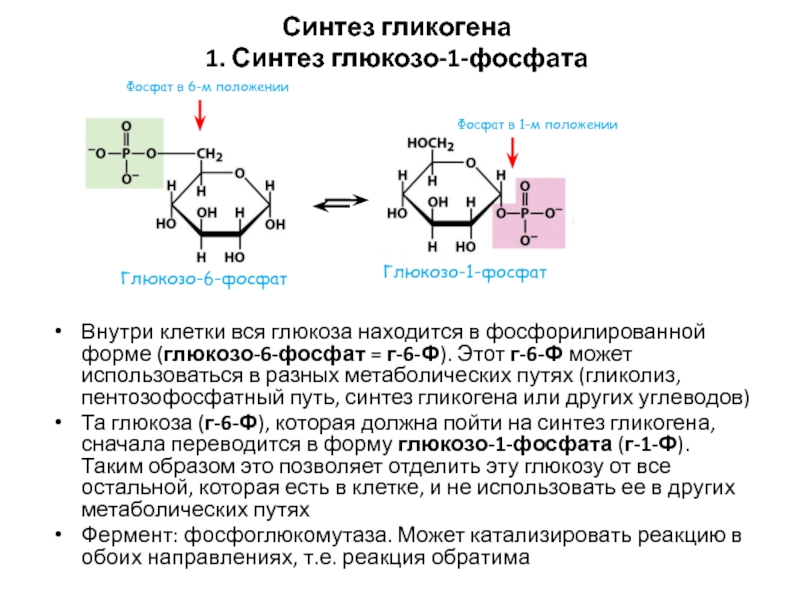
- 51. Синтез гликогена 1. Синтез глюкозо-1-фосфатаВнутри клетки вся
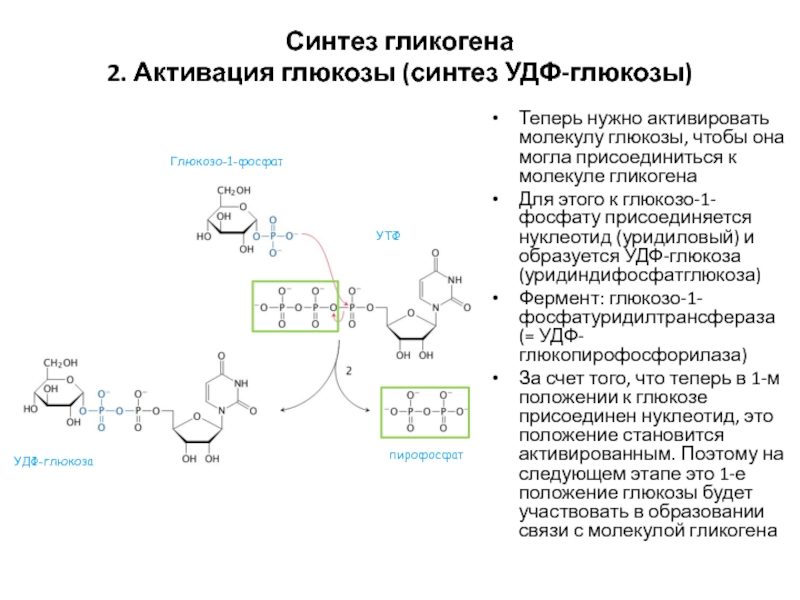
- 52. Синтез гликогена 2. Активация глюкозы (синтез УДФ-глюкозы)Теперь
- 53. Синтез гликогена 3. Удлинение молекулы гликогенаНа рисунке
- 54. Синтез гликогена 4.Ветвление молекулы гликогенаКогда ветка
- 55. Этапы распада гликогенаФерменты укорачивают отдельные ветки молекул
- 56. Распад гликогена 1. Укорачивание линейных участков (фосфоролиз
- 57. Распад гликогена 2. Превращение глюкозо-1-фосфата в глюкозо-6-фосфат
- 58. Распад гликогена 3. Удаление точек ветвленияКрасным показаны
- 59. Нарушения метаболизма гликогена - гликогенозыФерменты, участвующие в
- 60. Пентозофосфатный путь
- 61. Схема:ФункцииОбразование рибозы для синтеза нуклеотидовОбразование НАДФН для
- 62. НАДН vs. НАДФНОба являются коферментами ОВРОба содержат
- 63. Две стадии:Окислительная: глюкозо-6-фосфат (С6) превращается в рибулозо-5-фосфат
- 64. I. Окислительная стадияЦелями первой стадии являются:Превращение 6-углеродной
- 65. Целью неокислительной стадии является превращение нескольких 5-углеродных
- 66. Полная схема пентозофосфатного путиОбратите внимание на метаболиты
- 67. Нарушения пентозофосфатного путиНаследственное заболевание, связанное с нарушением
- 68. Участие глутатиона и пентозофосфатного пути в защите
- 69. Регуляция метаболизма углеводов
- 70. Регуляторные ферментыВ любом метаболическом пути есть два
- 71. 1234567891011Регуляторные ферменты в гликолизе
- 72. Общие принципы регуляции работы ферментовИзменение скорости работы
- 73. Регуляторные ферменты гликолизаНеобратимые реакции (они же регуляторные
- 74. Аллостерические регуляторы гликолизаТормозят гликолиз: АТФ, цитрат, глюкозо-6-фосфат (мышцы), фруктозо-6-фосфат (печень), ацетил-КоА, ВЖКУскоряют гликолиз: АДФ, АМФ, фруктозо-2,6-бисфосфат
- 75. Гормональная регуляция гликолизаТормозит: глюкагонАктивируют: инсулин, адреналин (в мышцах)
- 76. Регуляция гликолиза и глюконеогенеза
- 77. Регуляция синтеза и распада гликогена
- 78. Регуляторные ферментыГликогенсинтаза – регуляторный фермент синтеза гликогена.
- 79. Фосфорилированные и нефосфорилированные формы гликогенфосфорилазы (вверху) и
- 80. Описание сигнального каскада адреналина и глюкагона –
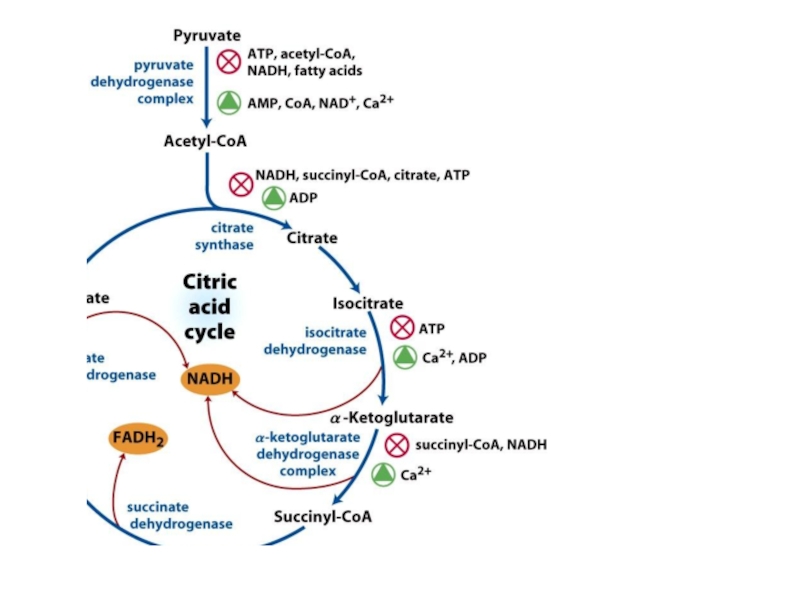
- 81. Регуляция ЦТК
- 82. Регуляторные ферментыЦитратсинтаза:Ингибируют: НАДН, сукцинил-КоА, цитрат, АТФАктивирует: АДФИзоцитратдегидрогеназаИнгибирует: АТФАктивируют: Ca2+, АДФα-кетоглутаратдегидрогеназный комплексИнгибируют: НАДН, сукцинил-КоААктивирует: Ca2+
- 83. Слайд 83
- 84. Физиологические эффекты инсулина: метаболизм глюкозы, аминокислот, липидов
- 85. Влияние на метаболизм углеводовАктивация поступления глюкозы в
- 86. Влияние инсулина на концентрацию глюкозы в кровиПосле
- 87. Механизм действия инсулина на клеткиНа схеме показана
- 88. Влияние на метаболизм липидовИнгибирует гормон-чувствительную липазу адипоцитовАктивирует
- 89. Влияние на метаболизм белков и аминокислотАктивация синтеза белковАктивация захвата аминокислот тканями
- 90. Сахарный диабет: причины и типы
- 91. СД 1 типаИммунные: аутоантитела к инсулину и
- 92. СД 2 типаИнсулинорезистентность – невосприимчивость (устойчивость) клеток
- 93. Глюкагон и адреналин
- 94. Глюкагон и адреналинГлюкагон – пептидный гормонАдреналин –
- 95. Интеграция метаболизма
- 96. «Метаболическая воронка»Это понятие, которое описывает унификацию получения
- 97. Окисление всех питательных веществ с образованием ацетил-КоА
- 98. Ацетил-КоАпируватглюкозаСерин, глицинГлюкозо-6-ФКетоновые телаВЖКхолестеринα-кетоглутаратГлутамат и другие а.к.оксалоацетатАспартат, аспарагиналанинГликогенРибозо-5-ФглицеринТАГ, фосфолипидыПростая схема связи между углеводами, липидами и аминокислотами
- 99. Простая схема связи между углеводами, липидами и
- 100. Скачать презентанцию
Слайды и текст этой презентации
Слайд 1Метаболизм углеводов (дополнение)
Пентозофосфатный путь
регуляция обмена углеводов
интеграция метаболизма аминокислот,
углеводов и липидов
Слайд 2Вопросы из билетов по теме
Моносахариды, олигосахариды. Полисахариды. Важнейшие представители. Химическое
строение. Биологическая роль.
Моносахариды, олигосахариды, полисахариды. Важнейшие представители. Химическое строение, биологическая
роль.Гликолиз. Регуляция. Энергетический эффект анаэробного распада углеводов.
Анаэробное расщепление углеводов в организме, его биологическое значение. Энергетический эффект. Понятие о субстратном фосфорилировании.
Глюконеогенез. Энергетический эффект. Регуляция.
Окислительное декарбоксилирование пировиноградной кислоты. Ферменты и коферменты, участвующие в этом процессе.
Окислительное декарбоксилирование пировиноградной кислоты. Ферменты и коферменты, участвующие в этом процессе.
Цикл трикарбоновых кислот Кребса. Биологическое значение. Регуляция.
Цикл Кребса, его биологическое значение, регуляция
Сопряженность цикла Кребса с процессом биологического окисления. Окислительное фосфорилирование.
Энергетический эффект анаэробного и аэробного путей распада углеводов.
Окислительное фосфорилирование. Хемиосмотическая теория П. Митчелла.
Пентозофосфатный путь окисления глюкозы в тканях. Биологическая роль.
Пентозофосфатный путь окисления глюкозы в тканях и его биологическая роль.
Распад и синтез гликогена в печени. Гликогенолиз в мышцах.
Распад и синтез гликогена в печени. Гликогенолиз в мышцах. Регуляция этих процессов.
Синтез и распад гликогена, гормональная регуляция этих процессов.
Механизмы регуляции содержания глюкозы в крови. Явления гипо- и гипергликемии. Сахарный диабет. Диагностическое значение сахарных кривых.
Регуляция углеводного обмена. Нарушения углеводного обмена.
Общие пути обмена веществ в организме. Анаболизм и катаболизм - основные процессы метаболизма.
Возможные пути превращения пирувата в клетках.
Возможные пути превращения ацетил-КоА в клетках.
Превращения глицерина. Рассчитать энергетический эффект полного аэробного окисления одной молекулы глицерина.
Методы определения глюкозы в крови. Клинико-диагностическое значение.
Слайд 3Структура темы
Углеводы с точки зрения химии: структура, классификация. Функции углеводов
Моносахариды
Дисахариды
Полисахариды
АТФ
и получение энергии:
Субстратное фосфорилирование
Окислительное фосфорилирование
Окислительно-восстановительные реакции в биохимии
Коферменты
Ферменты
Изменения в молекулах,
которые происходят при ОВРГликолиз
Участники
Обратимые и необратимые реакции
ОВР и реакции субстратного фосфорилирования, макроэргические соединения в гликолизе
Глюконеогенез
Участники
Отличие и сходство с гликолизом
Окислительное декарбоксилирование пирувата. Особенности фермента и его коферменты
ЦТК. Участники, ОВР
Дыхательная цепь о окислительное фосфорилирование
Гликоген: синтез, распад. Ферменты.
Пентозофосфатный путь
Стадии
нарушения
Регуляция метаболизма углеводов. Регуляция уровня глюкозы в крови: инсулин, глюкагон, адреналин
Слайд 5По химической структуре:
Многоатомные спирты, содержащие альдегидную (альдозы, альдосахара) или кетогруппу
(кетозы, кетосахара)
Углеводы также делятся на группы в зависимости от количества
атомов углерода:триозы (3С)
тетрозы (4С)
пентозы (5С)
гексозы (6С), и т.д.
С другой стороны, молекулы углеводов могут объединяться друг с другом, образуя еще более сложные молекулы. Поэтому есть еще один параметр, по которому классифицируют углеводы:
Моносахариды – не гидролизуются (распадаются) с образованием более простых углеводов)
дисахариды – гидролизуются с образованием двух более простых углеводов
полисахариды – гидролизуются с образованием большого количества более простых углеводов
Форма молекулы: линейная или циклическая. Линейная молекула углевода может замыкаться в кольцо, при этом альдегидная или кетогруппа будут реагировать с одной из гидроксильных групп. В зависимости от того, сколько атомов входят в кольцо (чаще всего 5 или 6), такие формы называют:
Пиранозная (6 атомов в кольце: 1 атом О и 5 атомов С)
Фуранозная (5 атомов в кольце: 1 атом О и 4 атома С)
Таким образом, каждый углевод можно охарактеризовать по 4 параметрам
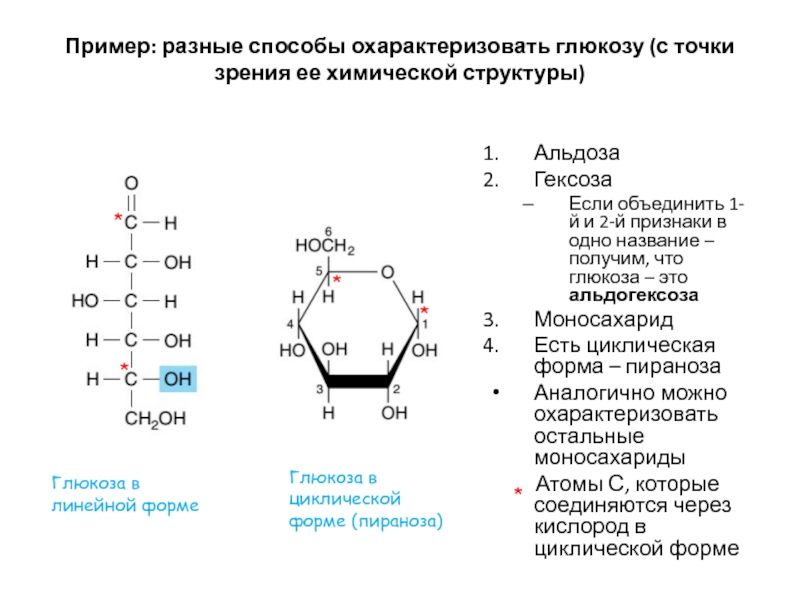
Слайд 6Пример: разные способы охарактеризовать глюкозу (с точки зрения ее химической
структуры)
Альдоза
Гексоза
Если объединить 1-й и 2-й признаки в одно название –
получим, что глюкоза – это альдогексозаМоносахарид
Есть циклическая форма – пираноза
Аналогично можно охарактеризовать остальные моносахариды
Атомы С, которые соединяются через кислород в циклической форме
Глюкоза в линейной форме
Глюкоза в циклической форме (пираноза)
*
*
*
*
*
Слайд 8Важные моносахариды: рибоза, дезоксирибоза
Рибоза, дезоксирибоза: входит в состав нуклеозидов, нуклеотидов,
нуклеиновых кислот (ДНК, РНК) и коферментов (НАД, НАДФ, ФАД, КоА,
кобаламин)дезоксирибоза
Это пример фуранозной формы углеводов
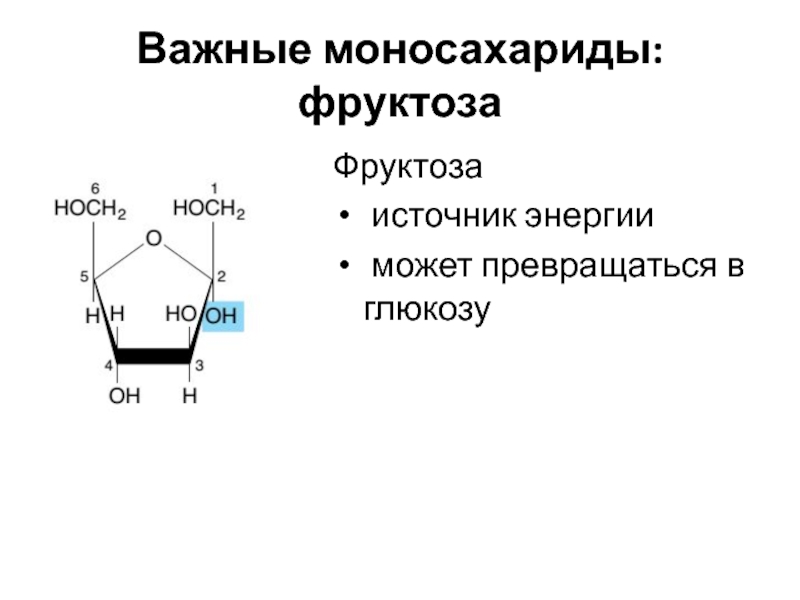
Слайд 9Важные моносахариды: глюкоза
Глюкоза:
основной источник энергии
предшественник всех других углеводов
входит в состав гликопротеинов
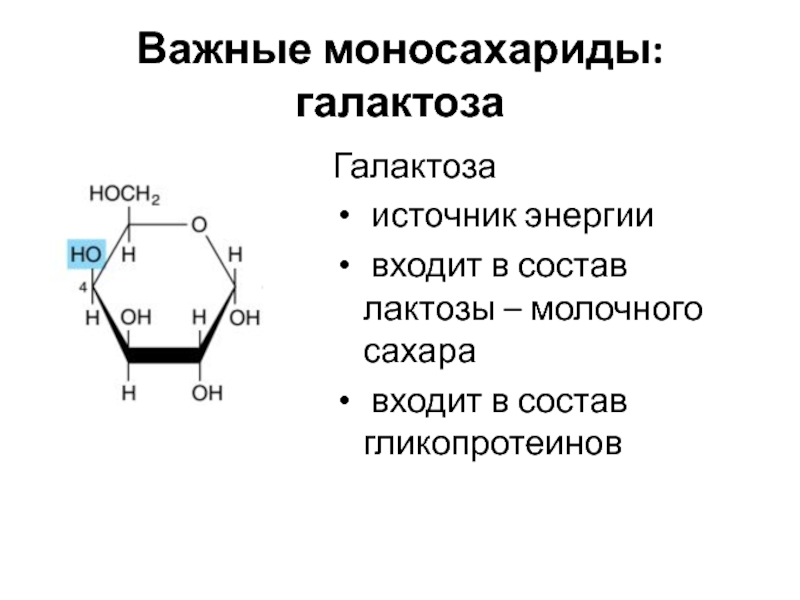
Слайд 11Важные моносахариды: галактоза
Галактоза
источник энергии
входит в состав лактозы –
молочного сахара
входит в состав гликопротеинов
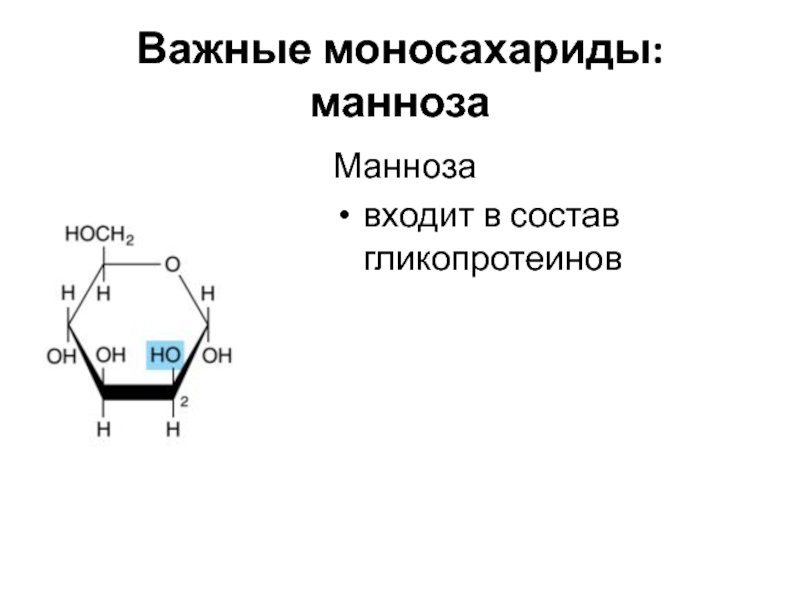
Слайд 13Важные моносахариды: ксилоза
Ксилоза
входит в состав гликопротеинов (гепарансульфат, хондроитинсульфат)
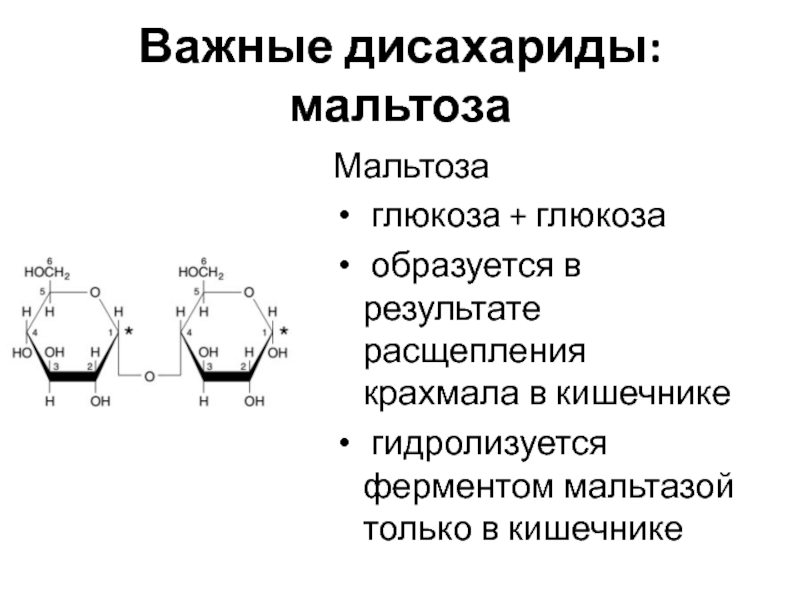
Слайд 14Важные дисахариды: мальтоза
Мальтоза
глюкоза + глюкоза
образуется в результате расщепления
крахмала в кишечнике
гидролизуется ферментом мальтазой только в кишечнике
Слайд 15Важные дисахариды: лактоза
Лактоза (молочный сахар)
галактоза + глюкоза
содержится в
молоке
гидролизуется ферментом лактазой только в кишечнике
недостаточность лактазы вызывает
непереносимость лактозыСлайд 16Важные дисахариды: сахароза
сахароза
глюкоза + фруктоза
содержится в растениях
гидролизуется
ферментом сахаразой только в кишечнике
Слайд 17Важные полисахариды: гликоген и крахмал
Гликоген (крахмал у растений)
состоит из
глюкозы
основная запасная форма углеводов
запасается в печени и мышцах
(наибольшее содержание) гликоген печени распадается с образованием глюкозы, которая затем идет в кровь (функция – поддержание уровня глюкозы в крови)
гликоген мышц распадается с образованием глюкозы, которая используется самими мышцами для работы
разветвленный, содержит 2 типа связей: 1-4 (на линейных участках) и 1-6 (в точках ветвления) гликозидные связи
Каждый кружок – молекула глюкозы
Слайд 18Переваривание углеводов
Сахараза, мальтаза и лактаза – ферменты класса гидролаз, которые
расщепляют соответствующие дисахариды до моносахаридов. Содержатся только в тонком кишечнике.
Поэтому расщепление дисахаридов до моносахаридов происходит только в тонком кишечникеАмилаза – фермент, расщепляющий крахмал и гликоген при переваривании в кишечнике
Амилаза есть и в слюне, но она работает недолго, так как пища быстро попадает в желудок, и амилаза инактивируется
Слайд 20АТФ: источник энергии для биохимических процессов
По химической структуре АТФ является
нуклеотидом:
аденин (азотистое основание) + рибоза (углевод) + три фосфата
Когда требуется
использовать энергию, от АТФ может отщепляться один (γ) или два (γ и β) концевых фосфатаВ результате образуется АДФ (аденозиндифосфат) или АМФ (аденозинмонофосфат)
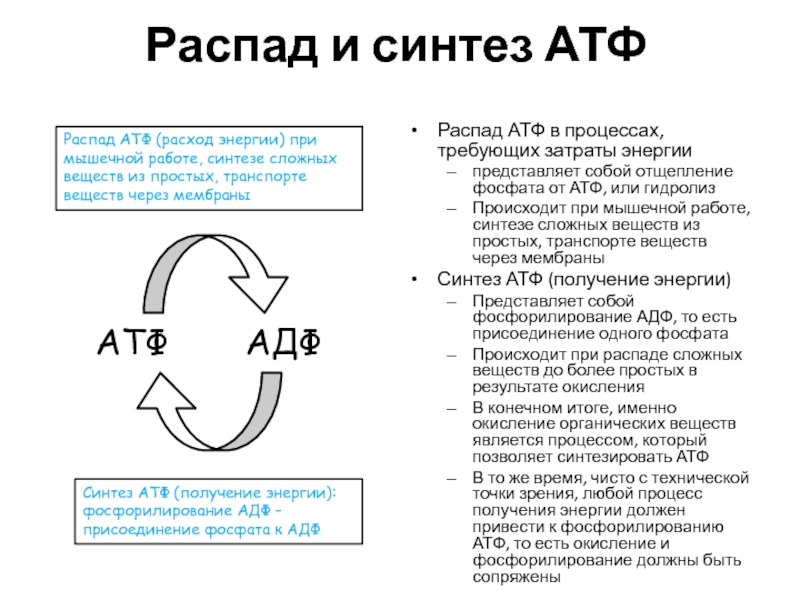
Слайд 21Распад и синтез АТФ
Распад АТФ в процессах, требующих затраты энергии
представляет
собой отщепление фосфата от АТФ, или гидролиз
Происходит при мышечной работе,
синтезе сложных веществ из простых, транспорте веществ через мембраныСинтез АТФ (получение энергии)
Представляет собой фосфорилирование АДФ, то есть присоединение одного фосфата
Происходит при распаде сложных веществ до более простых в результате окисления
В конечном итоге, именно окисление органических веществ является процессом, который позволяет синтезировать АТФ
В то же время, чисто с технической точки зрения, любой процесс получения энергии должен привести к фосфорилированию АТФ, то есть окисление и фосфорилирование должны быть сопряжены
АТФ
АДФ
Распад АТФ (расход энергии) при мышечной работе, синтезе сложных веществ из простых, транспорте веществ через мембраны
Синтез АТФ (получение энергии): фосфорилирование АДФ – присоединение фосфата к АДФ
Слайд 22Существует всего 2 способа синтеза АТФ (т.е. фосфорилирования АДФ)
1. Субстратное
фосфорилирование*
Сначала образуется органическая молекула, содержащая фосфатную группу, которую можно легко
перенести на АДФ с образованием АТФ (фосфорилирование)Такое промежуточное соединение называется макроэргическое, или соединение с высоким потенциалом переноса фосфатной группы
Макроэргические вещества:
все нуклеотидтрифосфаты (НТФ и дНТФ)
1,3-бисфосфоглицерат (1,3-БФГ)
фосфоенолпируват (ФЕП)
креатинфосфат (фосфокреатин)
сукцинил-КоА
ацетил-КоА
Встречается в нескольких метаболизческих процессах: в гликолизе, ЦТК, гликогенолизе
Не требует O2, быстрый процесс, дает мало энергии
2. Окислительное фосфорилирование*
Присоединение неорганического фосфата к АДФ с образованием АТФ
Всегда происходит в митохондриях – только один фермент (АТФсинтаза) способен катализировать окислительное фосфорилирование
Требует O2, медленный процесс, дает много энергии (основной способ получения энергии клетками)
* если совсем точно, то «субстратное фосфорилирование АДФ» и «окислительное фосфорилирование АДФ» но «АДФ» всегда пропускают, как само собой разумеющееся, так как в 99% случаев речь идет именно об АДФ
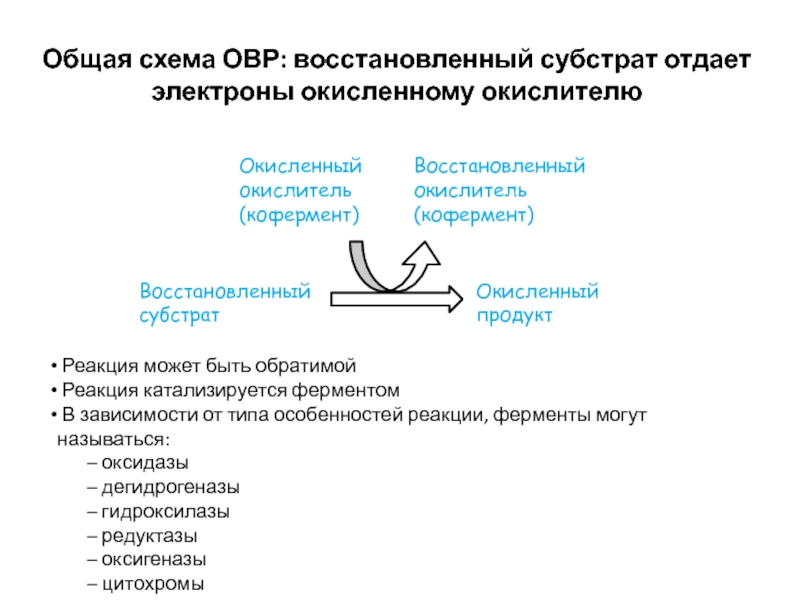
Слайд 24Общая схема ОВР: восстановленный субстрат отдает электроны окисленному окислителю
Восстановленный субстрат
Окисленный
продукт
Окисленный окислитель (кофермент)
Восстановленный окислитель (кофермент)
Реакция может быть обратимой
Реакция
катализируется ферментомВ зависимости от типа особенностей реакции, ферменты могут называться:
оксидазы
дегидрогеназы
гидроксилазы
редуктазы
оксигеназы
цитохромы
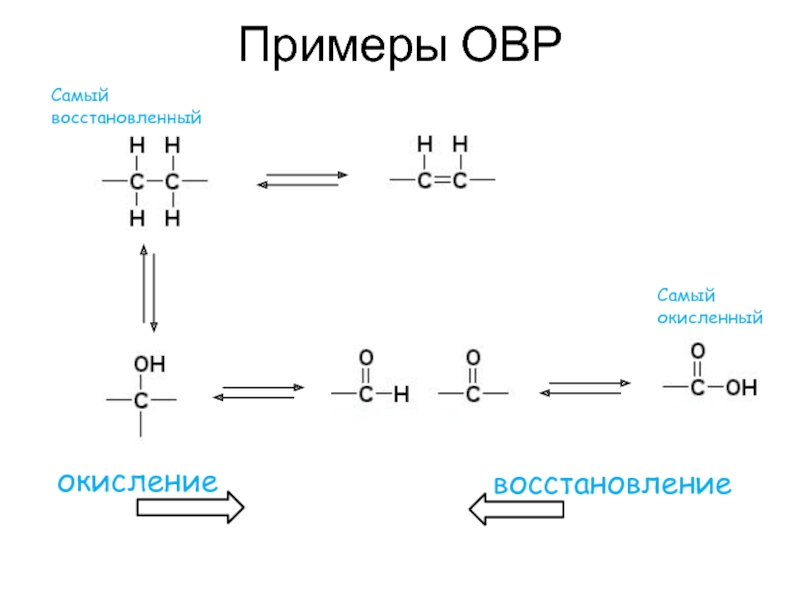
Слайд 25ОВР (окислительно-восстановительные реакции в биохимии)
В качестве одного из участников реакции
часто выступает кофермент, принимающий или отдающий электроны
Распространенные коферменты (окисленная
/ восстановленная формы)НАД+/НАДН
НАДФ+/НАДФН
ФАД/ФАДН2
ФМН/ФМНН2
Н4-БП (тетрагидробиопетрин) / Н2-БП
металлы
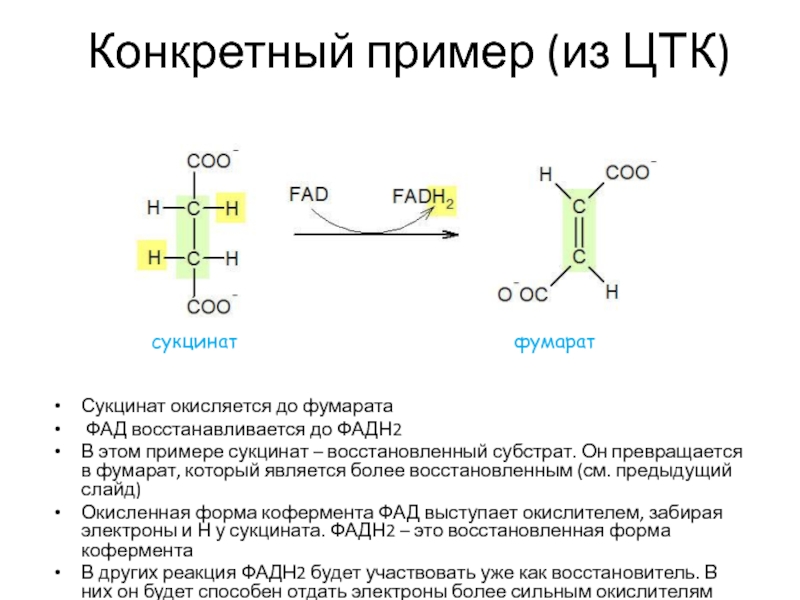
Слайд 27Конкретный пример (из ЦТК)
Сукцинат окисляется до фумарата
ФАД восстанавливается до
ФАДН2
В этом примере сукцинат – восстановленный субстрат. Он превращается в
фумарат, который является более восстановленным (см. предыдущий слайд)Окисленная форма кофермента ФАД выступает окислителем, забирая электроны и Н у сукцината. ФАДН2 – это восстановленная форма кофермента
В других реакция ФАДН2 будет участвовать уже как восстановитель. В них он будет способен отдать электроны более сильным окислителям
сукцинат
фумарат
Слайд 29Схема:
Функции
энергетическая
промежуточные метаболиты гликолиза используются в синтезе аминокислот и липидов
Внутриклеточная
локализация: цитозоль
Тканевая локализация: все ткани
глюкоза
пируват
АТФ
НАДН
…
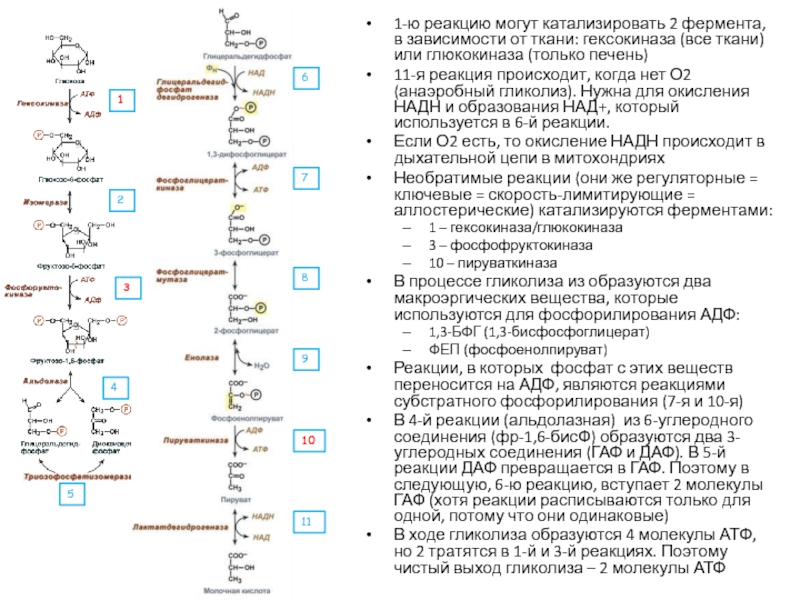
Слайд 301-ю реакцию могут катализировать 2 фермента, в зависимости от ткани:
гексокиназа (все ткани) или глюкокиназа (только печень)
11-я реакция происходит, когда
нет О2 (анаэробный гликолиз). Нужна для окисления НАДН и образования НАД+, который используется в 6-й реакции.Если О2 есть, то окисление НАДН происходит в дыхательной цепи в митохондриях
Необратимые реакции (они же регуляторные = ключевые = скорость-лимитирующие = аллостерические) катализируются ферментами:
1 – гексокиназа/глюкокиназа
3 – фосфофруктокиназа
10 – пируваткиназа
В процессе гликолиза из образуются два макроэргических вещества, которые используются для фосфорилирования АДФ:
1,3-БФГ (1,3-бисфосфоглицерат)
ФЕП (фосфоенолпируват)
Реакции, в которых фосфат с этих веществ переносится на АДФ, являются реакциями субстратного фосфорилирования (7-я и 10-я)
В 4-й реакции (альдолазная) из 6-углеродного соединения (фр-1,6-бисФ) образуются два 3-углеродных соединения (ГАФ и ДАФ). В 5-й реакции ДАФ превращается в ГАФ. Поэтому в следующую, 6-ю реакцию, вступает 2 молекулы ГАФ (хотя реакции расписываются только для одной, потому что они одинаковые)
В ходе гликолиза образуются 4 молекулы АТФ, но 2 тратятся в 1-й и 3-й реакциях. Поэтому чистый выход гликолиза – 2 молекулы АТФ
1
2
3
4
5
6
7
8
9
10
11
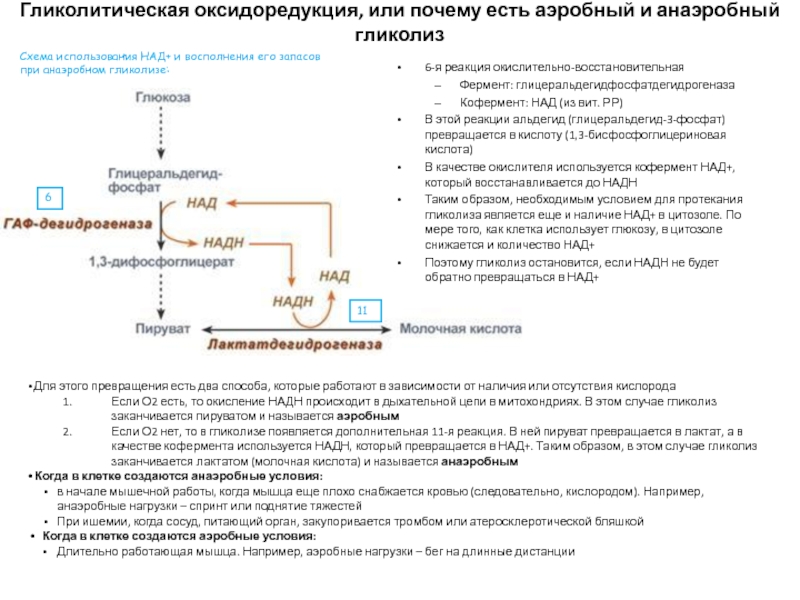
Слайд 31Гликолитическая оксидоредукция, или почему есть аэробный и анаэробный гликолиз
6-я реакция
окислительно-восстановительная
Фермент: глицеральдегидфосфатдегидрогеназа
Кофермент: НАД (из вит. РР)
В этой реакции альдегид (глицеральдегид-3-фосфат)
превращается в кислоту (1,3-бисфосфоглицериновая кислота)В качестве окислителя используется кофермент НАД+, который восстанавливается до НАДН
Таким образом, необходимым условием для протекания гликолиза является еще и наличие НАД+ в цитозоле. По мере того, как клетка использует глюкозу, в цитозоле снижается и количество НАД+
Поэтому гликолиз остановится, если НАДН не будет обратно превращаться в НАД+
Для этого превращения есть два способа, которые работают в зависимости от наличия или отсутствия кислорода
Если О2 есть, то окисление НАДН происходит в дыхательной цепи в митохондриях. В этом случае гликолиз заканчивается пируватом и называется аэробным
Если О2 нет, то в гликолизе появляется дополнительная 11-я реакция. В ней пируват превращается в лактат, а в качестве кофермента используется НАДН, который превращается в НАД+. Таким образом, в этом случае гликолиз заканчивается лактатом (молочная кислота) и называется анаэробным
Когда в клетке создаются анаэробные условия:
в начале мышечной работы, когда мышца еще плохо снабжается кровью (следовательно, кислородом). Например, анаэробные нагрузки – спринт или поднятие тяжестей
При ишемии, когда сосуд, питающий орган, закупоривается тромбом или атеросклеротической бляшкой
Когда в клетке создаются аэробные условия:
Длительно работающая мышца. Например, аэробные нагрузки – бег на длинные дистанции
6
11
Схема использования НАД+ и восполнения его запасов при анаэробном гликолизе:
Слайд 33Глюконеогенез - синтез глюкозы из неуглеводных предшественников («субстратов глюконеогенеза»)
Схема:
Функции:
поддержание
концентрации глюкозы в крови в перерывах между приемами пищи и
при голоданииполучение глюкозы для дальнейшего синтеза из нее других углеводов (фруктозы, галактозы)
Внутриклеточная локализация: цитозоль и митохондрии клеток печени
Тканевая локализация: только в печени
Пируват, лактат
Аминокислоты (аланин, глутамат, аспартат и др.)
Глицерин
Оксалоацетат
глюкоза
…
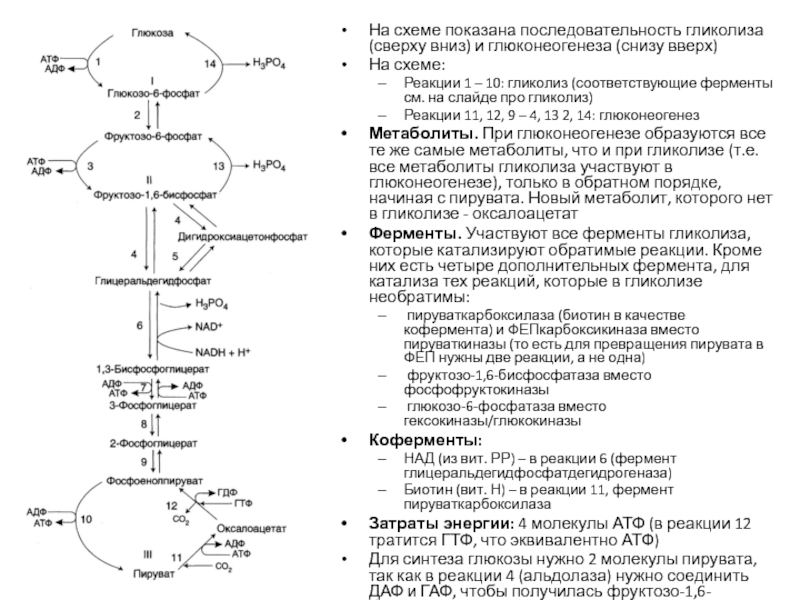
Слайд 34На схеме показана последовательность гликолиза (сверху вниз) и глюконеогенеза (снизу
вверх)
На схеме:
Реакции 1 – 10: гликолиз (соответствующие ферменты см. на
слайде про гликолиз)Реакции 11, 12, 9 – 4, 13 2, 14: глюконеогенез
Метаболиты. При глюконеогенезе образуются все те же самые метаболиты, что и при гликолизе (т.е. все метаболиты гликолиза участвуют в глюконеогенезе), только в обратном порядке, начиная с пирувата. Новый метаболит, которого нет в гликолизе - оксалоацетат
Ферменты. Участвуют все ферменты гликолиза, которые катализируют обратимые реакции. Кроме них есть четыре дополнительных фермента, для катализа тех реакций, которые в гликолизе необратимы:
пируваткарбоксилаза (биотин в качестве кофермента) и ФЕПкарбоксикиназа вместо пируваткиназы (то есть для превращения пирувата в ФЕП нужны две реакции, а не одна)
фруктозо-1,6-бисфосфатаза вместо фосфофруктокиназы
глюкозо-6-фосфатаза вместо гексокиназы/глюкокиназы
Коферменты:
НАД (из вит. РР) – в реакции 6 (фермент глицеральдегидфосфатдегидрогеназа)
Биотин (вит. Н) – в реакции 11, фермент пируваткарбоксилаза
Затраты энергии: 4 молекулы АТФ (в реакции 12 тратится ГТФ, что эквивалентно АТФ)
Для синтеза глюкозы нужно 2 молекулы пирувата, так как в реакции 4 (альдолаза) нужно соединить ДАФ и ГАФ, чтобы получилась фруктозо-1,6-бисфосфат. Из одной молекулы пирувата образуется ДАФ, а из другой – ГАФ
Слайд 36Схема
Функции:
энергетическая
связь между гликолизом и ЦТК
Внутриклеточная локализация: митохондрии
Тканевая локализация:
все ткани, в которых есть митохондрии
пируват
Ацетил-КоА
Слайд 37В результате реакции от пирувата отщепляется карбоксильная группа, которая уходит
в форме СО2. Оставшиеся два атома углерода (ацетат, т.е. уксусная
кислота) присоединяются к коферменту А. В результате получается ацетил-КоАФермент: пируватдегидрогеназный комплекс
Состоит из 3 ферментов и включает в себя 5 коферментов:
ТПФ(тиаминпирофосфат), из витамина В1 (тиамин)
Липоевая кислота
КоА (кофермент А), из витамина В3 (пантотеновая кислота)
ФАД (флавинадениндинуклеотд), из витамина В2 (рибофлавин)
НАД (никотинамидадениндинуклеотид), из витамина РР (никотиновая кислота)
Для работы ферментного комплекса необходимы все коферменты. Без любого из них работа останавливается
В частности, недостаточность тиамина (при алкоголизме) приводит к тому, что пируват не превращается в ацетил-КоА. Следовательно, становится невозможным дальнейшее получение энергии из пирувата (в конечном счете, из глюкозы, так как основным источником пирувата является глюкоза), клетка переходит на другие источники энергии (липиды). Пируват накапливается внутри клеток, потом выходит в кровь
Получившийся в реакции ацетил-КоА далее вступает в ЦТК
Слайд 39Схема:
Функции:
Энергетическая
Связь метаболизма аминокислот, углеводов и липидов
Внутриклеточная локализация: матрикс митохондрий
Тканевая локализация:
все клетки, в которых есть митохондрии
Ацетил-КоА
3 АТФ
3 АТФ
3 АТФ
2 АТФ
1
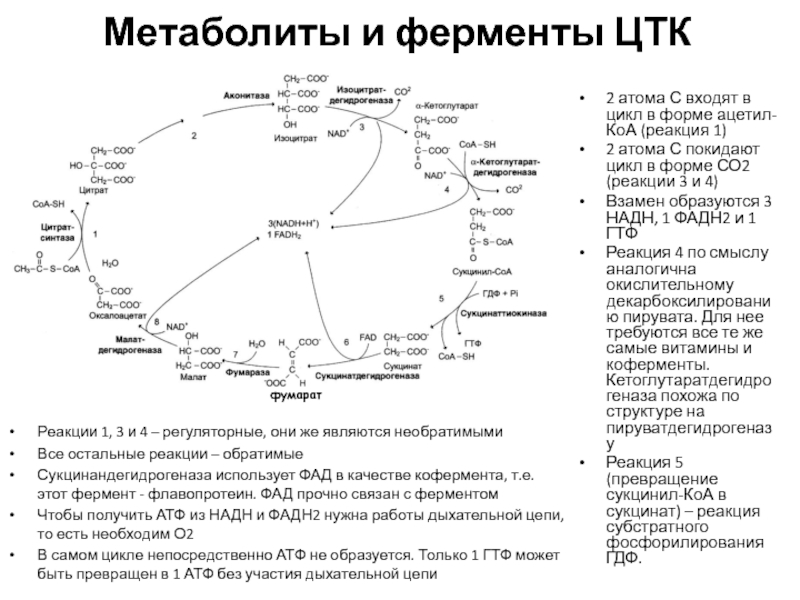
АТФСлайд 40Метаболиты и ферменты ЦТК
2 атома С входят в цикл в
форме ацетил-КоА (реакция 1)
2 атома С покидают цикл в форме
СО2 (реакции 3 и 4)Взамен образуются 3 НАДН, 1 ФАДН2 и 1 ГТФ
Реакция 4 по смыслу аналогична окислительному декарбоксилированию пирувата. Для нее требуются все те же самые витамины и коферменты. Кетоглутаратдегидрогеназа похожа по структуре на пируватдегидрогеназу
Реакция 5 (превращение сукцинил-КоА в сукцинат) – реакция субстратного фосфорилирования ГДФ.
фумарат
Реакции 1, 3 и 4 – регуляторные, они же являются необратимыми
Все остальные реакции – обратимые
Сукцинандегидрогеназа использует ФАД в качестве кофермента, т.е. этот фермент - флавопротеин. ФАД прочно связан с ферментом
Чтобы получить АТФ из НАДН и ФАДН2 нужна работы дыхательной цепи, то есть необходим О2
В самом цикле непосредственно АТФ не образуется. Только 1 ГТФ может быть превращен в 1 АТФ без участия дыхательной цепи
Слайд 42Схема:
Функция: энергетическая (большая часть АТФ синтезируется этим путем)
Внутриклеточная локализация: митохондрии
Тканевая
локализация: все ткани, где есть митохондрии
НАДН
ФАДН2
Ферменты дыхательной цепи
Градиент протонов (ΔμН+)
Фермент
АТФсинтазаАТФ
АДФ + Ф
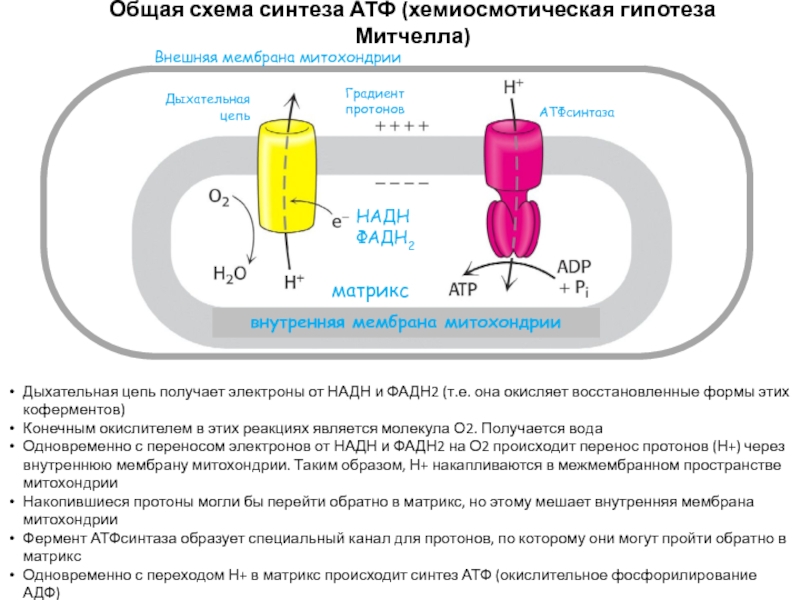
Слайд 43Общая схема синтеза АТФ (хемиосмотическая гипотеза Митчелла)
НАДН
ФАДН2
Дыхательная цепь
Градиент протонов
АТФсинтаза
Внешняя мембрана
митохондрии
внутренняя мембрана митохондрии
матрикс
Дыхательная цепь получает электроны от НАДН и ФАДН2
(т.е. она окисляет восстановленные формы этих коферментов)Конечным окислителем в этих реакциях является молекула О2. Получается вода
Одновременно с переносом электронов от НАДН и ФАДН2 на О2 происходит перенос протонов (Н+) через внутреннюю мембрану митохондрии. Таким образом, Н+ накапливаются в межмембранном пространстве митохондрии
Накопившиеся протоны могли бы перейти обратно в матрикс, но этому мешает внутренняя мембрана митохондрии
Фермент АТФсинтаза образует специальный канал для протонов, по которому они могут пройти обратно в матрикс
Одновременно с переходом Н+ в матрикс происходит синтез АТФ (окислительное фосфорилирование АДФ)
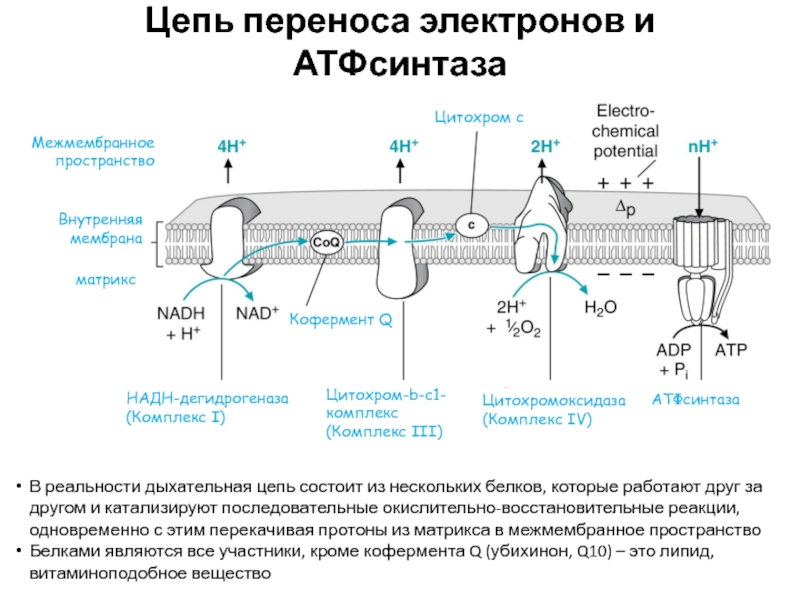
Слайд 44Цепь переноса электронов и АТФсинтаза
В реальности дыхательная цепь состоит из
нескольких белков, которые работают друг за другом и катализируют последовательные
окислительно-восстановительные реакции, одновременно с этим перекачивая протоны из матрикса в межмембранное пространствоБелками являются все участники, кроме кофермента Q (убихинон, Q10) – это липид, витаминоподобное вещество
НАДН-дегидрогеназа
(Комплекс I)
Цитохром-b-c1-комплекс
(Комплекс III)
Цитохромоксидаза
(Комплекс IV)
АТФсинтаза
матрикс
Межмембранное пространство
Внутренняя мембрана
Цитохром с
Кофермент Q
Слайд 45Подробное описание работы дыхательной цепи
Комплекс I окисляет НАДН и восстанавливается
(и выкачивает протоны из матрикса)
↓
Кофермент Q окисляет Комплекс I и
восстанавливается↓
Комплекс III окисляет Кофермент Q и восстанавливается (и выкачивает протоны из матрикса)
↓
Комплекс IV окисляет Комплекс III и восстанавливается (и выкачивает протоны из матрикса)
↓
Кислород окисляет Комплекс IV и восстанавливается (образование H2O) (и выкачивает протоны из матрикса)
Таким образом, каждый из участников передает электрон другому, который стоит в цепи переноса электронов после него
После передачи электрона каждый участник снова готов принять еще электроны
Слайд 47Схема:
Функция:
Запасание энергии (синтез гликогена)
Получение энергии и поддержание постоянной концентрации глюкозы
в крови (распад гликогена)
Внутриклеточная локализация: цитозоль
Тканевая локализация: все ткани, в
особенности:Мышцы (из гликогена образуется глюкозо-6-фосфат, который идет в гликолиз – используют гликоген как источник энергии для себя)
Печень (из гликогена образуется глюкозо-6-фосфат, а потом – глюкоза, которая идет в кровь – поддержание концентрации глюкозы в крови)
Глюкозо-6-Ф
…
Глюкозо-1-Ф
гликоген
УТФ
…
Слайд 48Гликоген: структура и особенности синтеза и распада
Молекула гликогена разветвленная, поэтому
в его структуре есть два типа связей:
1-4 гликозидные (точки ветвления)
1-6
гликозидные (линейные участки)Когда гликоген синтезируется, необходимо минимум 2 фермента, которые будут катализировать образование связей этих двух типов. Эти ферменты:
Гликогенсинтаза (1-4 связи)
Ветвящий фермент (1-6 связи)
Аналогично, при распаде гликогена, нужно минимум 2 фермента, которые будут катализировать разрыв связей этих двух типов
Гликогенфосфорилаза (1-4 связи)
Деветвящий фермент (1-6 связи)
форма молекулы:
Подробная структура небольшого участка этой молекулы:
1-6
1-4
С этих концов идет разрушение и синтез гликогена
Разрушение и рост молекулы всегда происходят с ее концов, и никогда с середины
Благодаря тому, что концов у молекулы много, рост и разрушение происходит одновременно со всех концов. Следовательно, это происходит быстро
глюкоза
Слайд 49В пространстве молекула гликогена похожа на сферу (гранулы гликогена)
Ветви гликогена
в гранулах уложены в 12 слоев
На рисунке схематично показаны границы
4 внутренних слоевКогда размер молекулы гликогена меняется, фактически изменяется количество слоев
Когда гликоген распадается, это означает, что уменьшается количество слоев в грануле
Когда гликоген синтезируется, это означает, что увеличивается количество слоев в грануле
В то же время, в организме постоянно образуются новые гранулы гликогена и исчезают старые, но эти процессы мы не рассматриваем
Слайд 50Этапы синтеза гликогена
В клетке всегда существуют небольшие молекулы гликогена, имеющие
несколько веточек, которые можно удлинять (откуда берутся они, мы не
обсуждаем). Поэтому мы не говорим о синтезе молекулы гликогена «с нуля», а говорим об удлинении существующих молекулСинтез глюкозо-1-фосфата
Активация глюкозы (синтез УДФ-глюкозы)
Удлинение молекулы гликогена
Ветвление молекулы гликогена
Слайд 51Синтез гликогена
1. Синтез глюкозо-1-фосфата
Внутри клетки вся глюкоза находится в фосфорилированной
форме (глюкозо-6-фосфат = г-6-Ф). Этот г-6-Ф может использоваться в разных
метаболических путях (гликолиз, пентозофосфатный путь, синтез гликогена или других углеводов)Та глюкоза (г-6-Ф), которая должна пойти на синтез гликогена, сначала переводится в форму глюкозо-1-фосфата (г-1-Ф). Таким образом это позволяет отделить эту глюкозу от все остальной, которая есть в клетке, и не использовать ее в других метаболических путях
Фермент: фосфоглюкомутаза. Может катализировать реакцию в обоих направлениях, т.е. реакция обратима
Фосфат в 6-м положении
Фосфат в 1-м положении
Глюкозо-6-фосфат
Глюкозо-1-фосфат
Слайд 52Синтез гликогена
2. Активация глюкозы (синтез УДФ-глюкозы)
Теперь нужно активировать молекулу глюкозы,
чтобы она могла присоединиться к молекуле гликогена
Для этого к глюкозо-1-фосфату
присоединяется нуклеотид (уридиловый) и образуется УДФ-глюкоза (уридиндифосфатглюкоза)Фермент: глюкозо-1-фосфатуридилтрансфераза (= УДФ-глюкопирофосфорилаза)
За счет того, что теперь в 1-м положении к глюкозе присоединен нуклеотид, это положение становится активированным. Поэтому на следующем этапе это 1-е положение глюкозы будет участвовать в образовании связи с молекулой гликогена
Глюкозо-1-фосфат
УТФ
УДФ-глюкоза
пирофосфат
Слайд 53Синтез гликогена
3. Удлинение молекулы гликогена
На рисунке урацил в составе УДФ-глюкозы
не нарисован, а просто подписан
Активированная на предыдущем этапе глюкоза теперь
присоединяется к короткой молекуле гликогенаЗа счет отсоединения нуклеотида от глюкозы, присоединение новой глюкозы к гликогену происходит легко
Фермент: гликогенсинтаза. Это регуляторный фермент. От скорости его работы зависит скорость синтеза гликогена.
Рост цепи гликогена происходит путем последовательного добавления новых глюкозных звеньев
Каждая из включенных в гликоген глюкоз сначала превращается в УДФ-глюкозу (см. этап 2)
УДФ-глюкоза
Конец ветки молекулы гликогена
гликогенсинтаза
Эта глюкоза будет включена в цепь гликогена
Ветка гликогена удлинилась на 1 молекулу глюкозы
Слайд 54Синтез гликогена
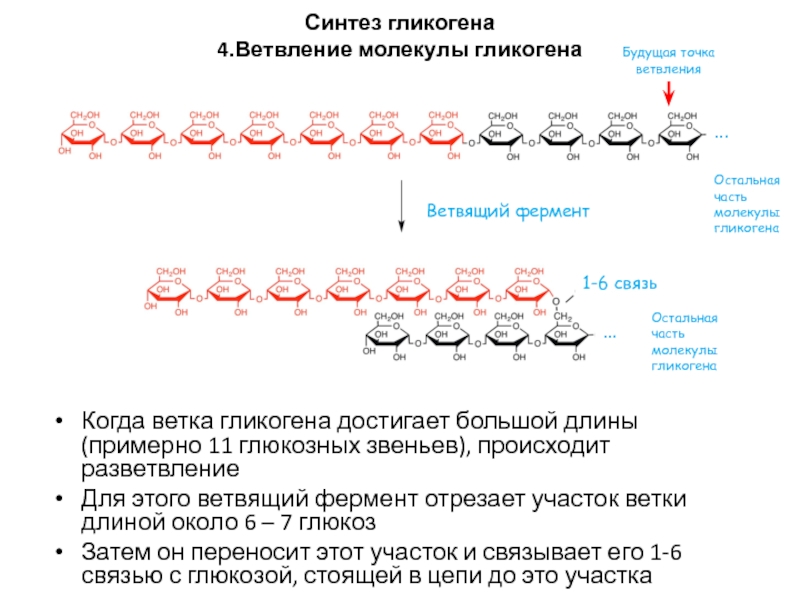
4.Ветвление молекулы гликогена
Когда ветка гликогена достигает большой длины
(примерно 11 глюкозных звеньев), происходит разветвление
Для этого ветвящий фермент отрезает
участок ветки длиной около 6 – 7 глюкозЗатем он переносит этот участок и связывает его 1-6 связью с глюкозой, стоящей в цепи до это участка
Ветвящий фермент
Будущая точка ветвления
1-6 связь
Остальная часть молекулы гликогена
…
Остальная часть молекулы гликогена
…
Слайд 55Этапы распада гликогена
Ферменты укорачивают отдельные ветки молекул гликогена или удаляют
некоторые из этих веток полностью. Но та часть молекулы гликогена,
которая находится в самом центре, не исчезает (точнее, мы про это не говорим). Поэтому, говоря о распаде гликогена, мы имеем ввиду уменьшение молекулы гликогена, но не ее полное исчезновениеУкорачивание линейных участков (фосфоролиз = фосфоролитическое расщепление) с образованием глюкозо-1-фосфата
Превращение глюкозо-1-фосфата в глюкозо-6-фосфат и его дальнейшая судьба
Удаление точек ветвления
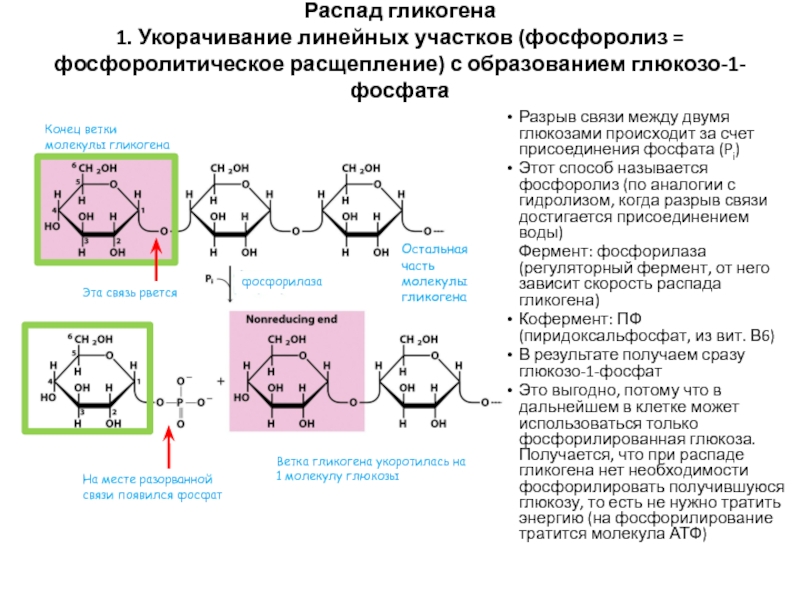
Слайд 56Распад гликогена 1. Укорачивание линейных участков (фосфоролиз = фосфоролитическое расщепление) с
образованием глюкозо-1-фосфата
Разрыв связи между двумя глюкозами происходит за счет присоединения
фосфата (Pi)Этот способ называется фосфоролиз (по аналогии с гидролизом, когда разрыв связи достигается присоединением воды)
Фермент: фосфорилаза (регуляторный фермент, от него зависит скорость распада гликогена)
Кофермент: ПФ (пиридоксальфосфат, из вит. В6)
В результате получаем сразу глюкозо-1-фосфат
Это выгодно, потому что в дальнейшем в клетке может использоваться только фосфорилированная глюкоза. Получается, что при распаде гликогена нет необходимости фосфорилировать получившуюся глюкозу, то есть не нужно тратить энергию (на фосфорилирование тратится молекула АТФ)
Конец ветки молекулы гликогена
Ветка гликогена укоротилась на 1 молекулу глюкозы
Остальная часть молекулы гликогена
Эта связь рвется
На месте разорванной связи появился фосфат
фосфорилаза
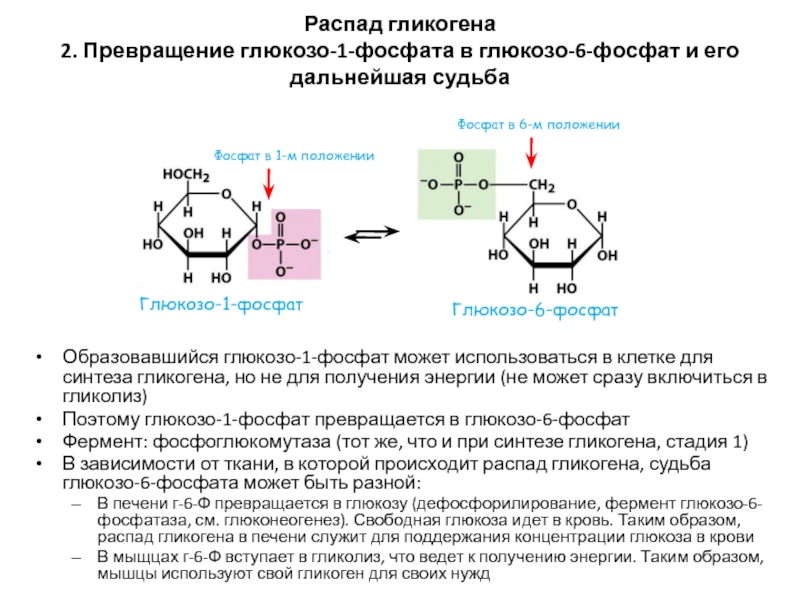
Слайд 57Распад гликогена
2. Превращение глюкозо-1-фосфата в глюкозо-6-фосфат и его дальнейшая судьба
Образовавшийся
глюкозо-1-фосфат может использоваться в клетке для синтеза гликогена, но не
для получения энергии (не может сразу включиться в гликолиз)Поэтому глюкозо-1-фосфат превращается в глюкозо-6-фосфат
Фермент: фосфоглюкомутаза (тот же, что и при синтезе гликогена, стадия 1)
В зависимости от ткани, в которой происходит распад гликогена, судьба глюкозо-6-фосфата может быть разной:
В печени г-6-Ф превращается в глюкозу (дефосфорилирование, фермент глюкозо-6-фосфатаза, см. глюконеогенез). Свободная глюкоза идет в кровь. Таким образом, распад гликогена в печени служит для поддержания концентрации глюкоза в крови
В мыщцах г-6-Ф вступает в гликолиз, что ведет к получению энергии. Таким образом, мышцы используют свой гликоген для своих нужд
Фосфат в 6-м положении
Фосфат в 1-м положении
Глюкозо-6-фосфат
Глюкозо-1-фосфат
Слайд 58Распад гликогена
3. Удаление точек ветвления
Красным показаны звенья (глюкозы), которые удаляются
фосфорилазой (см. этап 1)
Не доходя до разветвления, фосфорилаза останавливается, так
как в развилку она пройти не может. Следовательно, она не может расщепить 1-4 связи между глюкозными звеньями, находящимися недалеко от развилкиТеперь деветвящий фермент переносит 3 глюкозы (синие) с одной ветки на другую
После этого оставшаяся глюкоза (зеленая), связанная 1-6 связью, отщепляется тем же деветвящим ферментом
Таким образом, у деветвящего фермента есть 2 активности:
Может переносить три остатка глюкозы
Может расщеплять 1-6 связь
Расщепление 1-6 связи происходит путем гидролиза, то есть в результате образуется свободная глюкоза
Деветвящий фермент переносит
Деветвящий фермент расщепляет
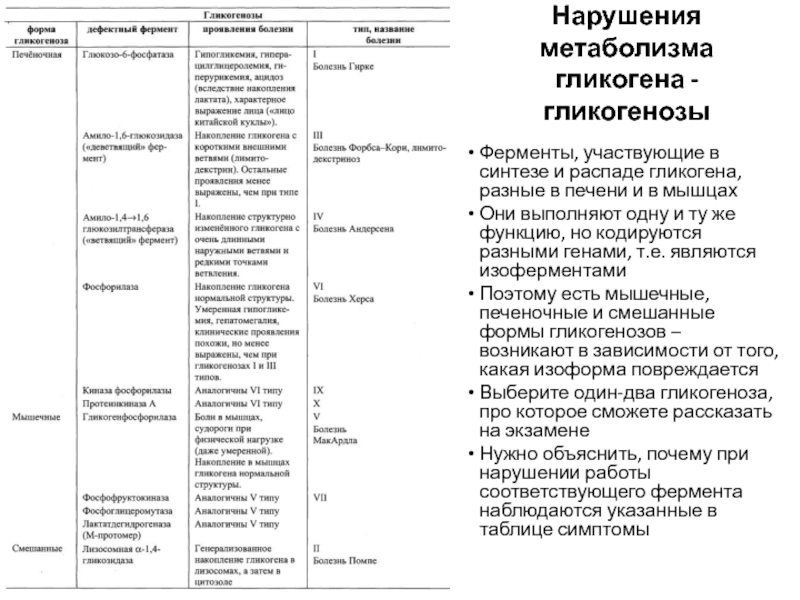
Слайд 59Нарушения метаболизма гликогена - гликогенозы
Ферменты, участвующие в синтезе и распаде
гликогена, разные в печени и в мышцах
Они выполняют одну и
ту же функцию, но кодируются разными генами, т.е. являются изоферментамиПоэтому есть мышечные, печеночные и смешанные формы гликогенозов – возникают в зависимости от того, какая изоформа повреждается
Выберите один-два гликогеноза, про которое сможете рассказать на экзамене
Нужно объяснить, почему при нарушении работы соответствующего фермента наблюдаются указанные в таблице симптомы
Слайд 61Схема:
Функции
Образование рибозы для синтеза нуклеотидов
Образование НАДФН для синтеза липидов и
защиты от свободных радикалов
Внутриклеточная локализация: цитозоль
Тканевая локализация: все ткани, особенно
те, в которых активно происходит синтез липидов и нуклеотидов (эпителии, железы, печень, эмбриональные ткани)глюкозо-6-ф
…
рибозо-5-ф
НАДФН
…
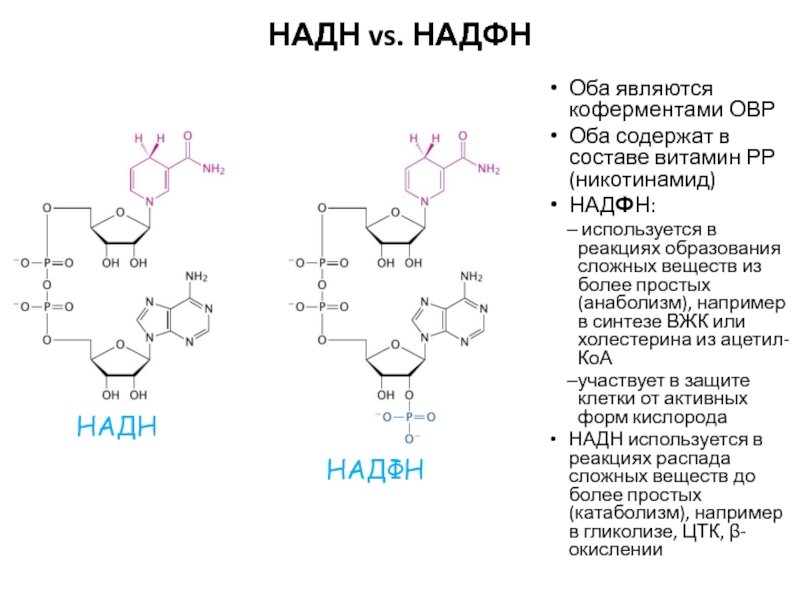
Слайд 62НАДН vs. НАДФН
Оба являются коферментами ОВР
Оба содержат в составе витамин
РР (никотинамид)
НАДФН:
используется в реакциях образования сложных веществ из более
простых (анаболизм), например в синтезе ВЖК или холестерина из ацетил-КоАучаствует в защите клетки от активных форм кислорода
НАДН используется в реакциях распада сложных веществ до более простых (катаболизм), например в гликолизе, ЦТК, β-окислении
НАДФН
НАДН
Слайд 63Две стадии:
Окислительная: глюкозо-6-фосфат (С6) превращается в рибулозо-5-фосфат (С5), образуются 2
НАДФН
Неокислительная: рибулозо-5-фосфат (С5) превращается обратно в глюкозо-6-фосфат (С6) путем перестановок
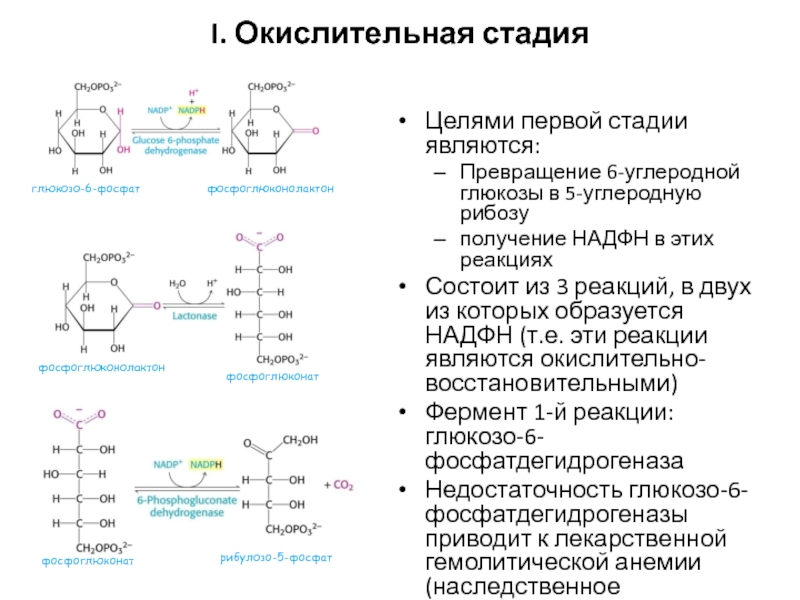
дву- и трехуглеродных фрагментовСлайд 64I. Окислительная стадия
Целями первой стадии являются:
Превращение 6-углеродной глюкозы в 5-углеродную
рибозу
получение НАДФН в этих реакциях
Состоит из 3 реакций, в двух
из которых образуется НАДФН (т.е. эти реакции являются окислительно-восстановительными)Фермент 1-й реакции: глюкозо-6-фосфатдегидрогеназа
Недостаточность глюкозо-6-фосфатдегидрогеназы приводит к лекарственной гемолитической анемии (наследственное заболевание)
глюкозо-6-фосфат
фосфоглюконолактон
фосфоглюконолактон
фосфоглюконат
фосфоглюконат
рибулозо-5-фосфат
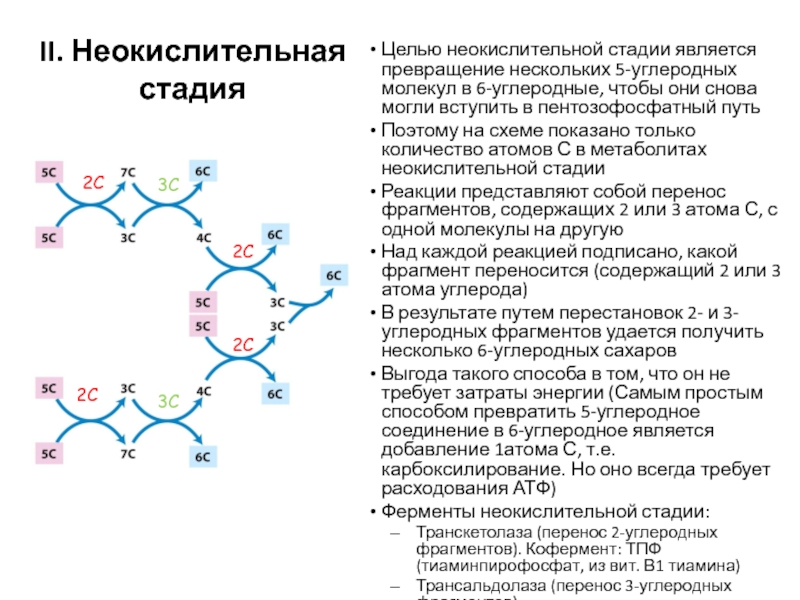
Слайд 65Целью неокислительной стадии является превращение нескольких 5-углеродных молекул в 6-углеродные,
чтобы они снова могли вступить в пентозофосфатный путь
Поэтому на схеме
показано только количество атомов С в метаболитах неокислительной стадииРеакции представляют собой перенос фрагментов, содержащих 2 или 3 атома С, с одной молекулы на другую
Над каждой реакцией подписано, какой фрагмент переносится (содержащий 2 или 3 атома углерода)
В результате путем перестановок 2- и 3-углеродных фрагментов удается получить несколько 6-углеродных сахаров
Выгода такого способа в том, что он не требует затраты энергии (Самым простым способом превратить 5-углеродное соединение в 6-углеродное является добавление 1атома С, т.е. карбоксилирование. Но оно всегда требует расходования АТФ)
Ферменты неокислительной стадии:
Транскетолаза (перенос 2-углеродных фрагментов). Кофермент: ТПФ (тиаминпирофосфат, из вит. В1 тиамина)
Трансальдолаза (перенос 3-углеродных фрагментов)
II. Неокислительная стадия
2С
2С
2С
2С
3С
3С
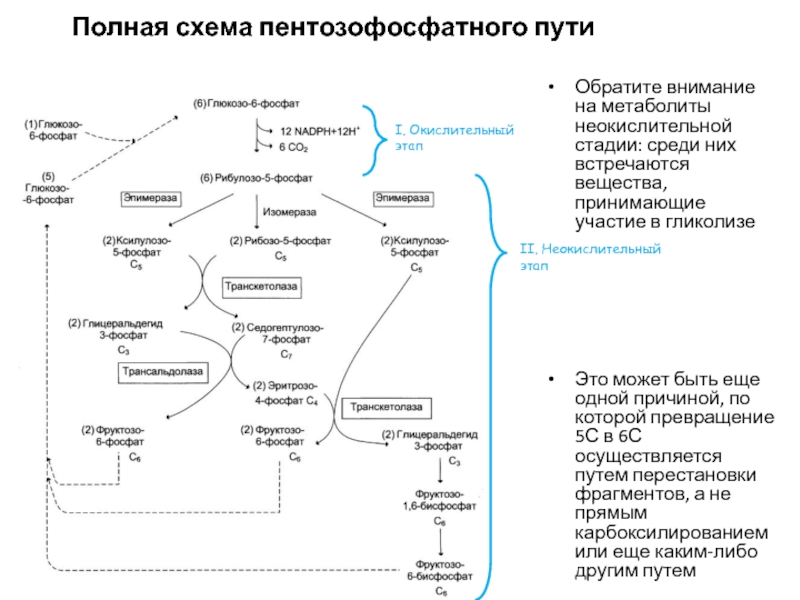
Слайд 66Полная схема пентозофосфатного пути
Обратите внимание на метаболиты неокислительной стадии: среди
них встречаются вещества, принимающие участие в гликолизе
Это может быть еще
одной причиной, по которой превращение 5С в 6С осуществляется путем перестановки фрагментов, а не прямым карбоксилированием или еще каким-либо другим путемI. Окислительный этап
II. Неокислительный этап
Слайд 67Нарушения пентозофосфатного пути
Наследственное заболевание, связанное с нарушением работы пентозофосфатного пути:
лекарственная гемолитическая анемия
Фермент, снижение активности которого наблюдается: глюкозо-6-фосфатдегидрогеназа
Последствия: снижение количества
НАДФН и, как следствие этого, восстановленного глутатиона в эритроцитах (см. следующий слайд)Недостаток восстановленного глутатиона приводит к тому, что при увеличении количества свободных радикалов клетка не может с ними справиться
В результате клетка разрушается, в случае эритроцитов это выглядит как гемолиз
Повышение количества свободных радикалов может быть вызвано приемом лекарственных препаратов или употреблением в пищу некоторых растений (бобов)
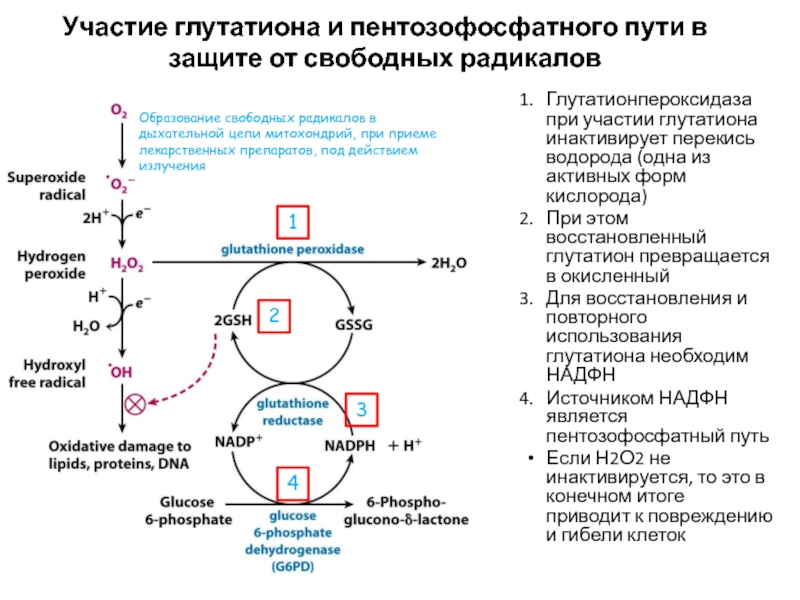
Слайд 68Участие глутатиона и пентозофосфатного пути в защите от свободных радикалов
Глутатионпероксидаза
при участии глутатиона инактивирует перекись водорода (одна из активных форм
кислорода)При этом восстановленный глутатион превращается в окисленный
Для восстановления и повторного использования глутатиона необходим НАДФН
Источником НАДФН является пентозофосфатный путь
Если Н2О2 не инактивируется, то это в конечном итоге приводит к повреждению и гибели клеток
1
2
3
4
Образование свободных радикалов в дыхательной цепи митохондрий, при приеме лекарственных препаратов, под действием излучения
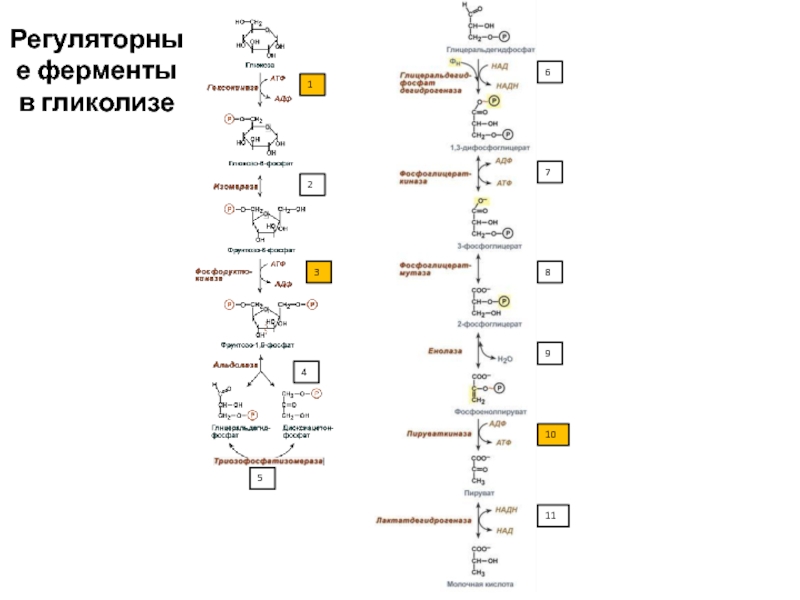
Слайд 70Регуляторные ферменты
В любом метаболическом пути есть два типа ферментов (с
точки зрения возможности изменения скорости их работы):
Работают с постоянной высокой
скоростью (например, Е3 – Е7)Скорость работы может меняться в зависимости от потребностей клетки (регуляторные ферменты). Как правило, они катализируют начальные этапы метаболического пути (например, Е1 или Е2)
А → В → С → D → E → F → G → H
E1 E2 E3 E4 E5 E6 E7
Слайд 72Общие принципы регуляции работы ферментов
Изменение скорости работы ферментов происходит путем
их:
фосфорилирования киназами и/или
присоединения/удаления аллостерических регуляторов
Когда концентрация аллостерического регулятора
низкая, он не соединяется с ферментом, а когда повышается – присоединяется к ферментуКонцентрация аллостерического регулятора отражает физиологические потребности клетки
Таким образом, активность ферментов связана с физиологическими потребностями клетки через концентрацию аллостерических регуляторов
Слайд 73Регуляторные ферменты гликолиза
Необратимые реакции (они же регуляторные = ключевые =
скорость-лимитирующие = аллостерические):
1 – гексокиназа/глюкокиназа
3 – фосфофруктокиназа
10 – пируваткиназа
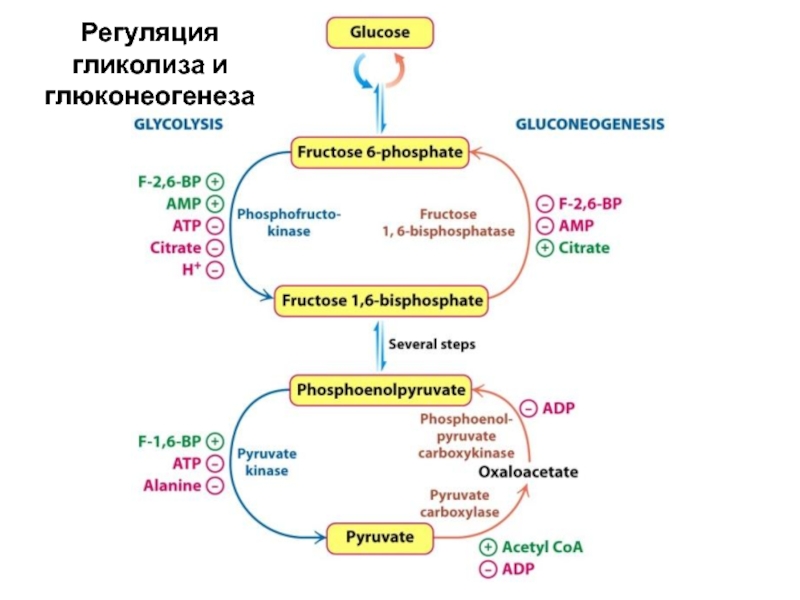
Слайд 74Аллостерические регуляторы гликолиза
Тормозят гликолиз: АТФ, цитрат, глюкозо-6-фосфат (мышцы), фруктозо-6-фосфат (печень),
ацетил-КоА, ВЖК
Ускоряют гликолиз: АДФ, АМФ, фруктозо-2,6-бисфосфат
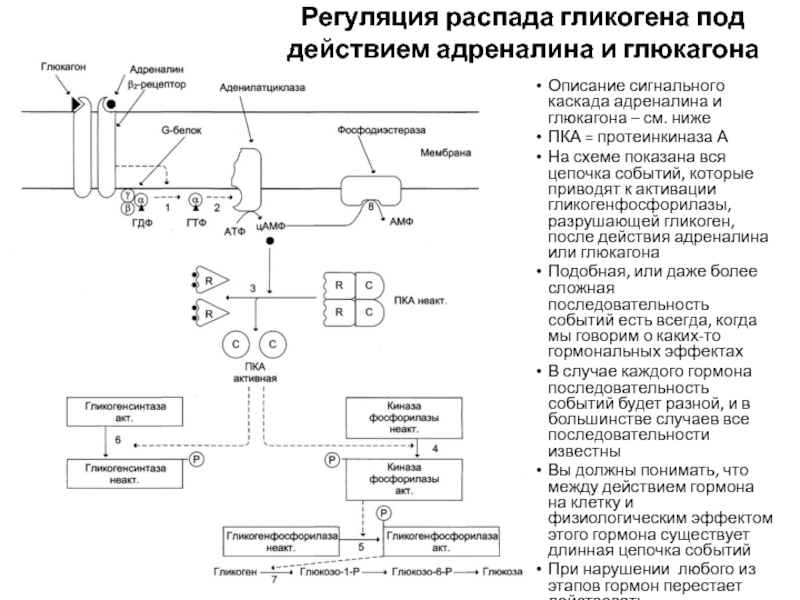
Слайд 78Регуляторные ферменты
Гликогенсинтаза – регуляторный фермент синтеза гликогена. Неактивна в фосфорилированной
форме, активна – в нефосфорилированной
Активация: инсулин
Ингибирование: адреналин, глюкагон
Гликогенфосфорилаза – регуляторный
фермент распада гликогена. Активна в фосфорилированной форме, неактивна – в дефосфорилированнойАктивация: адреналин, глюкагон
Ингибирование: инсулин
Слайд 79Фосфорилированные и нефосфорилированные формы гликогенфосфорилазы (вверху) и гликогенсинтазы (внизу)
Традиционно активные
формы этих ферментов обозначаются буквой А, а неактивные – буквой
ВНа схеме показано, что переход между двумя формами регулируется специальными ферментами – киназами (фосфорилируют) и фосфатазой (удаляет фосфат)
Гормоны запускают сигнальные каскады внутри клетки, которые приводят к активации или инактивации киназ или фосфатазы
В свою очередь, киназы или фосфатаза меняют активность гликогенсинтазы или гликогенфосфорилазы
Слайд 80Описание сигнального каскада адреналина и глюкагона – см. ниже
ПКА =
протеинкиназа А
На схеме показана вся цепочка событий, которые приводят к
активации гликогенфосфорилазы, разрушающей гликоген, после действия адреналина или глюкагонаПодобная, или даже более сложная последовательность событий есть всегда, когда мы говорим о каких-то гормональных эффектах
В случае каждого гормона последовательность событий будет разной, и в большинстве случаев все последовательности известны
Вы должны понимать, что между действием гормона на клетку и физиологическим эффектом этого гормона существует длинная цепочка событий
При нарушении любого из этапов гормон перестает действовать
Регуляция распада гликогена под действием адреналина и глюкагона
Слайд 82Регуляторные ферменты
Цитратсинтаза:
Ингибируют: НАДН, сукцинил-КоА, цитрат, АТФ
Активирует: АДФ
Изоцитратдегидрогеназа
Ингибирует: АТФ
Активируют: Ca2+, АДФ
α-кетоглутаратдегидрогеназный
комплекс
Ингибируют: НАДН, сукцинил-КоА
Активирует: Ca2+
Слайд 85Влияние на метаболизм углеводов
Активация поступления глюкозы в клетки, снижение глюкозы
в крови
Стимуляция гликолиза
Стимуляция синтеза гликогена
Ингибирование глюконеогенеза
Ингибирование гликогенолиза
Слайд 86Влияние инсулина на концентрацию глюкозы в крови
После еду глюкоза поступает
в кровь
Это вызывает высвобождение инсулина из поджелудочной железы
Инсулин связывается с
рецепторами на поверхности клетокЭто приводит к тому, что на поверхности клеток появляются белки-переносчики для глюкозы, которые закачивают ее в клетки
Таким образом, эффект инсулина связан с тем, что глюкоза из крови поступает в клетки. Именно поэтому ее концентрация в крови снижается
Слайд 87Механизм действия инсулина на клетки
На схеме показана мембрана клетки
Глюкоза поступает
снаружи клетк
После связывания с рецепторами инсулина, запускается сигнальный каскад
Он приводит
к появлению на поверхности клетки новых белков-транспортеров для глюкозы, которые ранее были просто запасена в клеткеСама молекула инсулина никогда в клетку не проникает, а остается снаружи
Стрелки означают разные сигнальные каскады, запускающиеся в ответ просто на связывание инсулина с его рецептором
Белки-транспортеры глюкозы
Белки-транспортеры глюкозы
инсулин
Рецептор инсулина
Глюкоза
Перенос белков-транспортеров на поверхность клетки в ответ на сигнал от рецептора инсулина
Слайд 88Влияние на метаболизм липидов
Ингибирует гормон-чувствительную липазу адипоцитов
Активирует липогенез (синтез липидов)
в печени, в том числе путем активации захвата свободных ВЖК
печеньюСлайд 89Влияние на метаболизм белков и аминокислот
Активация синтеза белков
Активация захвата аминокислот
тканями
Слайд 91СД 1 типа
Иммунные: аутоантитела к инсулину и специфическим белкам бета-клеток.
Разрушение поджелудочной железы разной степени выраженности
Идиопатический – причина неизвестна
Слайд 92СД 2 типа
Инсулинорезистентность – невосприимчивость (устойчивость) клеток к сигналу, который
им отдает инсулин
Проявляется в зрелом возрасте
В начале развития заболевания развивается
компенсаторный механизм: так как инсулин перестает действовать, то поджелудочная железа выделяет его все больше. Поэтому в случае СД 2-го типа количество инсулина в крови человека больше, чем в норме. Это позволяет поддерживать концентрацию глюкозы в крови на нормальном уровнеСо временем поджелудочная железа перестает справляться с синтезом большого количества инсулина. В этот момент концентрация глюкозы в крови увеличивается
Слайд 94Глюкагон и адреналин
Глюкагон – пептидный гормон
Адреналин – производное аминокислоты тирозина
Оба
гормона обладают сходными эффектами. Они запускают процессы, активирующие катаболизм (получение
энергии).Глюкагон – гормон голода. Повышает уровень глюкозы в крови, активирует глюконеогенез и распад гликогена
Адреналин – гормон стресса. Повышает уровень глюкозы в крови, активирует глюконеогенез, распад гликогена и липолиз в адипоцитах
Механизм действия сходен:
Активация рецепторов, сопряженных с G-белками, на поверхности клетки
Активация G-белка
Активация аденилатциклазы
Синтез цАМФ
Активация протеинкиназы А
Протеинкиназа А фосфорилирует ряд регуляторных ферментов, которые участвуют в метаболических путях (гликолиз, глюконеогенез, синтез и распад гликогена, липолиз). Активность этих регуляторных ферментов меняется. Поэтому меняется скорость соответствующих метаболических путей
Слайд 96«Метаболическая воронка»
Это понятие, которое описывает унификацию получения энергии из разных
источников
Энергию мы можем получать из белков, жиров и углеводов
Эти три
источника энергии разными путями превращаются в ацетил-КоА и метаболиты ЦТК, а также НАДН и ФАДН2. Т.е. начальные этапы получения энергии из разных источников очень многообразныА вот конечные этапы, уже после получения ацетил-КоА – одинаковы – это включение в ЦТК и дыхательную цепь. При этом не важно, из каких веществ были получены ацетил-КоА, НАДН и ФАДН2
Слайд 97Окисление всех питательных веществ с образованием ацетил-КоА (или метаболитов цикла
Кребса). Также образуются НАДН и ФАДН2. Много путей
Окисление ацетил-КоА до
CO2 и H2O с параллельным образованием НАДН и ФАДН2 (т.е. “все питательные вещества окисляются до CO2 и H2O”). Один путь - ЦТКНАДН и ФАДН2 используются для создания протонного градиента, который используется АТФсинтазой для синтеза АТФ (здесь используется кислород)
«Метаболическая воронка»
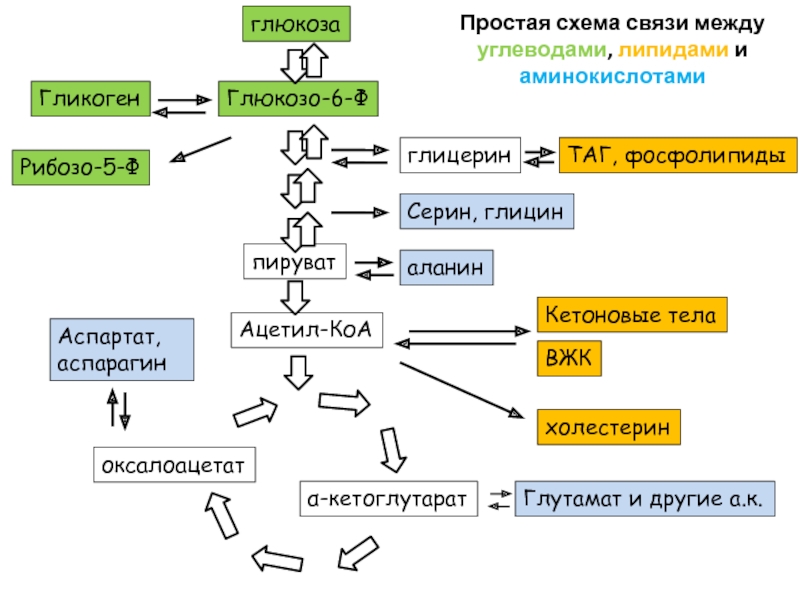
Слайд 98Ацетил-КоА
пируват
глюкоза
Серин, глицин
Глюкозо-6-Ф
Кетоновые тела
ВЖК
холестерин
α-кетоглутарат
Глутамат и другие а.к.
оксалоацетат
Аспартат, аспарагин
аланин
Гликоген
Рибозо-5-Ф
глицерин
ТАГ, фосфолипиды
Простая схема связи
между углеводами, липидами и аминокислотами
Слайд 99Простая схема связи между углеводами, липидами и аминокислотами
Одна стрелка может
означать несколько или даже много реакций
Обратите внимание, что из ацетил-КоА
нельзя получить пируват или оксалоацетат. Поэтому говорят, что из липидов не синтезируется глюкозаНа схеме нет орнитинового цикла. Связь между ЦТК и орнитиновым циклом есть в презентации по аминокислотам. Откройте ее ))
В той же презентации есть подробности о синтезе аминокислот из метаболитов гликолиза