Слайд 1Метаболизм. Взаимосвязь различных путей обмена веществ.
Метаболизм – совокупность химических превращений,
катализируемых ферментами.
Реакции внешнего обмена (внеклеточный компартмент).
Реакции промежуточного обмена (внутриклеточный
компартмент).
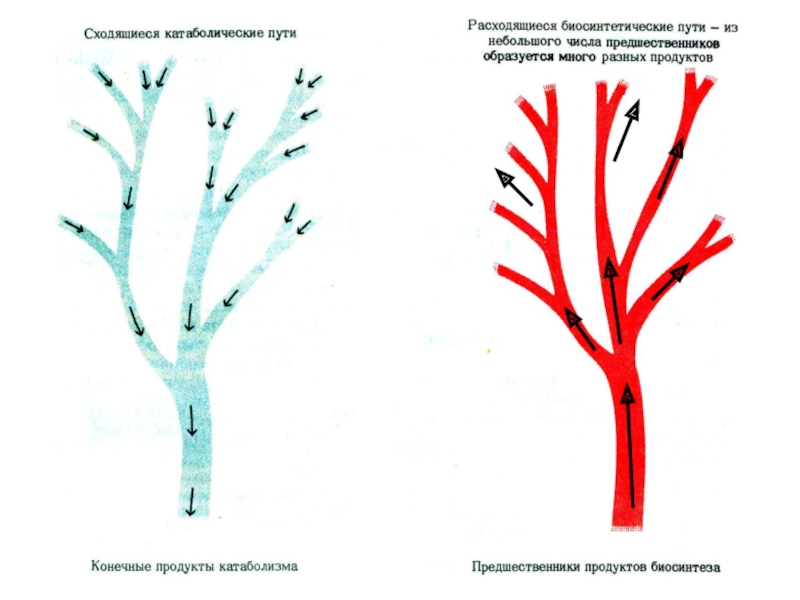
Две стороны обмена: Катаболизм (диссимиляция, энергетический обмен); Анаболизм (ассимиляция, пластический обмен). Взаимосвязаны анаплеротическими (пополняющими) реакциями, когда метаболиты одного пути служат субстратами для другого: глю ? ПВК + СО2 ? ОА ?ЦТК и амфиболическими, объединяющими пути синтеза и распада (ПФП, ЦТК).
Слайд 4Основные характеристики метаболизма клеток млекопитающих
Гетеротрофы
Аэробы (факультативные или облигатные). Акцептором электронов
являются органические вещества и (или) в конечном итоге – О2.
Источник углерода – глюкоза, источник азота – аминокислоты.
Слайд 5Функции метаболизма
Аккумулирование энергии в макроэргических связях АТФ.
Использование энергии АТФ для
биосинтеза de novo молекул (химическая работа), а также осмотической, электрической,
механической работы.
Распад и синтез обновляемых структурных компонентов клеток.
Синтез и распад молекул «специального» назначения (гормонов, медиаторов, кофакторов).
Слайд 6Все механизмы регуляции направлены на поддержание гомеостаза и адаптацию к
изменяющимся условиям внешней и внутренней среды
Способы регуляции скорости ферментативных реакций:
Изменение
каталитической активности ферментов (аллостерическая или ковалентная модификация ключевых ферментов метаболизма)
Изменение количества ферментных молекул (конститутивные и адаптивные ферменты)
Компартментализация метаболических процессов.
Слайд 7Взаимосвязь обменов:
Углеводы – липиды:
«Лишние» углеводы обеспечивают синтез липидов
(образование глицерол-3- фосфата, ацетил-КоА, НАДФН)
глицерин – субстрат для глюконеогенеза.
«жиры сгорают
в пламени углеводов»: основным источником оксалоацетата является пируват.
Слайд 8Взаимосвязь обменов:
Белки – липиды:
Запас нейтральных липидов предотвращает использование белков на
энергетические нужды.
Аминокислоты ? ацетил-КоА ?биосинтез жирных кислот
Глицерин ? ГАФ
? ПВК ? Аминокислоты
Серин, метионин - участвуют в биосинтезе фосфолипидов
Глицин. таурин – участвуют в синтезе желчных кислот (переваривание липидов).
Слайд 9Взаимосвязь обменов
Белки – углеводы:
Гликогенные аминокислоты (кроме лиз и лей)
Основной путь
синтеза заменимых аминокислот – реакции переаминирования или восстановительного аминирования кетокислот
(т.е. источник углерода для биосинтеза – глюкоза!)
ПФП превращения глюкозы – источник рибозы и НАДФН для биосинтеза нуклеотидов, а значит нуклеиновых кислот и белков.
ЦТК ? сукцинил-КоА ? биосинтез порфиринов для гемо- миоглобина, цитохромов, каталазы) .
Слайд 10Роль нуклеотидов в обмене веществ
Адениловые нуклеотиды обеспечивают энергетический потенциал клеток
УТФ
участвует в обмене углеводов
ЦТФ участвует в биосинтезе фосфолипидов
ГТФ участвует в
трансляции
АМФ является структурным компонентом НАД, ФАД, Ко-А
Циклические нуклеотиды – вторичные мессенджеры гормонов
ФАФS и УДФ-глюкуронат образуют парные соединения , обезвреживая токсины
Слайд 11Этапы энергетического обмена
1. Крупные «пищевые» молекулы гидролизуются до мономеров: аминокислот,
жирных кислот, моносахаров.
2. Специфические дегидрогеназы окисляют эти вещества до пирувата,
ацетил-КоА, кетоглутарата, сукцината, оксалоацетата.
3. Эти универсальные «субстраты дыхания» окисляются до СО2 в ЦТК.
4. НАДН и ФАДН2 поставляют протоны и электроны во внутреннюю мембрану МХ, восстанавливают кислород до Н2О и создают условия для фосфорилирования АДФ до АТФ.
Слайд 12Унификация клеточного «топлива»
В процессе основных путей катаболизма - гликолиза, окислительного
дезаминирования, β – окисления, ЦТК образуется ограниченное количество универсальных «топливных»
молекул: ацетил-КоА, метаболитов ЦТК.
Слайд 13Основные этапы адаптации организма к голоданию
Суточная потребность в энергетических ресурсах
в зависимости от физической нагрузки составляет 1600 – 6000 ккал.
Метаболические запасы составляют: 40 ккал – глюкоза; 1600 ккал – гликоген; 135 000 ккал – нейтральный жир; 24 000 ккал – белок.
Слайд 14Адаптация к голоданию
Голодание (равно как любой стресс или диабет) приводит
к повышению
уровня катехоламинов, глюкагона, глюкокортикоидов, тиреоидов при одновременном
снижении инсулина.
Этот гормональный статус обеспечивает поддержание концентрации глюкозы в крови не < 2 -2,5 ммоль/л и сохранение азотистого баланса.
Метаболическая ситуация при этом характеризуется усилением глюконеогенеза в печени, липолиза в адипоцитах, протеолиза в мышцах.
Слайд 151- ая фаза голодания (1сутки)
На начальном этапе уровень глюкозы крови
(особенно важный для нейронов и эритроцитов) поддерживается запасами гликогена печени.
Далее предшественниками для глюконеогенеза становятся глицерин (продукт липолиза) и аминокислоты, как продукт протеолиза мышечных белков (глюкозо-аланиновый цикл).
Проблема сохранения мышечной массы и азотистого баланса!!!
Слайд 162- ая фаза голодания (1 –ая неделя)
Гормональная ситуация приводит к
адаптивному переключению энергетического обмена с преимущественно углеводного типа на липидный.
Основными источниками энергии становятся жирные кислоты.
Концентрация СЖК в крови увеличивается в 3 -4 раза, кетоновых тел – в 10 – 15 раз.
Низкое содержание глюкозы (ПВК и ОА) приводит к накоплению ацетил-КоА и цитрата, торможению гликолиза (сохранение глюкозы!) и усилению кетогенеза!!!. Мозг и сердце на 1/3 удовлетворяют свои потребности в энергии за счет кетоновых тел.
Слайд 173 – я фаза голодания (1 – 3 месяца)
Усиление кетогенеза
предотвращает использование аминокислот (Но! метаболический ацидоз!).
Продолжительность голодания определяется запасом
ТАГ. Затем следует утилизация аминокислот для глюконеогенеза.
Терминальная стадия голодания характеризуется отрицательным азотистым балансом (распадается > 20 г белка и выделяется 3 г мочевины в сутки). Атрофия тканей.
Слайд 18Биоэнергетика изучает процессы превращения энергии в живом организме.
Биологическое окисление (тканевое
дыхание) – процессы, протекающие с участием кислорода ???
Главный вопрос биоэнергетики:
как энергия окисления органических веществ трансформируется в энергию связей АТФ?
Слайд 19История учения о биоокислении
18 век, А.Лавуазье: « Дыхание – медленное
горение»
1920 - е г., А.Н.Бах. Перекисная теория активации кислорода. Открытие
оксигеназ и пероксидаз.
1930 - е г., О.Варбург, Д.Кейлин. Открытие цитохромов (гемсодержащих ферментов), взаимодействующих с кислородом.
В.И.Палладин : «окисление – м.б. отнятие водорода!» Открытие флавинсодержащих ферментов.
Г.Вилланд, О.Варбург. В. Христиан. Открытие никотинсодержащих дегидрогеназ.
Слайд 20История учения о биоокислении
Биологическое окисление – отнятие водорода от субстратов
и передача его через серию посредников на кислород с образованием
воды.
90% О2 утилизируется МХ цепью ферментов (фосфорилирующее окисление)
10% О2 – микросомальное окисление (нефосфорилирующее), О2 внедряется в окисляемую молекулу.
Слайд 21Аккумулирование энергии в клетке:
НАДН, ФАДН2, НАДФН
АТФ (реже другие нуклеозидтрифосфаты)
Внутренняя мембрана
митохондрий, функционирующая как конденсатор, где разделяются заряженные атомы и молекулы.
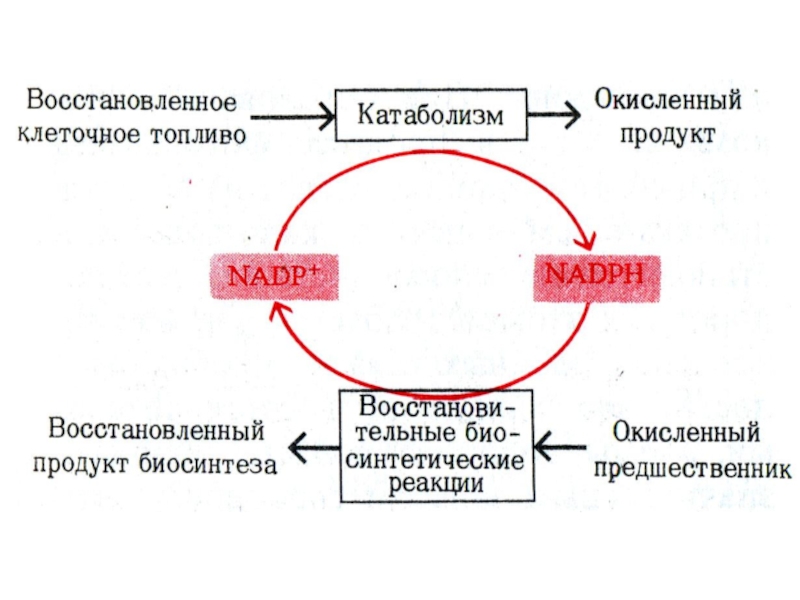
Слайд 22НАДН, НАДФН, ФАДН2
Восстановленные эквиваленты образуются при окислении органических субстратов; НАДН
и ФАДН2 реокисляются в дыхательной цепи МХ, НАДФН использует восстановительный
потенциал в реакциях биосинтеза, обезвреживания, антиперекисной защиты.
Подавляющее большинство восстановленных эквивалентов образуется в матриксе МХ (окисление ПВК, аминокислот, жирных кислот, ЦТК).
Доставка цитоплазматических восстановленных эквивалентов требует специального транспорта (челночные механизмы), т.к. пулы цитоплазматические и митохондриальные разделены!
Слайд 23Роль НАДФН в метаболизме
1. Восстановительные синтезы аминокислот, нуклеотидов, жирных кислот,
холестерола, стероидов, желчных кислот.
2. Десатурация жирных кислот
3.Кофактор Met – Hb
редуктазы
4. Кофактор глутатион-редуктазы
5. Участие в микросомальном окислении
Слайд 24Челночные механизмы транспорта
Восстановленные эквиваленты, образующиеся в цитозоле, например при окислении
глицеральдегид- 3 фосфата попадают в МХ компартмент непрямым путем: с
помощью НАДН в цитозоле образуются вещества проникающие в МХ.
Наиболее активна малат-аспартатная челночная система (печень, почки, миокард).
В скелетных мышцах и мозге – глицерофосфатный челнок. При этом глицерофосфат окисляется в МХ с помощью ФАД.
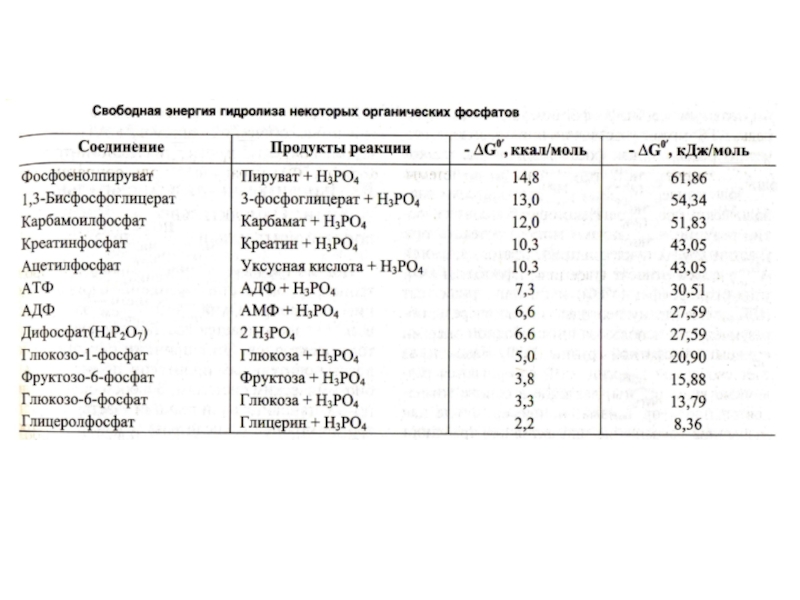
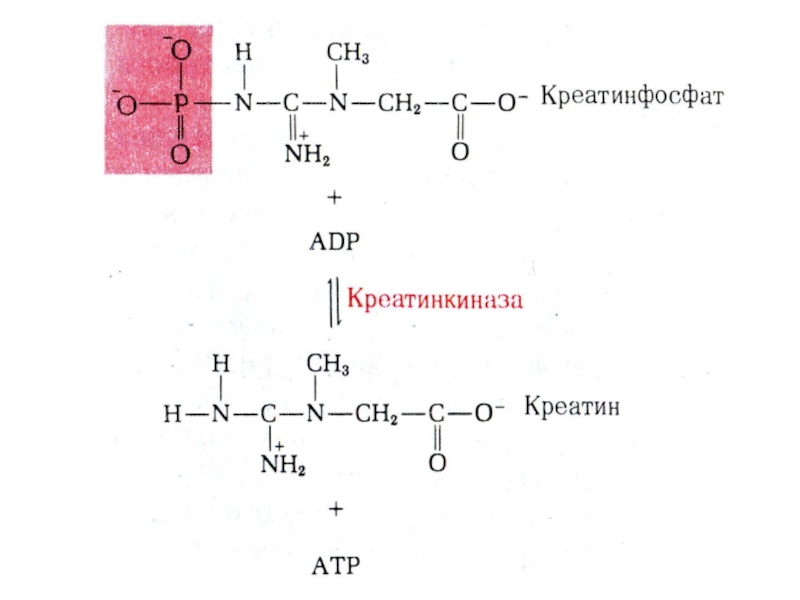
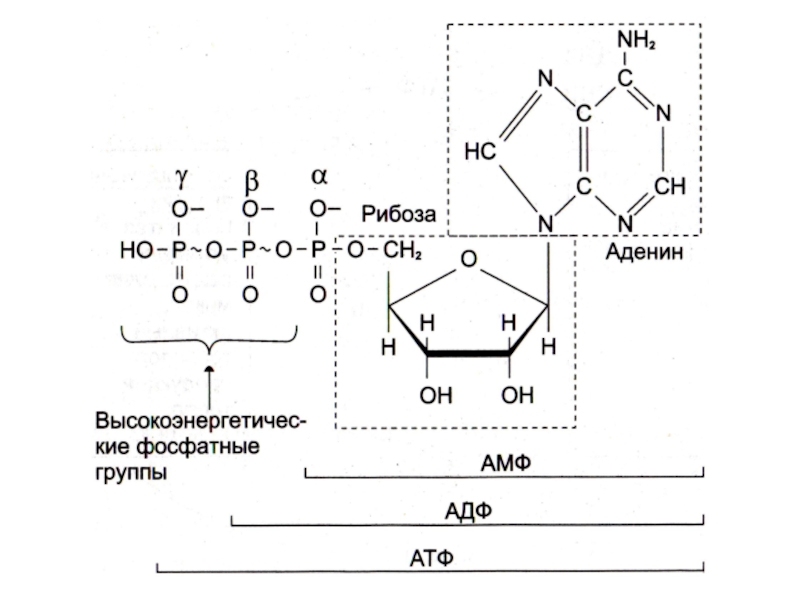
Слайд 28Почему именно адениловые нуклеотиды составляют энергетический потенциал клеток?
Адениловые нуклеотиды более
устойчивы к химическим и физическим факторам среды (УФ), обладают наибольшей
скоростью обмена концевых остатков фосфорной кислоты.
При калорийности суточного рациона 2- 3 тыс. ккал и 50% КПД, этой энергии достаточно для образования 120 молей АТФ (М.м. 540 г).; таким образом ежесуточно в организме синтезируется и распадается около 50 -60 кг АТФ.
Содержание свободных адениловых нуклеотидов в организме не более 3 - 4 г, т.е. происходит постоянное фосфорилирование и гидролиз.
Запаса АТФ практически нет, его хватает на секунды активной мышечной работы.
Интенсивность распада АТФ стимулирует скорость его синтеза.
АТФ – не форма депонирования химической энергии, только временное ее аккумулирование.
Слайд 29Содержание адениловых нуклеотидов к клетке
АДФ + Ф? [АТФ]?АДФ + Фн
(АМФ +ФФ)
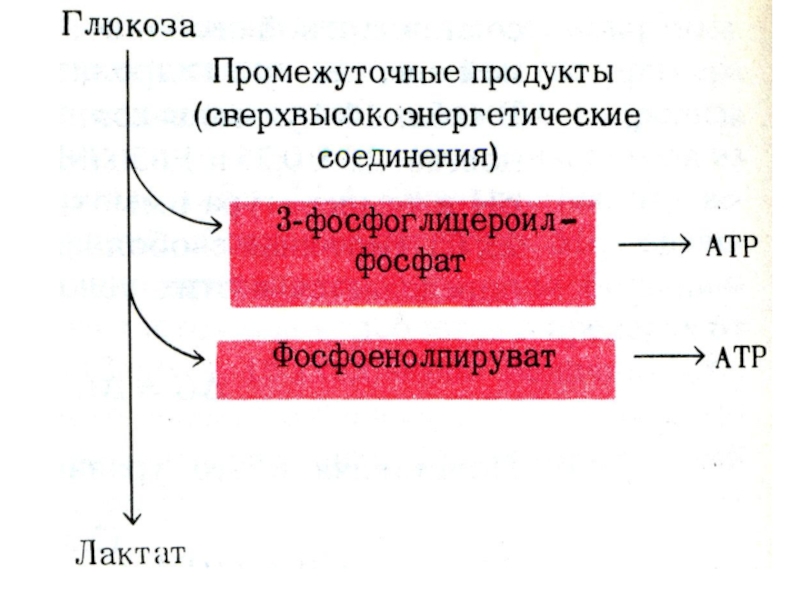
Синтез АТФ: субстратное или окислительное фосфорилирование.
Оба механизма – по
сути окислительные.
Субстратное сопряжено с реакциями гликолиза или ЦТК и образованием промежуточных макроэргов: дифосфоглицерата, фосфоэнолпирувата, сукцинил-КоА.
Окислительное сопряжено с дыханием и работой внутренней мембраны МХ, промежуточных посредников нет.
Слайд 36Гипотезы сопряжения окисления и фосфорилирования
Липман, 1946г., Слэйтер, 1953г.
Гипотеза химического сопряжения
Перенос
ē сопряжен с адениловой системой через образование промежуточных макроэргических соединений
(подобно субстратному фосфорилированию)
Слайд 37Гипотеза химического сопряжения
АН2 + В + Х ? А +
ВН2 ∞Х
ВН2 ∞ Х + V ? ВН2 + Х∞
V
Х ∞ V + Рн ? Х + V∞ РH
V ∞ Рн + АДФ ? АТФ + V
Х м.б. О2, Na, Ca; V м.б. P,C
Однако, в МХ не обнаружено никаких макроэргов кроме адениловых нуклеотидов.
Слайд 38Гипотеза конформационного сопряжения
Бойер, 1964: Ленинджер, 1966; Грин, 1970г.
Транспорт ē по
внутренней мембране МХ вызывает ее конформационные изменения, она приобретает «напряженную»
структуру (энергизованная мембрана). «Релаксация» мембраны передает энергию конформационного напряжения АТФ-синтетазе, встроенной в эту мембрану.
Электронно-микроскопические исследования подтверждают «уплотнения» крист МХ при добавлении субстратов дыхания, АДФ и Рн .
Старение МХ, действие детергентов, снижение скорости дыхания вызывает «набухание» МХ.
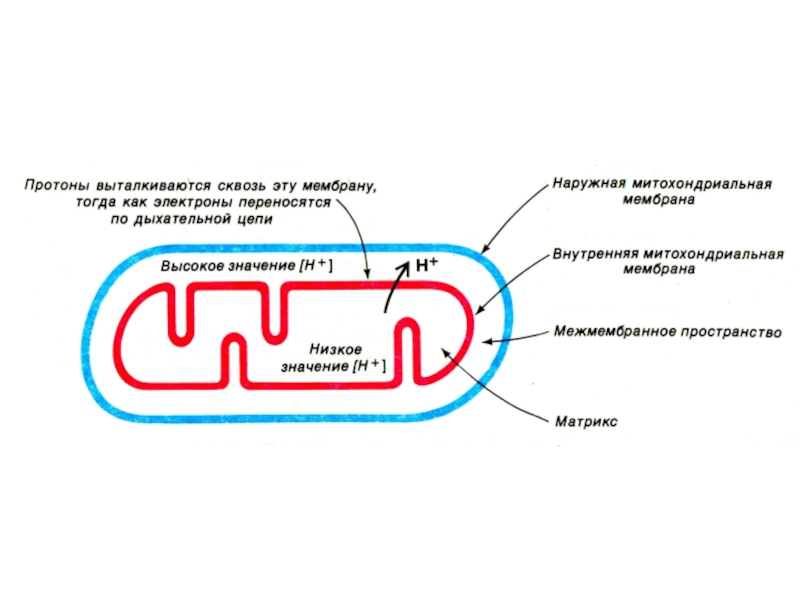
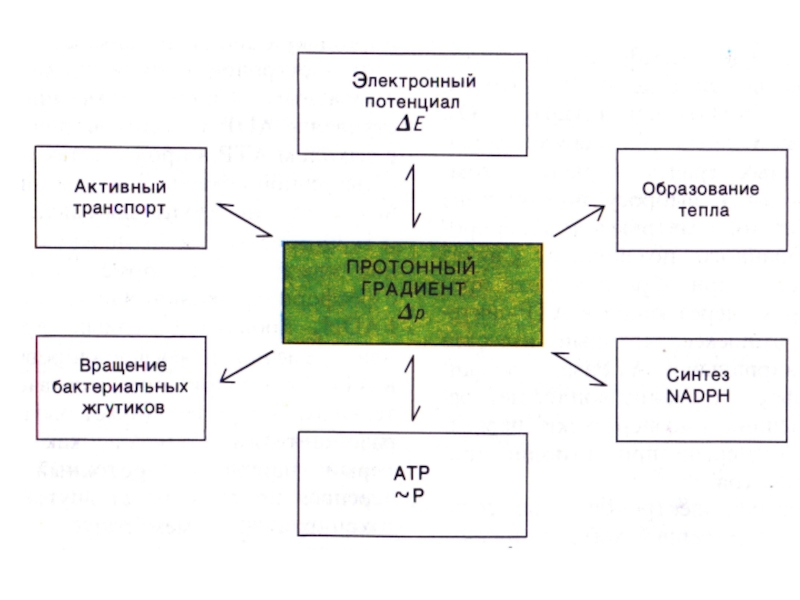
Слайд 39Хемиоосмотическая гипотеза
Митчелл,1961
Перенос ē вдоль внутренней мембраны сопровождается выкачиванием Н+ из
матрикса МХ в наружную среду. Энергия этого трансмембранного протонного градиента
используется на синтез АТФ.
Слайд 40Доказательства хемиоосмотической гипотезы
1. В МХ нет высокоэнергетических посредников. связывающих перенос
ē с биосинтезом АТФ.
2. Для окислительного фосфорилирования необходима пространственная замкнутость
внутренней мембраны МХ.
3.Большое значение имеет разница в ионной силе и концентрации ионов с наружной и внутренней стороны мембраны.
4.Заряд внутренней мембраны имеет электрохимическую и концентрационную (осмотическую) составляющую.
5. Окислительное фосфорилирование предотвращается «разобщителями»
Слайд 42Дыхательная цепь ферментов осуществляет окислительно- восстановительные реакции, перенося ē от
одной молекулы к другой и в конечном итоге – на
О2восстанавливая его до Н2О.
НАДН – поставляет ē в виде гидрид –иона (:Н-);
ФАДН2 и КоQ - 2ē и 2 Н+ (2 атома водорода);
цитохромы и Fe – S центры – только ē.
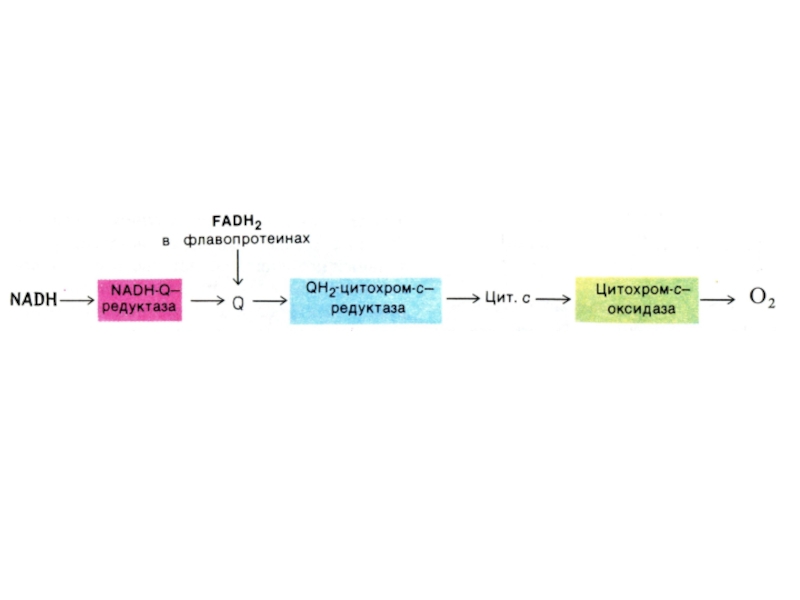
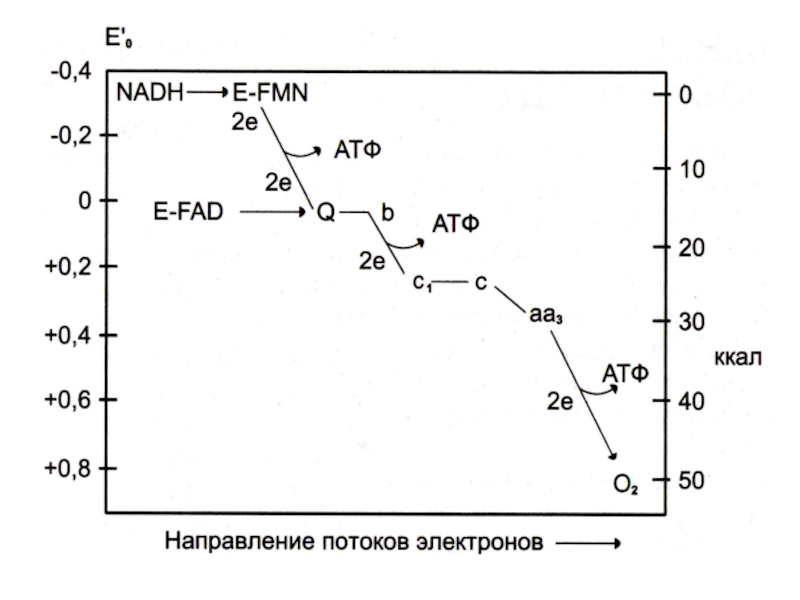
Слайд 43Структура дыхательной цепи МХ
I комплекс: НАДН –КоQ дегидрогеназа: кофакторы FMN
и Fe-S белки
II комплекс: FADH2 – КоQ дегидрогеназа:
III комплекс: КоQ
– цитохром С дегидрогеназа: (через цитохромы в и с1.и Fe – S)
IV - комплекс: цитохром аа3 – оксидаза (через Cu2+ )
Слайд 44Никотинамидные дегидрогеназы
Более сотни субстратов окисляются через НАД. Основное количество НАДН
образуется при окислении изоцитрата, малата, гидроксиацил-КоА, гидроксибутирата, глутамата.
НАД-ДГ слабо связаны
с апоферментом
SН2 + НАД+ ? S + НАДН + Н+
Фиксирует в никотинамиде гидрид-ион
НАДФН поставляет протоны и ē в дыхательную цепь также через НАДН:
НАДФН + НАД+ ? НАДФ+ + НАДН
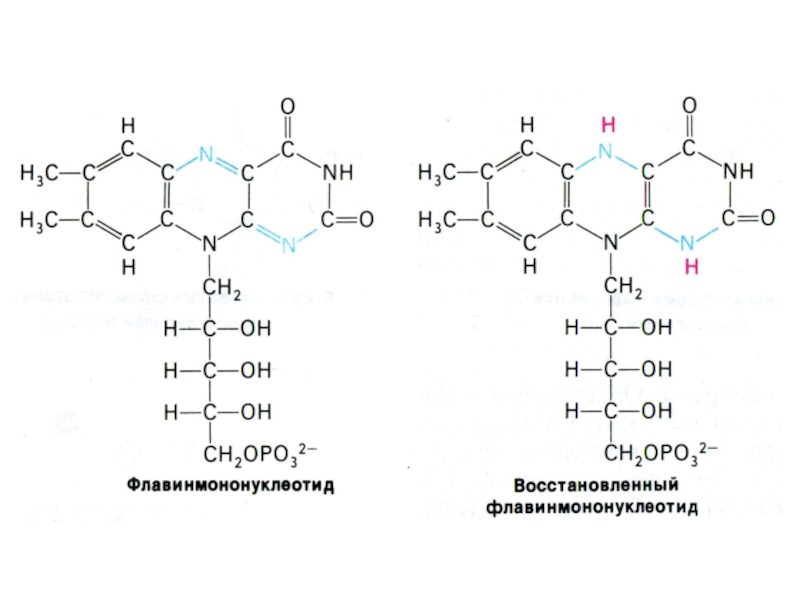
Слайд 45Флавинзависимые дегидрогеназы
Коферментную функцию выполняют ФМН или ФАД (производные рибофлавина)
Прочно связаны
с белковой частью ферментов.
SH2 + FAD+ ? S + FADH2
Фиксируют
в изоаллоксазиновом центре 2 Н+ и 2 ē.
ФАДН2 образуется при окислении глицеролфосфата, сукцината, жирных кислот.
Слайд 46Убихинон (КоQ)
Повсеместно распространенное производное бензохинона.
Гидрофобное, низкомолекулярное вещество,
не связанное с белком (кофермент), способное мигрировать в пределах мембраны.
Принимает
восстановленные эквиваленты от флавопротеинов I и II комплексов и передает на цитохромы в дыхательной цепи, превращаясь в гидрохинон.
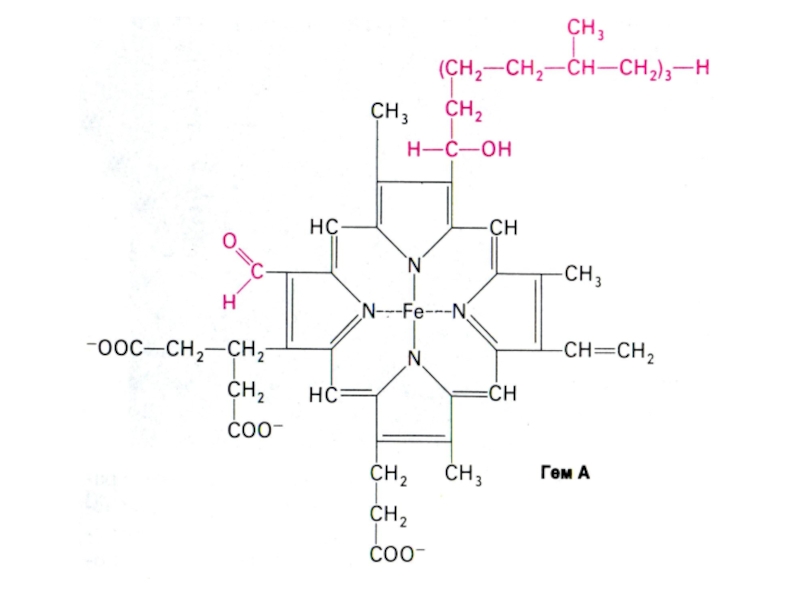
Слайд 47Цитохромы
Гемсодержащие белки (15-45 кДа), простетические группы - гем b
или a, отличающиеся строением боковых радикалов порфириновой группировки.
Цитохромы аa3
содержат еще атомы Cu+(2+) .
Функциональноактивный центр цитохромов железо гема с переменной валентностью ( в отличие от железа Hb).
Функция цитохромов в дыхательной цепи -перенос ē (КоQH2 ? цит.b ? цит.с1 ? цит. c ? цит. aa3 ? O2.).
Слайд 48Железосерные белки
Низкомолекулярные белки, содержащие негемовое железо и неорганическую серу (2Fe
-2S; 4Fe- 4S). Атом железа связан с атомом серы и
группами белковой части.
Как и цитохромы осуществляют одноэлектронный транспорт. Входят в состав разных комплексов вместе с флавопротеинами и цитохромами.
Слайд 49Создание градиента ионов на внутренней мембране МХ
Перенос ē по
дыхательной цепи сопровождается закислением наружной среды (рН=7) и защелачиванием матрикса
(рН=8). т.е. ē – движущая сила выкачивает протоны в межмембранное пространство.
Прохождение пары ē на уровне I комплекса в матрикс попадает 2 пары Н+, III комплекса – 1 пара и IV – 2 пары.
Таким образом создается электрохимический Н+ градиент, имеющий электрический и осмотический компонент.
ΔµH = Δψ + ΔpH
Слайд 50Дыхательная цепь ферментов
Полная цепь системы МХ окисления:
SH2 (изоцитрат, малат, гидроксиацилКоА,
гидроксибутират, глутамат) ? никотинамидные ДГ? комплексI,III, IV ? O2 .
Укороченная
цепь: (без комплекса I)
SH2(сукцинат, ацилКоА, глицеролфосфат) ? КоQ ?комплекс III, IV ? O2
Удлиненная цепь окисления:
SH2 (пируват, кетоглутарат) ? комплексы I,III,IV ? O2. (окислительно-декарбоксилирующие комплексы кетокислот примыкают к внутренней мембране МХ).
Слайд 51Транслоказы
Кроме оксидоредуктаз дыхательной цепи во внутреннюю мембрану МХ встроена система
переноса «клеточного топлива»: кетокислот, аминокислот. дикарбоновых кислот, жирных кислот (транслоказы).
Адениннуклеотидтранслоказа,
фосфаттранслоказа.
АТФ – синтаза.
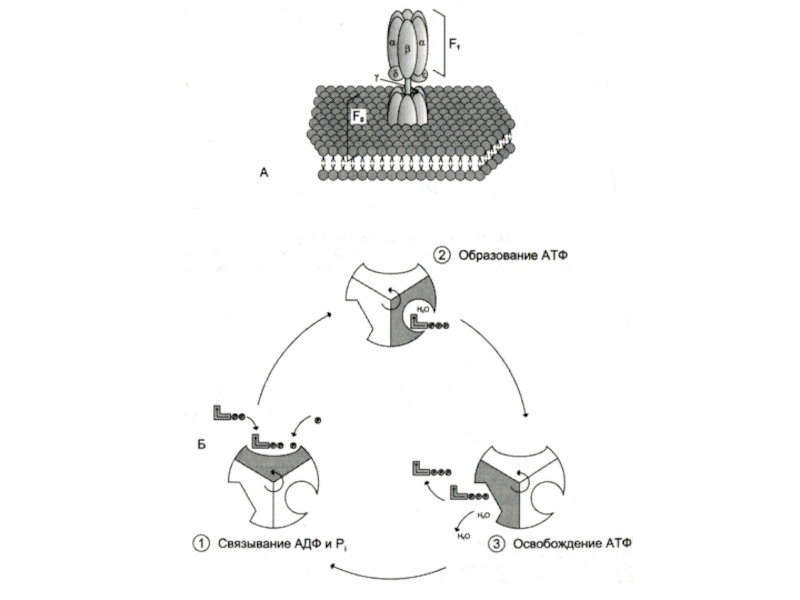
Слайд 57Строение АТФ – синтазы
Н+ - АТФ –синтаза (АТФ-АЗА)
V – комплекс
дыхательной цепи
Сложный белковый комплекс (500 кДа) из Fo и F1
субъединиц.
Фактор сопряжения дыхания (протонного градиента) и фосфорилирования.
Fo – трансмембранный канал для протонов во внутренней мембране МХ.
F1 - каталитическая субъединица, состоящая из трех гетеродимеров (α и β), связывающие АДФ и Фн, образование АТФ с выделением Н2О и освобождением АТФ.
Активация АТФ-азы происходит за счет ротации комплекса вызванного потоком протонов из внешней среды в матрикс.
При накоплении АТФ в матриксе АТФ – аза начинает гидролизовать АТФ и работать как протонная помпа, градиент протонов не уменьшается, а нарастает.
Слайд 59Протонный градиент и пункты фосфорилирования
Атомы водорода от окисляемых субстратов отдают
ē в дыхательную цепь и превращаются в Н+ ,которые поступают
в межмембранное пространство.
ē передаются по дыхательной цепи и оказываются на все более низких энергетических уровнях, пока не достигнут О2
В дыхательной цепи трижды происходит значительное снижение стандартной свободной энергии, достаточное для обеспечения синтеза АТФ. (три пункта фосфорилирования: на уровне I, III и IV комплексов).
Слайд 61Соотношение дыхания и фосфорилирования
4ē + 4Н+ + О2 ? 2Н2О
АДФ
+Фн ? АТФ
Эффективность фосфорилирования Р/О (количество Фн включенного в состав
АТФ на каждый атом О).
Теоретически для НАДН – коэффициент =3; для ФАДН2 = 2; для aa3 = 1.
Практически, этот коэффициент ниже, не все протоны проходят через протонные каналы АТФ-синтетазы, энергия Δ µН+ частично используется на другие нужды и Р/О = 2,5; 1,5 для I и II комплексов. соответственно.
Каковы взаимоотношения дыхания и фосфорилирования?
Слайд 62Дыхательный контроль
ДК (дыхательный контроль) отражает зависимость интенсивности дыхания от концентрации
АДФ.
Измеряется полярографически по поглощению О2 и отношению фосфорилирующего дыхания к
нефосфорилирующему (т.е. в присутствии или отсутствии АДФ).
Дыхательный контроль ведет к соответствию скорости синтеза АТФ потребностям клетки в данный момент: чем больше расход АТФ, тем быстрее поток ē к О2 (дыхание!) и интенсивнее окисление субстратов и поглощение О2.
Слайд 63Энергетический заряд клеток
АТФ: АДФ:АМФ
Энергетический заряд изменяется от 1 (если все
адениловые нуклеотиды максимально фосфорилированы и находятся в виде АТФ) ;
до 0 (если все
нуклеотиды находятся в виде АМФ.
Слайд 64Ингибиторы дыхания
На различных участках цепи передача ē блокируется специфическими
веществами: барбитуратами, некоторыми гликозидами, антибиотиками, цианидами.
На 90% дыхание подавляется
ингибиторами передачи ē на уровне цитохромоксидазы дыхательными ядами: цианидами, СО,H2S, NH3.
Слайд 66Ингибирование фосфорилирования
Олигомицин блокирует Fo – субъединицу АТФ – синтетазы.
Электрохимический
градиент при этом не снижается, но потока протонов в матрикс
через протонный канал не происходит и АТФ –синтетаза не активна.
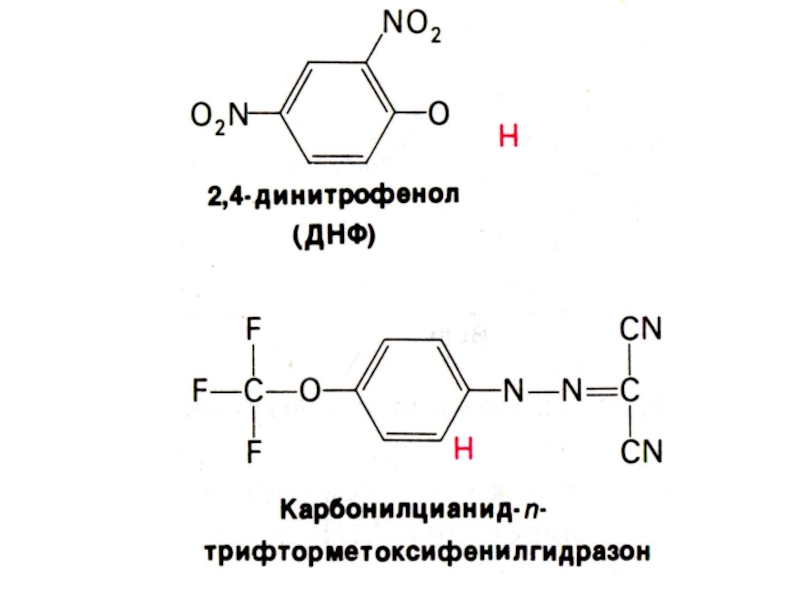
Слайд 67Разобщители дыхания и фосфорилирования
Липофильные вещества, способные переносить протоны (протонофоры) и
катионы (ионофоры) через внутреннюю мембрану, минуя канал Fo:
градиент Н+ снижается;
содержание
АДФ увеличивается, скорость окисления растет, поглощение О2 (дыхание) растет, но энергия рассеивается в виде тепла, коэффициент Р/О снижается.
2,4 – динитрофенол, валиномицин, грамицидин, дикумарол, билирубин, мочевая кислота, тироксин, длинноцепочечные жирные кислоты.
Разобщение окисления и фосфорилирования увеличивает теплопродукцию (специализированная ткань – бурый жир, где в МХ много белка термогенина, переносящего жирные кислоты в матрикс).
Слайд 69Митохондриальная цепь окисления – источник активных форм кислорода
4Н+ + 4ē
+ О2 ? 2 Н2О
Неполное восстановление кислорода ведет к образованию
АФК:
4Н+ + 3ē + О2 ? НО*
4Н+ + 2ē + О2 ? 2 Н2О2
4Н+ +ē + О2 ? :О2-
Слайд 70Антиперекисная защита
Ферментативные механизмы:
2О2* + 2Н+ ? Н2О + О2 (СОД)
2Н2О2
? 2 Н2О + О2 (каталаза)
Н2О2 + 2 глутатион- SH
? 2Н2О + глу-S-S –глу (глутатионпероксидаза)
глу-S-S-глу + НАДФН ? 2 глу-SH + НАДФ+ (глутатиоредуктаза)
Антиоксиданты неферментативной природы: витамины Е, С, каротин, глутатион, мочевая кислота, билирубин.

























![Метаболизм. Взаимосвязь различных путей обмена веществ. Содержание адениловых нуклеотидов к клеткеАДФ + Ф? [АТФ]?АДФ + Фн (АМФ Содержание адениловых нуклеотидов к клеткеАДФ + Ф? [АТФ]?АДФ + Фн (АМФ +ФФ)Синтез АТФ: субстратное или окислительное фосфорилирование.Оба](/img/thumbs/9bd0c16d85c2a5e5662ec0e3a09d0346-800x.jpg)