Слайд 1Металлические элементы 1-А группы
Щелочные металлы
Li Na K Rb Cs Fr
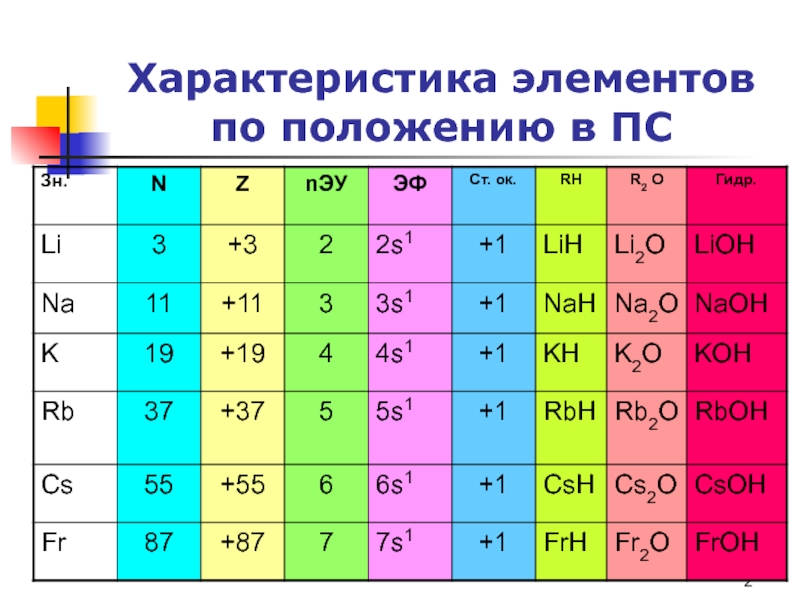
Слайд 2Характеристика элементов по положению в ПС
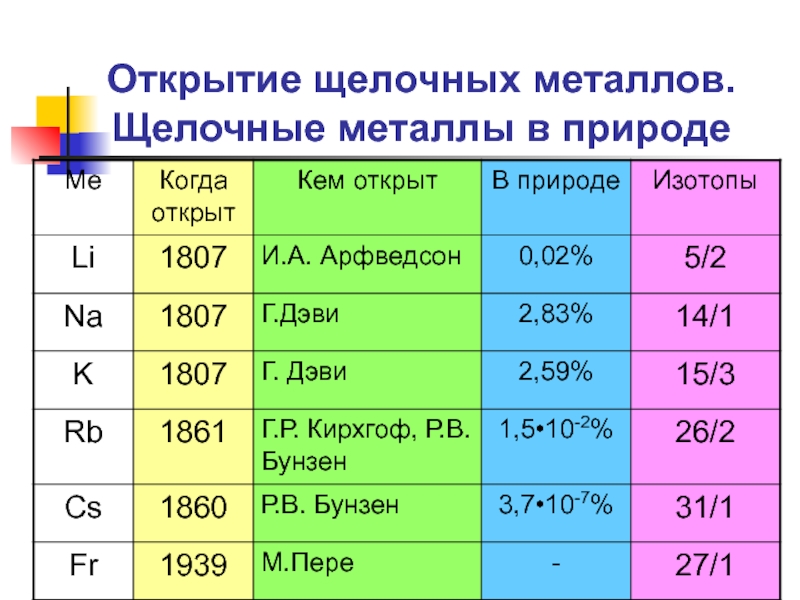
Слайд 3Открытие щелочных металлов. Щелочные металлы в природе
Слайд 4Получение щелочных металлов
Na: электролиз расплава 40% NaCl и 60% CaCl2,
5800С, 7 В, фильтрация металлического кальция при 1100С,
электролиз расплава NaOH
при ~3500С,
электролиз водных растворов с использованием ртути (амальгамный, большое перенапряжение).
K: Na + KCl = K + NaCl
Электролиз расплава K2CO3 – KCl, катод – расплав свинца, перегонка в вакууме
Li, Rb, Cs: электролиз расплава галогенидов, цирконий-термия
2M2CO3 + Zr = 4M + ZrO2 + 2CO2
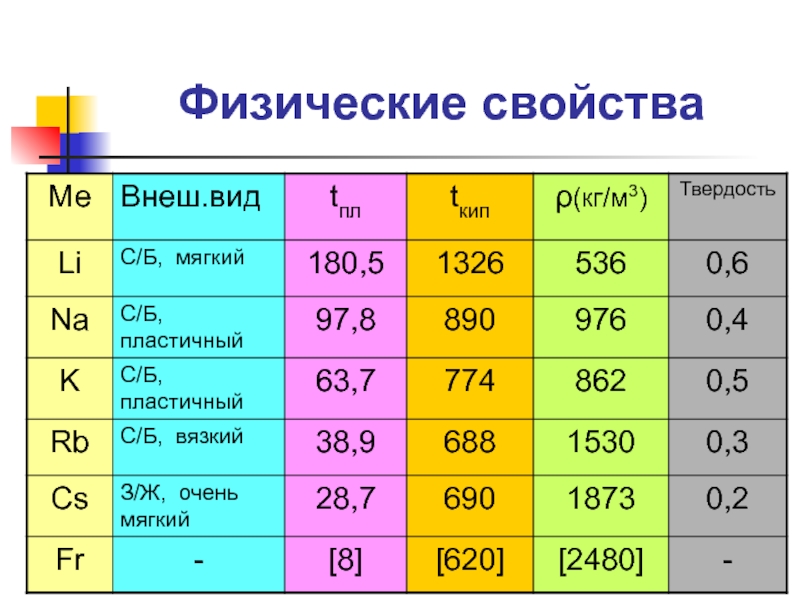
Слайд 6Химические свойства щелочных металлов
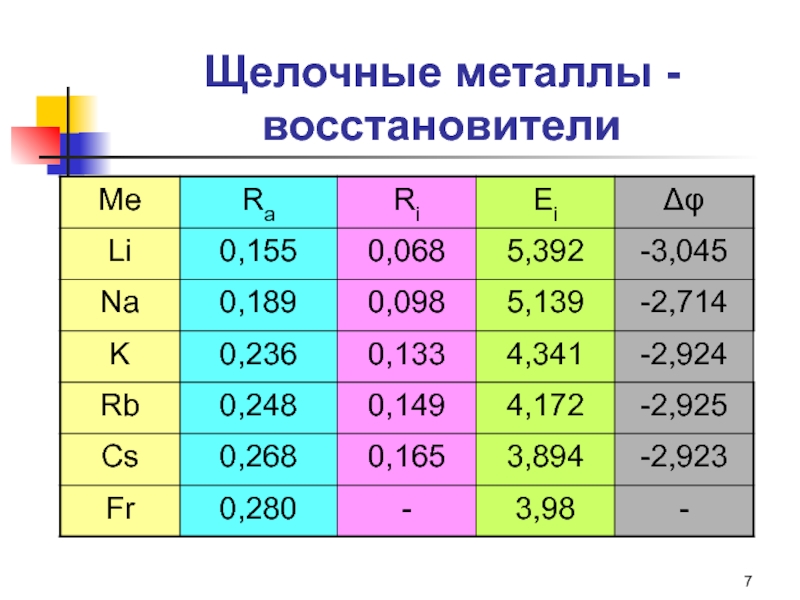
Общая характеристика восстановительных свойств
Окисление
Взаимодействие с неметаллами
Взаимодействие с
водой
Взаимодействие с кислотами
Сплавы щелочных металлов
Слайд 7Щелочные металлы - восстановители
Слайд 8Взаимодействие с кислородом
Активно окисляются на воздухе
Литий – единственный образует оксид
(?)
4Li + O2 = 2Li2O
Натрий образует пероксид (?)
Na + O2
= Na2O2
Калий, рубидий, цезий образуют надпероксиды (?)
K + O2 = KO2
Rb + O2 = RbO2
Cs + O2 = CsO2
Слайд 9Взаимодействие с неметаллами
С галогенами образуют галогениды:
2Ме + Gal2 = 2MeGal
С
серой взаимодействуют при незначительном нагревании или обычных условиях:
2Me + S
= Me2S
С углем, азотом взаимодействуют при нагревании:
2Me + 2С = Me2С2
6Me +N2 = 2Me3N
С водородом взаимодействуют при нагревании:
2Me +Н2 = 2MeН
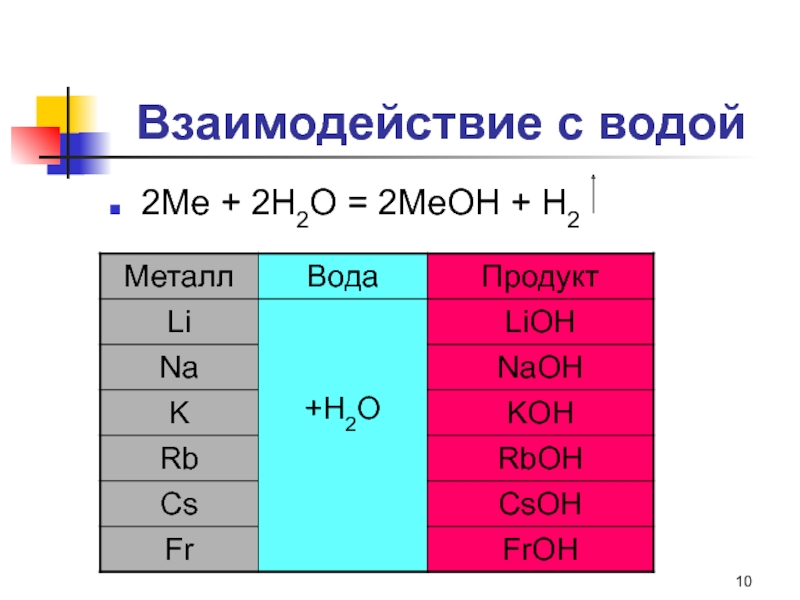
Слайд 10Взаимодействие с водой
2Ме + 2Н2О = 2МеОН + Н2
Слайд 11Взаимодействие с кислотами
2Ме + 2Н+ = 2Ме+ + Н2
Щелочные
металлы с растворами кислот не взаимодействуют!
При взаимодействии с концентрированными кислотами
или газообразными веществами, растворы которых являются кислотами, реакции протекают с выделением водорода (HNO3?)
Слайд 12Сплавы щелочных металлов
Образуют интерметаллические соединения
Образуют эвтектические сплавы (24% Na и
76% К – жидкость, Тпл = -12,60С)
Могут образовывать амальгамы
Сплав, содержащий
щелочной металл, всегда имеет более низкую температуру плавления
Слайд 13Соединения щелочных металлов
Кислородные соединения
Гидроксиды
Галогениды
Сульфиды
Соли кислородсодержащих кислот
Определение щелочных металлов
Применение щелочных металлов
Слайд 14Кислородные соединения
Оксиды – Ме2О
при взаимодействии с водой образуют щелочи
Пероксиды –
Ме2О2, сильные окислители
Надпероксиды – МеО2, сильные окислители
Озониды –МеО3 , сильные
окислители, нестойкие, разлагаются с образованием надпероксидов:
2МеО3 = 2МеО2 + О2
Слайд 15Гидроксиды
МеОН – щелочи, хорошо растворимы в воде, изменяют окраску
индикаторов:
Щелочные свойства изменяются в подгруппе сверху вниз (?)
Гигроскопичны, при нагревании
возгоняются без разложения (кроме гидроксида лития, разлагается)
Слайд 16Галогениды
Образуют соединения со всеми галогенами
Бесцветные , кристаллические вещества, не
плавятся, кристаллические решетки гранецентрированные и кубические
Соли, хорошо растворимые в воде
(кроме фторида лития), растворимость изменяется в зависимости от положения металла в подгруппе (?)
Имеют широкое применение
Слайд 17Сульфиды
Подобно соединениям с кислородом, образуется ряд сульфидов:
Сульфиды – Ме2S
Персульфиды
(полисульфиды) – Ме2S2, Ме2S3, Ме2S4, Ме2S5, (Ме2Sn)
n: для лития-2, натрия
–5, калия-цезия-6
Устойчивость полисульфидов увеличивается в ряду литий-цезий
Слайд 18Соли кислородсодержащих кислот
Карбонаты – сода, поташ
Сульфаты – сульфат натрия
Нитраты
– селитры
Фосфаты – полифосфаты натрия
Силикаты – жидкое стекло
Хлораты –
бертоллетова соль
Слайд 19Определение соединений щелочных металлов
Li – карминово-красный
Na – желтый
K –
фиолетово-розовый
Rb – розовый
Cs - фиолетово-розовый
Слайд 20Применение щелочных металлов
Фотоэлементы
Источники света
Сплавы с низкими температурами плавления
Атомная энергетика
Металлургия
Лабораторная
практика