подгрупп
2. Непереходные и переходные металлы - сравнение
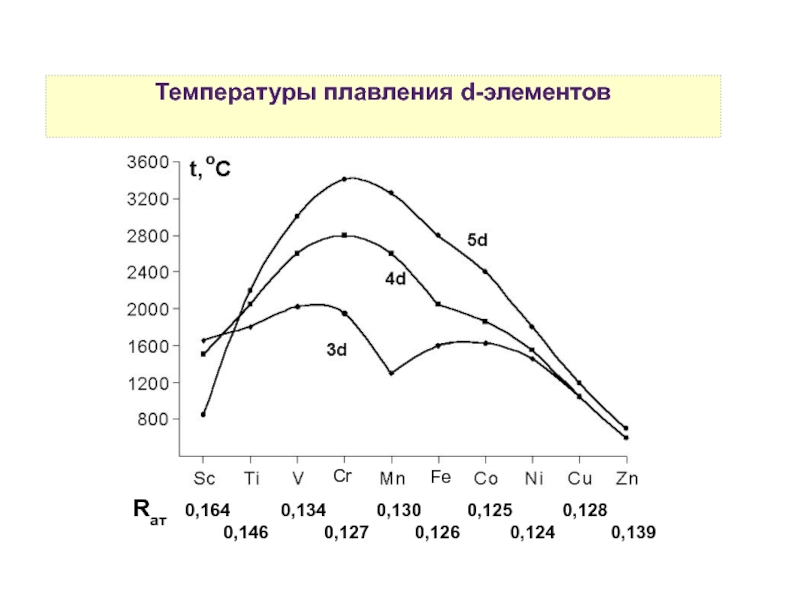
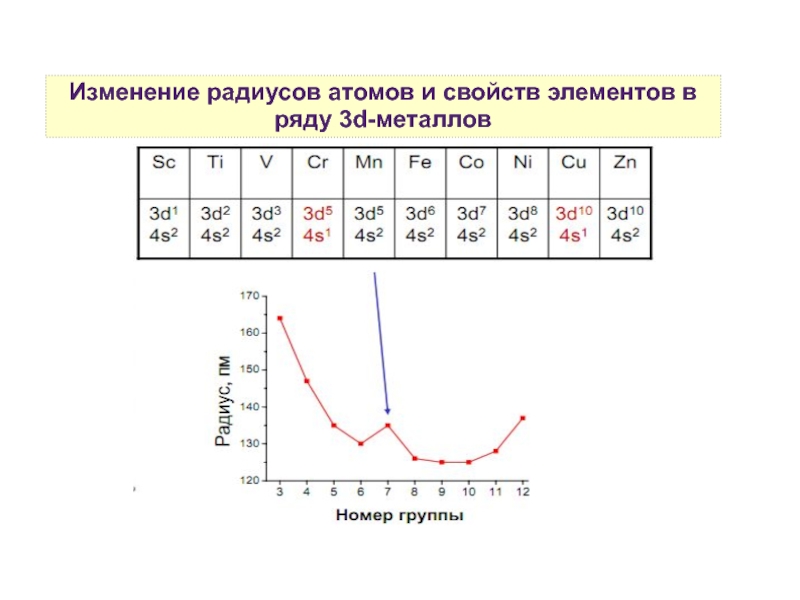
3. Физические свойства
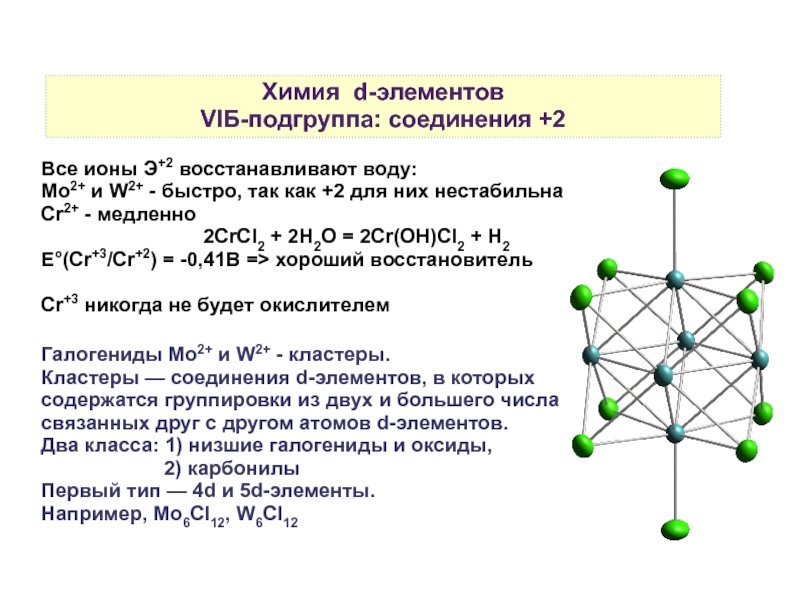
переходных металлов4. Соединения d-элементов
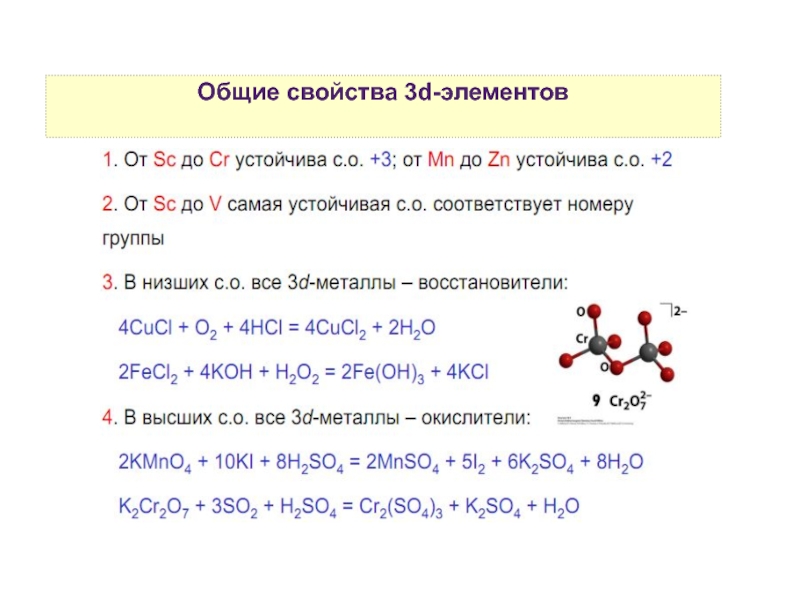
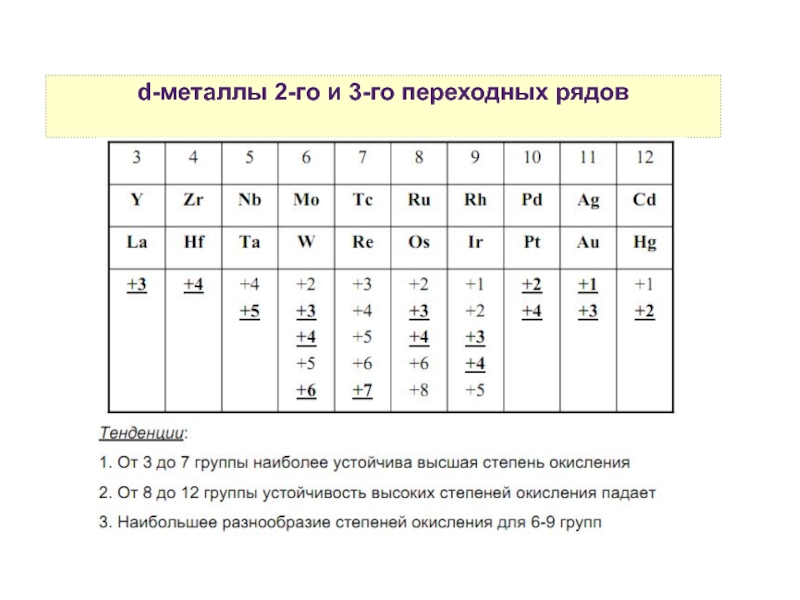
5. Степени окисления d-элементов
6. Кислотно-основные свойства оксидов и гидроксидов переходных металлов
7. Общие свойства d-элементов
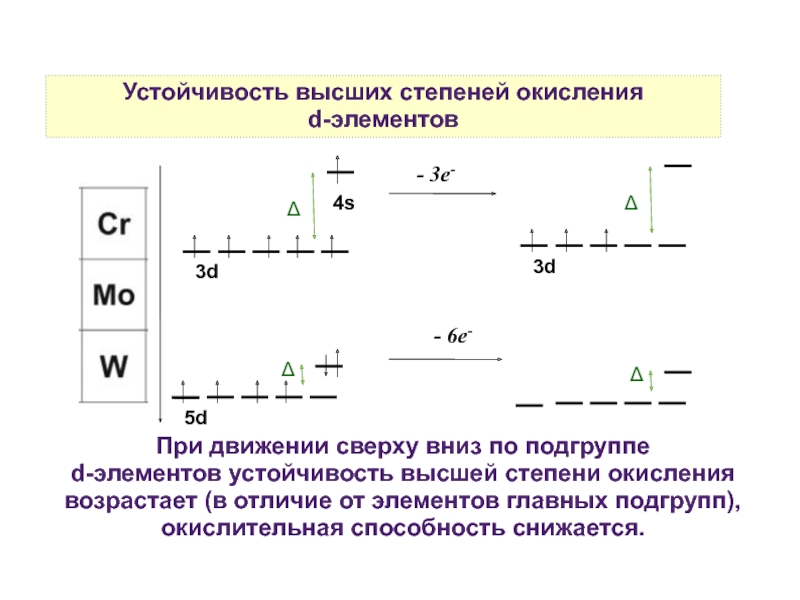
8. Устойчивость высших степеней окисления d-элементов
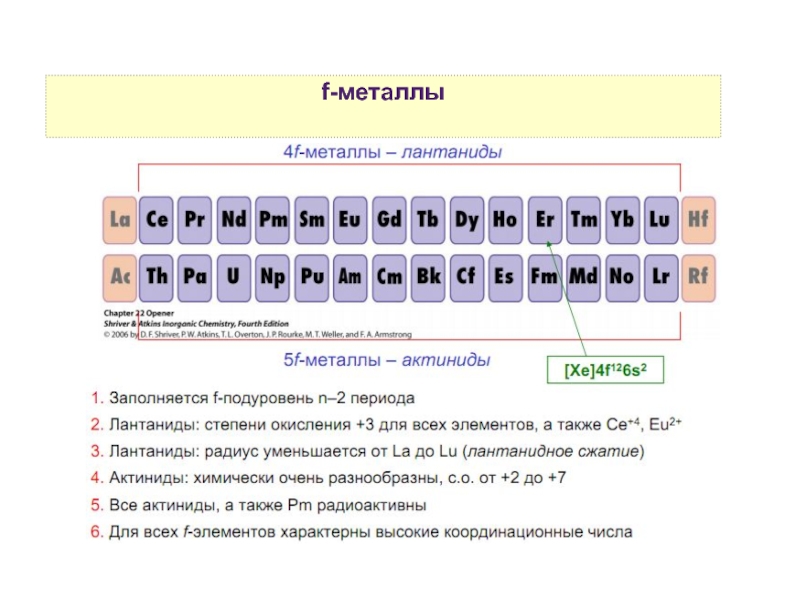
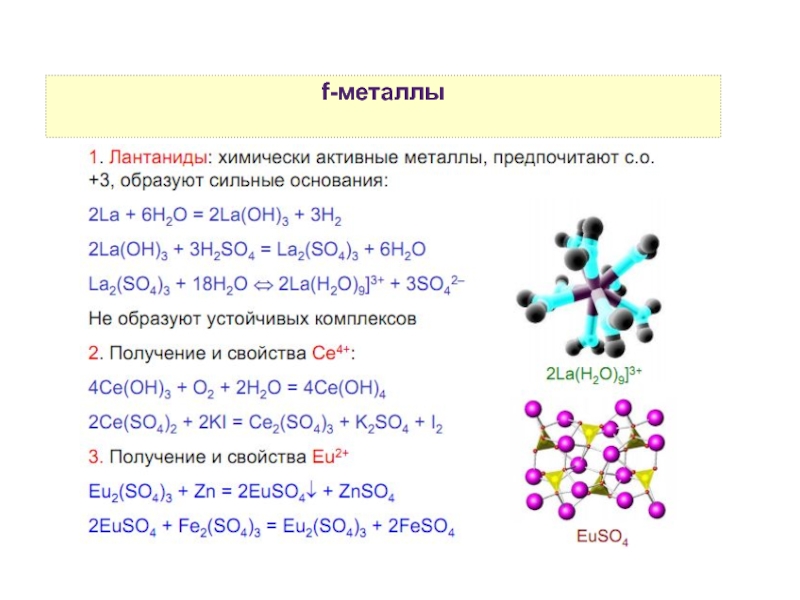
9. f-элементы — общие свойства
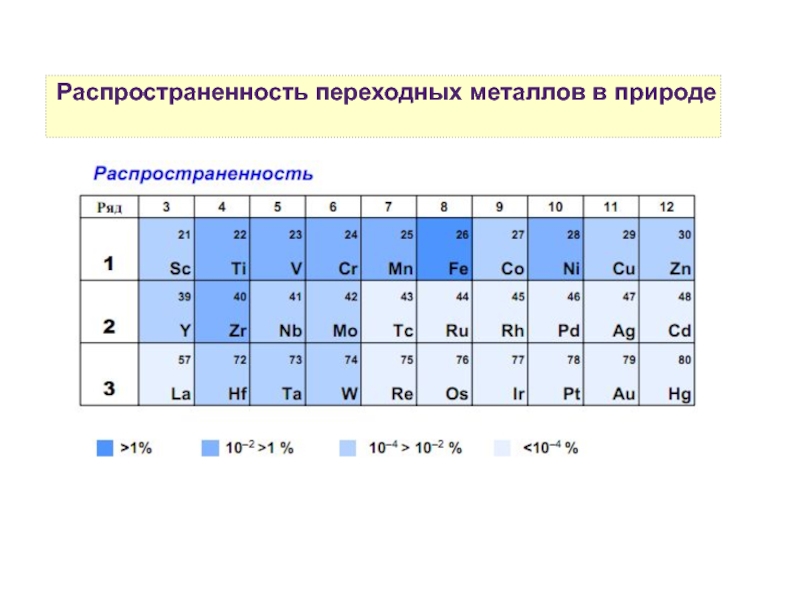
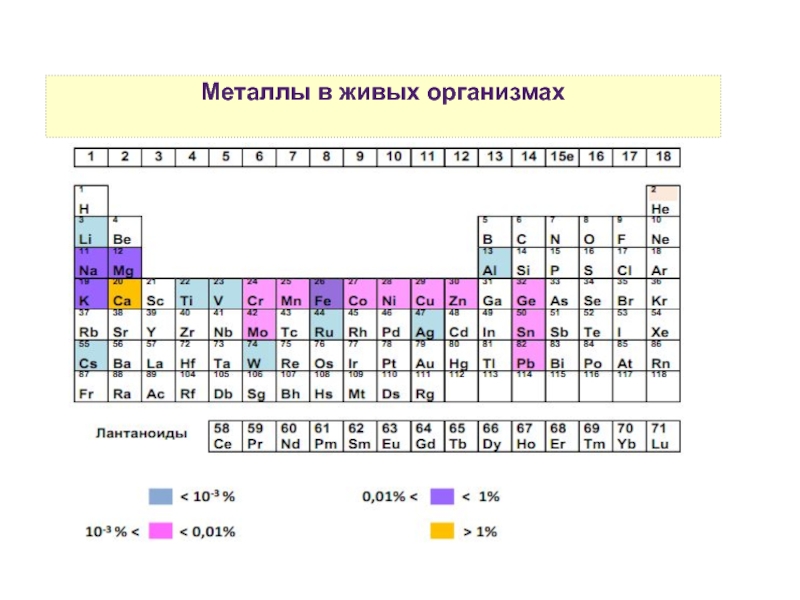
10. Распространенность переходных элементов в природе и в живых организмах