Слайд 1Металлургия редких металлов
Вольфрам. Технология производства вольфрама
Слайд 2План лекции
История открытия вольфрама, его свойства и соединения
Области применения
Минералы
вольфрама
Переработка вольфрамовых концентратов
Переработка продуктов вскрытия
Выделение вольфрама из растворов (NH4)2WO4
Получение
WO3
Восстановление WO3
Методы порошковой металлургии
Плавка вольфрама
Лекция: Металлургия вольфрама
Слайд 4Вольфрам
История открытия вольфрама
Слайд 6W – тугоплавкий металл, по внешнему виду похож на сталь
Атомный
номер ……………….….... 74
Атомная масса ……………..….…….184
Плотность …………….………19,3 г/см3
Температура плавления .….3400 оС
Температура
кипения..….….5900 оС
Физические свойства вольфрама
Слайд 7взаимодействие с кислородом
На воздухе стоек;
При 400-500 оС W окисляется с
образованием на поверхности металла пленок цвета побежалости;
При t>500 оС окисляется
интенсивно до желтой WO3
Химические свойства вольфрама
Слайд 8взаимодействие с водородом
не взаимодействует до температуры плавления
Химические свойства вольфрама
взаимодействие
с азотом
взаимодействует при t > 2000 0С образуя нитрид вольфрама
WN2
Слайд 9взаимодействие с углеродом и углеродсодержащими газами
взаимодействует при t =1000
-1200 оС
с образованием карбидов WC и W2C
Примечание: Небольшие примеси
карбидов в
металле сильно понижают его электропроводность
Химические свойства вольфрама
Слайд 10взаимодействие с галогенидами
c фтором при комнатной температуре
с хлором при t
= 800 0С
с серой при t > 400 0С
Химические свойства вольфрама
Слайд 11взаимодействие с кислотами
Хорошо растворяется в смеси НF и HNO3,
Разъедается в царской водке и HNO3 при нагревании
Химические свойства
вольфрама
Слайд 12Взаимодействие с щелочами
В растворах щелочей не растворяется;
Взаимодействует с расплавленными щелочами
образуя вольфраматы
Химические свойства вольфрама
Слайд 13Соединения W и их свойства
В соединениях W проявляет C.O. +2;
+3; +4; +5 и +6
Наиболее устойчивой степенью
окисления является +6.
Слайд 14Соединения с кислородом
WO3 – лимонно-желтого цвета
tпл.= 1470 0С
, tвозг= 800 0С, = 7,3 г/см3,
мало
растворим в Н2О, кислотах
хорошо растворим в НF, NH4OH, NaOH(р-р), Na2CO3(р-р)
восстанавливается водородом и окисью углерода при 800 – 900 оС до металла
WO2 – темно-коричневого цвета
tпл.= 1270 0С , tвозг= 1000 0С, = 11 г/см3,
не растворяется в Н2О, кислотах, щелочах
окисляется HNO3 до WO3
образуется при восстановлении WO3 водородом при 575 – 600 оС
WO2,72 – темно-фиолетовый, WO2,9 – синего цвета
мало растворимы в Н2О, кислотах, щелочах
образуются при восстановлении WO3 водородом при 300 – 550 оС
Соединения вольфрама
Слайд 15Кислоты
Н2WO4 – вольфрамовая кислота, cуществует в твердом состоянии
Н2WO4 (H2O*WO3)
>180 H2O + WO3
мало растворима в Н2О,
HNO3, HСl, H2SO4 Растворяется в растворах едких щелочей, соды и аммиака с образованием нормальных вольфраматов – солей типа Me2WO4
Н6W12O38·27H2O - метавольфрамовая кислота
растворима в Н2О
устойчива в слабокислых растворах
при добавлении щелочи, при кипячении переходит в нормальные вольфраматы
Соединения вольфрама
Слайд 16Изополикислоты
хН2О·уWO3·nH2O – поликислота
хNa2О·уWO3·nH2O – cоль поликисолоты
5(NН4)2О·12WO3·nH2O – паравольфрамат
аммония (ПВА)
Соединения вольфрама
Соли вольфрамовой кислоты
Вольфраматы щелочных металлов:
Na2WO4, (NH4)2WO4 растворимы в Н2О;
Вольфраматы тяжелых металлов:
СаWO4, FeWO4 не растворимы в Н2О
Слайд 17Соединения с серой
WS2 - природный минерал тунгстенит
WS3 – образуется при
осаждении
вольфрама из раствора
сероводородом
WS3
400 WS2 + 1/2S2
Соединения вольфрама
Слайд 18Области применения
Для изготовления сталей спец. назначения ………(50%)
Твердые сплавы
на основе WC
Жаропрочные, коррозионноустойчивые,
износостойкие сплавы…………………………………………(30%)
Радиоэлектроника
Краски в текстильной промышленности (Na2WO4)
Как смазка (WS2)
Слайд 19Минералы вольфрама
Лекция: Металлургия вольфрама
Шеелит CaWO4
Вольфрамит (Fe, Mn)WO4
Слайд 20Минералы вольфрама
Лекция: Металлургия вольфрама
Тунгстит WO3∙H2O
Слайд 22В рудах содержание WO3 0,5 – 2 %
Обогащение вольфрамового сырья
Руды
обогащают:
Гравитационным методом,
Флотацией,
Магнитной сепарацией,
Электростатической сепарацией,
Химическим методом
В концентратах содержание WO3 55 –
65 %
Слайд 23Способы переработки вольфрамовых концентратов
Лекция: Металлургия вольфрама
Спекание с содой
Автоклавно-содовое
выщелачивание
Разложение растворами едкого натра
Разложение соляной кислотой
Слайд 24Спекание с содой
Способы переработки вольфрамовых концентратов
Лекция: Металлургия вольфрама
Спекание вольфрамита с
Na2CO3
2 FeWO4 + 2 Na2CO3 + ½ O2 = 2
Na2WO4 + Fe2O3 + 2 CO2
3 MnWO4 + 3 Na2CO3 + ½ O2 = 3 Na2WO4 + Mn3O4 + 3 CO2
Спекание шеелита с Na2CO3
2 СаWO4 + 2 Na2CO3 + SiO2 = 2CaO·SiO2 + 2 Na2WO4 + 2CO2
Слайд 25Автоклавно-содовое выщелачивание
Способы переработки вольфрамовых концентратов
Лекция: Металлургия вольфрама
Шеелит
СаWO4 + Na2CO3(р-р) =
Na2WO4 + СаСО3(тв)
Вольфрамит
(Fe,Mn)WO4 + Na2CO3 = Na2WO4 + (Fe,Mn)СО3(тв)
Слайд 26Разложение растворами едкого натра
Способы переработки вольфрамовых концентратов
Лекция: Металлургия вольфрама
(Fe,Mn)WO4 +
2 NaOH = Na2WO4 + (Fe,Mn)(OH)2
Разложение соляной кислотой
СаWO4 + 2
НСl = H2WO4 + СаСl2
Слайд 27Переработка продуктов вскрытия
Переработка спеков
Переработка растворов
Водное выщелачивание
Температура 80 – 90 оС
Процесс
ведут в стальной аппаратуре (периодический режим) или в барабанных вращающихся
выщелачивателях (непрерывный режим)
Продукты: раствор (W) и нерастворимый остаток – хвосты выщелачивания.
Выход хвостов выщелачивания 30 – 40 %, содержание в них WO3 1,5 – 2 %.
Лекция: Металлургия вольфрама
1 стадия – очистка от примесей (Si, P, As, F, Mo)
2 стадия – осаждение искусственного шеелита и получение вольфрамовой кислоты
3 стадия – растворение вольфрамовой кислоты в аммиачной воде с последующим получением ПВА выпаркой или нейтрализацией
Слайд 28Очистка от примесей (Si, P, As, F, Mo)
Переработка продуктов вскрытия
Лекция:
Металлургия вольфрама
От F: MgCl2 + 2 F-
Mg F2 + Cl2
От Si: Na2SiO3+ 2 Н2O pH=8-9 Н2SiO3 + 2 NaОН
От Р и As:
Nа2НPO4 + MgCl2 + NH4ОН Mg(NH4)PO4 +2 NаCl + H2O
Nа2НAsO4 + MgCl2 + NH4ОН Mg(NH4) AsO4 +2 NаCl + H2O
Очистка от Мо: Nа2МоO4 + 4 S2- Nа2МоS4 + 4O2- Nа2МоS4 + 2 HCl МоS3 + 2 NаCl + H2S
Слайд 29Р-р (Nа2WO4)
Очистка от Si и F
Кек р-р NH4Сl, MgCl , NH4ОН
Очистка от As и P
р-р кек
очистка от Мо
МоS3 чистый р-р
(Nа2WO4)
Технологическая схема очистки растворов вольфрамата натрия от примесей
Слайд 30Осаждение искусственного шеелита
Переработка продуктов вскрытия
Лекция: Металлургия вольфрама
Na2WO4 + СaСl2 =
СaWO4 + 2 NaСl
СaWO4 + 2 НСl = СaСl2
+ Н2WO4
Na2WO4 + 2HCl = H2WO4 + 2 NaCl
Получение Н2WO4
Слайд 31Растворение вольфрамовой кислоты в аммиачной воде
Переработка продуктов вскрытия
Лекция: Металлургия вольфрама
Н2WO4
+ 2NH4ОН = (NH4)2WO4(р-р) + 2Н2О
Слайд 32Выделение вольфрама из растворов (NH4)2WO4
Лекция: Металлургия вольфрама
1 метод: осаждение
Н2WO4
(NH4)2WO4(р-р) + 2 НСl
Н2WO4 + 2 NH4Сl
При разложении поддерживают высокую кислотность
(90 - 100 г/л НСl ), что обеспечивает отделение от Н2WO4
примесей Р, As, и частично Мо.
2 метод: выделение ПВА - 5(NН4)2О·12WO3·nH2O
Можно проводить двумя способами
- упаривание с последующей кристаллизацией
12 (NH4)2WO4 = 5(NH4)2O·12WO3·5H2O↓+14 NH3 + 2 H2O
- нейтрализация
12 (NH4)2WO4 + 14 HCl + 4 H2O = 5(NH4)2O·12WO3·11H2O↓+14 NH4Cl
Слайд 33Получение WO3
Лекция: Металлургия вольфрама
WO3 получают из ПВА или Н2WO4
Н2WO4
= H2O + WO3
5(NН4)2О·12WO3·nH2O = (n+5) Н2O + 12 WO3
+ 10 NН3
Слайд 34Схема переработки вольфрамовых концентратов по способу спекания
Вольфрамитовый к-т Шеелитовый к-т
Измельчение Измельчение
Селитра – Шихтование Сода Шихтование Кварцевый песок
Спекание Спекание
Спек Спек
(Na2WO4, Fe2O3, Mn3O4, примеси) (Na2WO4, CaSiO3, CaWO4, примеси)
Вода
Выщелачивание
Фильтрование
Хвосты (в отвал) Р-р Na2WO4, Na2SiO3, примеси
Очистка от примесей Si, P, As, Mo
Р-р Na2WO4 Отвальные кеки примесей
CaCl2 ––– Осаждение вольфрамата кальция
Осадок CaWO4 Маточный р-р (в трап)
Разложение –––– Соляная к-та
Фильтрование и промывка вольфрамовой кислоты
Вольфрамовая к-та Промывные воды
На прокаливание или аммиачную очистку
концентрат HCl
+ HNO3
РАЗЛОЖЕНИЕ
Осадок вольфрамовой кислоты NH4OH
РАСТВОРЕНИЕ
Раствор вольфрамата аммония
ВЫПАРИВАНИЕ
(ИЛИ НЕЙТРАЛИЗАЦИЯ)
КРИСТАЛЛИЗАЦИЯ
Кристаллы ПВА
ПРОКАЛИВАНИЕ
Вольфрамовый ангидрид (WO3)
Схема переработки шеелитовых концентратов по способу разложения соляной кислотой
Слайд 36Экстракционный способ переработки растворов вольфрамата натрия
4 (R3NH)HSO4(орг) + W12O396-(водн) +
2 Н+(водн)
(R3NH)4H2W12O39(орг) + 4 НSO4-(водн)
Эксрагент – амины (ТОА),
соли ЧАО
Реэкстракция – аммиачной водой (2 – 4 %)
Продукт процесса – раствор вольфрамата аммония
Источники сырья вольфрама
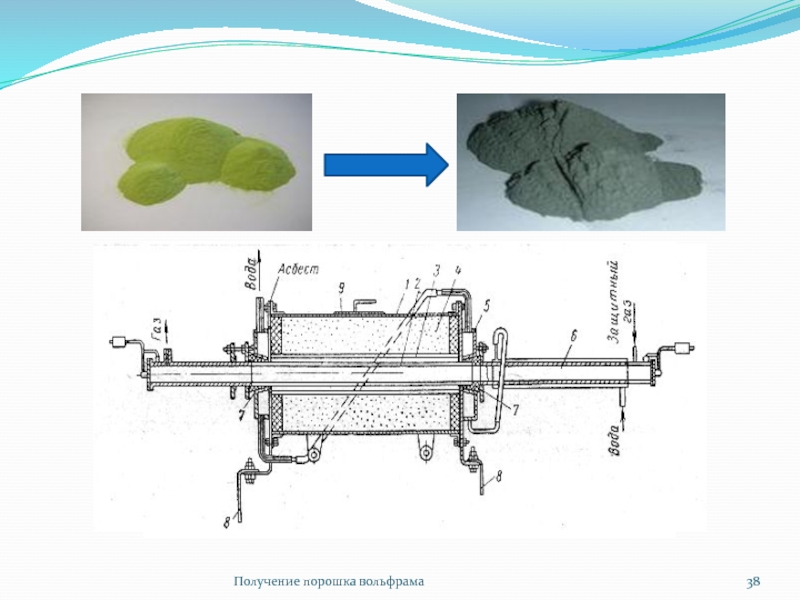
Слайд 37Восстановление WO3
Восстановление WO3
Лекция: Металлургия вольфрама
Водородом:
3 Н2 + WO3 =
W + 3 H2O
В системе W-O имеется 4 оксида:
WO3
WO2,9 WO2,72 WO2
Соответственно восстановление протекает в 4 стадии:
0,1Н2 + WO3 = WO2,9 + 0,1 H2O
0,18 Н2 + WO2,9 = 0,18 H2O + WO2,72
0,72 Н2+ WO2,72 = WO2 + 0,72 H2O
2 Н2 + WO2 = W + 2 H2O
Углеродом:
3 С + WO3 = W + 3 СO
Слайд 39Методы порошковой металлургии
Методы порошковой металлургии
Лекция: Металлургия вольфрама
1. Прессование заготовок
из порошков
1.1 Прессование штабиков в прессформах
1.2
Гидростатическое прессование
2. Спекание штабиков
2.1 Низкотемпературное спекание
2.2 Высокотемпературное спекание
2. Спекание крупных заготовок
3. Механическая обработка спеченных заготовок с
получением изделий (проволоки, ленты)
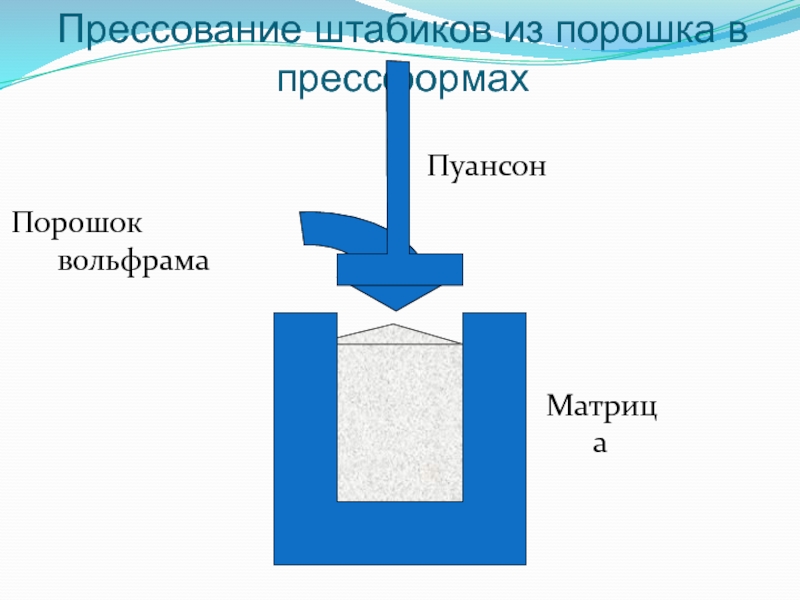
Слайд 40Прессование штабиков в пресс-формах
Слайд 41Прессование штабиков из порошка в прессформах
Порошок вольфрама
Матрица
Пуансон
Размеры штабика: (10-14)×(10-14)×450
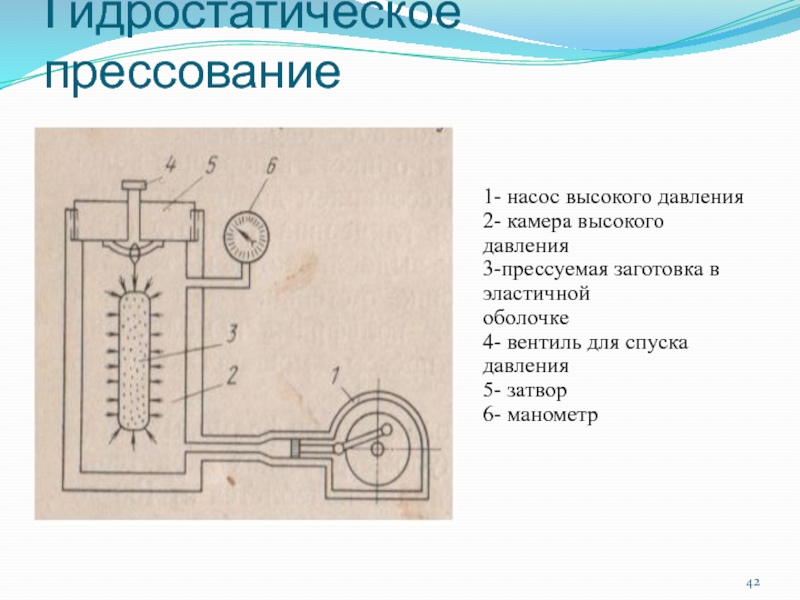
Слайд 42Гидростатическое прессование
1- насос высокого давления
2- камера высокого давления
3-прессуемая заготовка в
эластичной
оболочке
4- вентиль для спуска давления
5- затвор
6- манометр
Слайд 43Высокотемпературное спекание
Получение компактного вольфрама
1 – шины;
2 – токоподвод;
3 – верхний неподвижный контакт;
4 – штабик;
5 –
колпак;
6 – контактные вольфрамовые зажимы;
7 – нижний подвижный контакт;
8 – плита;
9 – противогруз.
Слайд 44Плавка вольфрама
Дуговая
Получение компактного вольфрама
1- вакуумное уплотнение штока
2- камера для
расходуемого электрода
3- подвижный шток
4- держатель электрода
5- корпус печи
6- патрубок к
вакуумному насосу
7- расходуемый электрод
8- медный кристаллизатор охлаждаемый водой
9- подвижный поддон
10- шток
11- вакуумное уплотнение
12- токоподвод
13- соленоид
14- окошко для наблюдения
15 токоподвод к электроду
Слайд 45Плавка вольфрама
Электронно-лучевая
Получение компактного вольфрама
1- катод электронной пушки
2- полый анод
3-
патрубок к вакуумной системе
4- электромагнитная катушка
5- диафрагма
6- шибер
7- плавильная камера
8-
электронный пучок
9- патрубок к вакуумной системе
10-слиток
11- медный кристаллизатор
12- механизм вытягивания слитка
13- переплавляемая заготовка
Слайд 471. ГРУППА ПО КЛАССИФИКАЦИИ РЕДКИХ МЕТАЛЛОВ, К КОТОРОЙ ОТНОСИТСЯ ВОЛЬФРАМ
… .
а) рассеянные
б) тугоплавкие
в) легкие
г) редкоземельные
д) радиоактивные
Слайд 482. Температура плавления вольфрама составляет … оС.
а) 820
б) 1670
в) 2620
г) 3400
д) 4200
Слайд 493. Плотность вольфрама … г/см3
а) 5,6
б) 7,2
в) 10,7
г) 15,4
д) 19,3
Слайд 504. валентность вольфрама в Наиболее устойчивых соединениях ….
а) 2
б) 3
в) 4
г) 5
д) 6
Слайд 51 5. Химическая формула вольфрамита - ….
а) CaWO4
б) (Fe,Mn)WO4
в) WS2
г) Na2WO4
д) (NH4)10W12O42
Слайд 526. Химическая формула шеелита - ….
а) CaWO4
б) (Fe,Mn)WO4
в) WS2
г) Na2WO4
д) (NH4)10W12O42
Слайд 537. Содержание WO3 в стандартных вольфрамовых концентратах …%.
а) 20-30
б) 30-50
в) 50-60
г) 60-70
д) 70-80
Слайд 548. способы разложения Шеелитовых концентратов: …
а) спекание с содой
б) автоклавно-содовое выщелачивание
в) разложение NaOH
г) разложение
НСl
д) разложение НF
Слайд 559. способы разложения Вольфрамитовых концентратов: …
а) спекание с содой
б) автоклавно-содовое
выщелачивание
в) разложение NaOH
г) разложение НСl
д) разложение NH4OH
Слайд 5610. температура спекания вольфрамсодержащих концентратов с содой … оС.
а) 300-400
б) 400-600
в) 600-800
г) 800-900
д) 900-1000
Слайд 5711. температура автоклавного-содового выщелачивания вольфрамовых концентратов … оС
а) 150-200
б) 200-250
в) 250-300
г)
300-350
д) 350-400
Слайд 5812. ДОБАВКИ в шихту При спекании шеелита с содой: …
.
а) СаО
б) SiO2
в) хвосты
г) NaNO3
д) FeO
Слайд 5913. ДОБАВКИ в шихту При спекании вольфрамита с содой …
.
а) СаО
б) SiO2
в)
хвосты
г) NaNO3
д) FeO
Слайд 6014. КОЛИЧЕСТВО ДОБАВЛЯЕМОГО ОКИСЛИТЕЛЯ – НАТРИЕВОЙ СЕЛИТРЫ ДЛЯ СПЕКАНИЯ ВОЛЬФРАМИТА
с СОДОЙ …%.
а) 1 – 4
б) 5 – 10
в) 10
– 20
г) 20 – 50
д) 50 – 60
Слайд 6115. НАЗНАЧЕНИЕ НАТРИЕВОЙ СЕЛИТРЫ ПРИ СПЕКАНИИ ВОЛЬФРАМИТА С СОДОЙ …
.
а) образование комплексов
б) выделение газовой фазы
в) ускорение процесса
г) снижение температуры
спекания
д) увеличение производительности аппарата
Слайд 6216. ФОРМУЛА КРЕМНИЙСОДЕРЖАЩЕГО СОЕДИНЕНИЯ ПРИ ОчисткЕ ОТ КРЕМНИЯ вольфрамсодержащих растворов
- … .
а) Na2SiO3
б) Ca2SiO4
в)
H2SiO3
г) SiO2
д) Na4SiO4
Слайд 6317. соединения, осаждаемые при очистке растворов вольфрамата натрия от фосфора
и мышьяка: …
а) гидроксид фосфора и мышьяка
б) фосфат и арсенат
магния
в) аммонийно-магниевый фосфат и арсенат
г) двойной сульфат фосфора и мышьяка
д) хлорид фосфора и мышьяка
Слайд 6418. смесь реагентов для Очистки растворов от фосфора и мышьяка
- … .
а) MgCl2+NH4OH
б) NaCl+NH4OH
в)
NaCl + MgCl2
г)NH4OH+CaCl2
д) HCl+MgCl2
Слайд 6519. СОЕДИНЕНИЕ МОЛИБДЕНА ПРИ ОчисткЕ ОТ НЕГО ВОЛЬФРАМСОДЕРЖАЩИХ растворов -
… .
а) Na2MoO4
б) MoS3
в) MoS2
г)CaMoO4
д) (NH4)2MoO4
Слайд 6620. Химическая формула паравольфрамата аммония - …
а) (NH4)2WO4
б) 5(NH4)2O·12WO3·nH2O
в) (NH4)2O∙W12O40·nH2O
г) (NH4)10H2 W12O42·nH2O
Слайд 6721. КОНЕЧНЫЙ ОБЪЕМ РАСТВОРА ПРИ ВЫДЕЛЕНИИ ПВА УпариваниеМ от первоначального
… .
а) 1/3
б) 1/2
в) 2/3
г) 3/4
д) 4/4
Слайд 6822. СОЕДИНЕНИЯ ДЛЯ ПОЛУЧЕНИЯ WO3 термическим разложением ….
а) H2WO4
б) ПВА
в) (NH4)2WO4
г) Na2WO4
д) СаWO4
Слайд 6923. Исходный материал для получения металлического вольфрама ….
а) H2WO4
б) WO3
в)ПВА
г) Na2WO4
д) СаWO4
Слайд 7024. СПОСОБЫ получЕНИЯ МеталлическОГО вольфрамА: …
а) восстановление водородом
б) металлотермия
в) восстановление углеродом
г) цементация
д) плавка
Слайд 7125. Химизм процесса спекания шеелита с содой -….
а) 2 FeWO4
+ 2 Na2CO3 + ½ O2 = 2 Na2WO4 +
Fe2O3 + 2 CO2
б) 3 MnWO4 + 3 Na2CO3 + ½ O2 = 3 Na2WO4 + Mn3O4 + 3CO2
в) CaWO4(тв) + Na2CO3(р-р) = Na2WO4(р-р) + CaCO3(тв)
г) CaWO4(тв) + Na2CO3(тв) = Na2WO4(тв) + CaCO3(тв)
Слайд 7226. Химизм процесса спекания вольфрамита с содой:….
а) 2 FeWO4 +
2 Na2CO3 + ½ O2 = 2 Na2WO4 + Fe2O3
+ 2 CO2
б) 3 MnWO4 + 3 Na2CO3 + ½ O2 = 3 Na2WO4 + Mn3O4 + 3CO2
в) CaWO4(тв) + Na2CO3(р-р) = Na2WO4(р-р) + CaCO3(тв)
г) CaWO4(тв) + Na2CO3(тв) = Na2WO4(тв) + CaCO3(тв)
Слайд 7327. Химизм процесса автоклавно-содового разложения шеелита -… .
а) 2 FeWO4
+ 2 Na2CO3 + ½ O2 = 2 Na2WO4 +
Fe2O3 + 2 CO2
б) 3 MnWO4 + 3 Na2CO3 + ½ O2 = 3 Na2WO4 + Mn3O4 + 3CO2
в) CaWO4(тв) + Na2CO3(р-р) = Na2WO4(р-р) + CaCO3(тв)
г) CaWO4(тв) + Na2CO3(тв) = Na2WO4(тв) + CaCO3(тв)
Слайд 7428. ДОБАВКА В шихтУ ДЛЯ избежаниЯ расплавления в печи в
процессе спекания вольфрамовых концентратов с содой ….
а) СаО
б) SiO2
в) хвосты
г) NaNO3
д) FeO
Слайд 75 29. способы получения ПВА: …
а) нейтрализация
б) выпарка
в) спекание
г) восстановление
д) плавка
Слайд 7630. способы получЕНИЯ КомпактнОГО вольфрамА: …
а) порошковая металлургия
б)
восстановление водородом
в) плавка
г) восстановление углеродом
д) восстановление
натрием
Слайд 7731. СООТВЕТСТВИЕ НАЗВАНИЯ МИНЕРАЛА И ЕГО ХИМИЧЕСКОЙ ФОРМУЛЫ:
1) Шеелит
2) Вольфрамит
а) Na2WO4
б) (NH4)WO4
в) (Fe,Mn)WO4
г) CaWO4
Слайд 7832. Последовательность переработки шеелитовых концентратов методом спекания с содой и
кварцевым песком:
а) шихтовка
б) водное выщелачивание
в) спекание
г) переработка раствора
Слайд 7933. Последовательность переработки шеелитовых концентратов разложением соляной кислотой:
а) выщелачивание соляной
кислотой
б) аммиачное выщелачивание вольфрамовой кислоты
в) прокалка ПВА
г) нейтрализация растворов
Слайд 8034. Последовательность переработки вольфрамитовых и шеелитовых концентратов спеканием с содой:
а)
очистка раствора Na2WO4 от примесей
б) выпарка и кристаллизация с получением
ПВА
в) выщелачивание с получением Na2WO4
г) осаждение искусственного шеелита
д) спекание с содой
Слайд 8135. ПОСЛЕДОВАТЕЛЬНОСТЬ ОперациЙ в технологической схеме переработки растворов вольфрамата натрия
(Na2WO4):
а) очистка от молибдена
б) очистка от фтора и кремния
в)
очистка от мышьяка и фосфора
г) осаждение искусственного шеелита
д) разложение HCl с получением технической вольфрамовой кислоты