Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Металлы
Содержание
- 1. Металлы
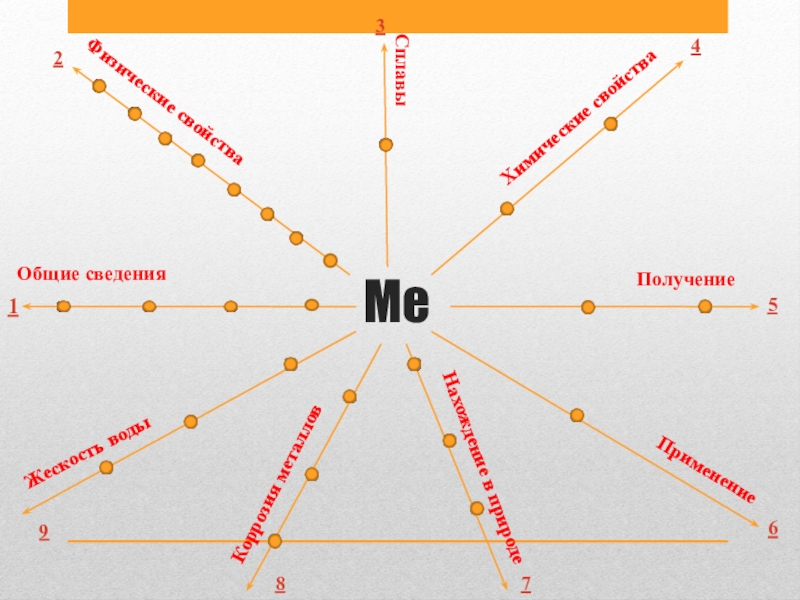
- 2. Me123456789Общие сведения Физические свойства СплавыХимические свойства ПолучениеПрименениеНахождение в природе Коррозия металловЖескость воды
- 3. 1.Общие сведения 2.Физические свойства 3.Сплавы 4.Химические свойства
- 4. Положение в ПСВ периодической системе более 3/4
- 5. Строение атомаК металлам относится большинство известных химических
- 6. Радиус атома увеличивается по группе сверху вниз, по периоду увеличивается справа налево.Радиус(по периодам)
- 7. Степени окисленияСтепень окисления: для металлов d –
- 8. Агрегатное состояниеПри обычных условиях все металлы (за
- 9. ТвердостьПри сравнении твердости различных веществ более твердым
- 10. ПластичностьПластичность — способность изменять форму под действием
- 11. Электро- и ТеплопроводностьКак вы уже знаете, металлы
- 12. ПлотностьВажной характеристикой металлов является плотность. Ее величина
- 13. БлескДля компактных металлов с гладкой поверхностью характерен
- 14. ЦветВ измельченном состоянии (в виде пыли или
- 15. Растворимость в водеЛюбой металл растворяется в воде,
- 16. СплавыСплавы – это системы, состоящие из двух
- 17. Взаимодействие с простыми веществами – неметалламиа) с
- 18. Взаимодействие со сложными веществамиа) Щелочные и щелочноземельные
- 19. Пирометаллургия - совокупность металлургических процессов, протекающих при
- 20. ЭлектролизЭлектролизом называется окислительно-восстановительный процесс, протекающий на электродах
- 21. ПрименениеЗолото - используют для изготовления деталей аппаратура
- 22. Свободное состояние(самородки)Подавляющее число металлов в природе находятся
- 23. В виде соединенийХимически активные металлы в природных
- 24. По нахождению в земной кореПо содержанию в
- 25. Коррозия металловКорро́зия — это самопроизвольный окислительно-восстановительный процесс
- 26. КоррозияПри температуре 250-300°C появляется видимая пленка оксидов.
- 27. Защита от коррозииВсе метода защиты металлов от
- 28. Жесткость воды• Жесткость воды — это совокупность
- 29. Жесткость воды
- 30. Способы устранения жесткости воды
- 31. Скачать презентанцию
Слайды и текст этой презентации
Слайд 2Me
1
2
3
4
5
6
7
8
9
Общие сведения
Физические свойства
Сплавы
Химические свойства
Получение
Применение
Нахождение в природе
Коррозия металлов
Жескость воды
Слайд 31.Общие сведения 2.Физические свойства 3.Сплавы 4.Химические свойства 5.Получение 6.Применение 7.Нахождение в природе 8.Коррозия металлов и пути ее
устранения
9.Жескость воды,способы ее устранения
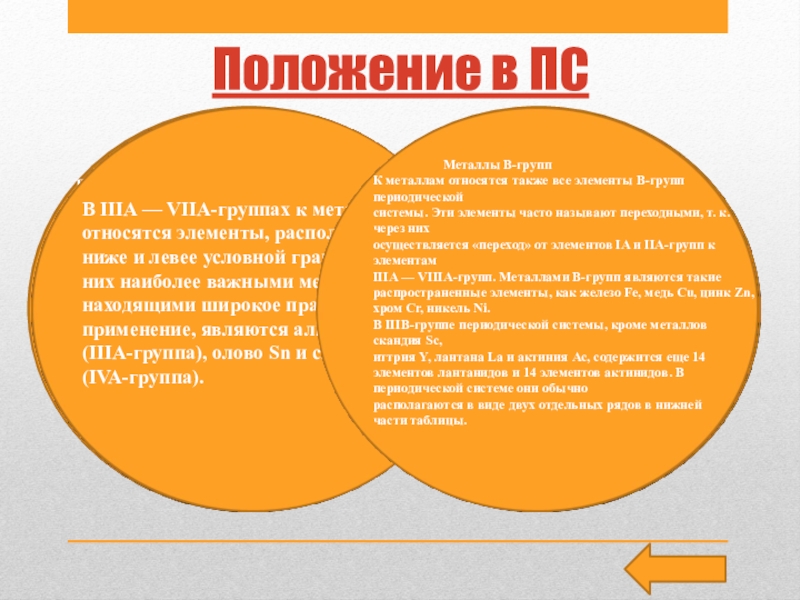
Слайд 4Положение в ПС
В периодической системе более 3/4 мест занимают металлы:
они находятся в I, II, III группах, в побочных подгруппах
всех групп. Кроме того, металлами являются наиболее тяжелые элементы IV, V, VI и VII групп.Лучшие восстановители — металлы I и II групп главных подгрупп.
Металлы А-групп
Из элементов А-групп периодической системы к металлам относятся
все элементы IA-группы (кроме Н), IIA-группы, а также некоторые элементы IIIA — VIA-групп, расположенные ниже и левее условной границы. Металлы А-групп находятся как в малых, так и в больших периодах
системы элементов.
В IА-группе периодической системы находятся металлы литий Li,
натрий Na, калий K, рубидий Rb, цезий Cs и франций Fr. Их общее групповое название — щелочные металлы, т. к. их гидроксиды являются
щелочами. В атомах этих элементов на внешних энергетических уровнях
содержится по 1 электрону. По мере возрастания атомных номеров элементов их металлические свойства, т. е. способность атомов отдавать валентные электроны, возрастают. Соответственно, химическая активность
щелочных металлов при переходе от лития к францию усиливается.
IIА-группу периодической системы образуют элементы бериллий Be,
магний Mg, кальций Ca, стронций Sr, барий Ba и радий Ra. В их атомах
на внешних энергетических уровнях содержится по 2 электрона. По мере
возрастания атомных номеров элементов в ряду Be — Ra способность атомов отдавать валентные электроны, а значит, и химическая активность
простых веществ металлов возрастают. Элементы Ca, Sr, Ba и Ra образуют семейство так называемых щёлочноземельных металлов.
В IIIA — VIIA-группах к металлам относятся элементы, расположенные ниже и левее условной границы. Из них наиболее важными металлами, находящими широкое практическое применение, являются алюминий Al (IIIA-группа), олово Sn и свинец Pb (IVA-группа).
Металлы В-групп
К металлам относятся также все элементы В-групп периодической
системы. Эти элементы часто называют переходными, т. к. через них
осуществляется «переход» от элементов IA и IIA-групп к элементам
IIIА — VIIIA-групп. Металлами В-групп являются такие распространенные элементы, как железо Fe, медь Cu, цинк Zn, хром Cr, никель Ni.
В IIIВ-группе периодической системы, кроме металлов скандия Sc,
иттрия Y, лантана La и актиния Ас, содержится еще 14 элементов лантанидов и 14 элементов актинидов. В периодической системе они обычно
располагаются в виде двух отдельных рядов в нижней
части таблицы.
Слайд 5Строение атома
К металлам относится большинство известных химических элементов — 95
из 118. Это некоторые элементы А-групп и все элементы В-групп.
В таблице периодической системы металлы отделены от неметаллов границей — ступенчатой линией, идущей от водорода H к оганесону Og. Эта граница достаточно условна, так как некоторые элементы, примыкающие к ней (кремний Si, германий Ge, мышьяк As, сурьма Sb, теллур Te), обладают как металлическими, так и неметаллическими свойствами. Эти элементы иногда называют полуметаллами.Все периоды периодической системы элементов (кроме первого) начинаются металлами. Как вам уже известно, в периодах по мере увеличения атомного номера элементов (т. е. в направлении слева направо) радиусы атомов уменьшаются. По этой причине радиусы атомов металлов всегда больше, чем радиусы атомов неметаллов того же периода.
В атомах подавляющего большинства металлов (80) на внешних энергетических уровнях находится по 1—2 электрона. Из-за большого радиуса атомов металлов электроны их внешних энергетических уровней слабо
притягиваются к ядрам. Поэтому атомы металлов (Me0 ) сравнительно
легко отдают электроны и превращаются в положительно заряженные
ионы — катионы (Me n+ ):
Me . 0 − ne− Me n+
По этой причине для металлов в сложных веществах характерны
только положительные степени окисления. Способность атомов (и простых веществ) металлов отдавать электроны определяет их металлические свойства. Чем меньше число электронов на внешнем электронном
слое и чем больше радиус атома металла, тем сильнее выражены его металлические свойства. Электроотрицательность атомов металлов ниже, чем атомов неметаллов.
Слайд 6Радиус атома увеличивается по группе сверху вниз, по периоду увеличивается
справа налево.
Радиус(по периодам)
Слайд 7Степени окисления
Степень окисления: для металлов d – семейства характерно образование
оксидов различного состава, отвечающих возможным степеням окисления металла: CrO (+2),
Cr2O3 (+3), CrO3 (+6), MnO (+2), MnO2 (+4), Mn2O7 (+7).Слайд 8Агрегатное состояние
При обычных условиях все металлы (за исключением ртути, её
температура плавления — –39 °C) являются твёрдыми веществами.
Отражательная способность –
выражена у серебра и индия, платины. Состояние металла (сплава) с различным механизмом взаимодействия ионов. Различают твердое, жидкое, газообразное. Металлы и сплавы в каждом агрегатном состоянии существуют при определенных условиях (температуре, концентрации). При изменении этих условий металл (сплав) может переходить из одного агрегатного состояния в другое.Слайд 9Твердость
При сравнении твердости различных веществ более твердым считается то, которое
оставляет след на другом при
царапании.
Наибольшей твердостью из
металлов обладает хром
Cr,заостренной палочкой из которого можно легко писать по стеклу. Самый мягкий металл — цезий Cs. Из металлов, имеющих широкое применение, наиболее мягкими являются олово Sn и свинец Pb.
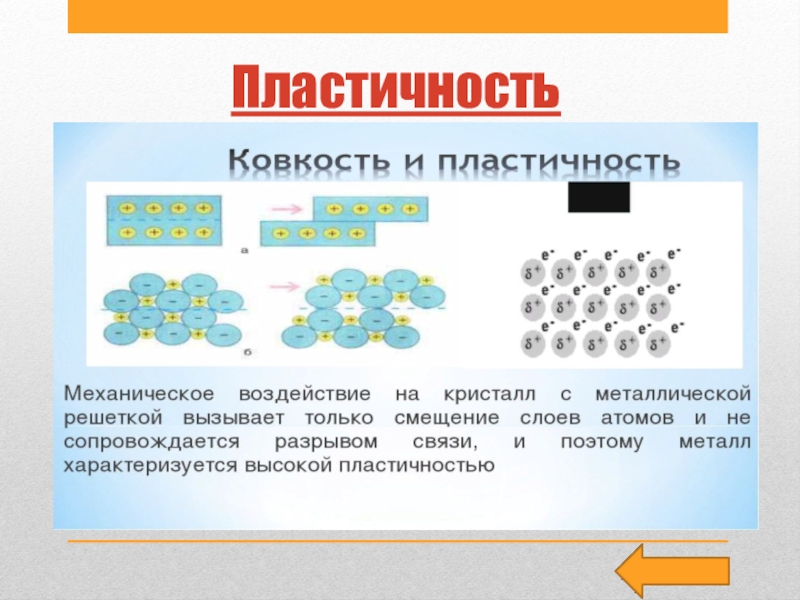
Слайд 10Пластичность
Пластичность — способность изменять форму под действием внешних
сил и сохранять
полученную форму после прекращения этого действия.
На практике пластичность металлов проявляется
в том, что при определенном усилии они изгибаются или растягиваются, а под ударами молотане дробятся, а расплющиваются, т. е. являются ковкими.
Пластичность металлов обусловлена тем, что при механическом воздействии слои атомов и катионов, удерживающиеся в кристалле «электронным газом», легко смещаются, как бы скользя друг по другу. Смещение происходит не беспорядочно, а таким образом, что одна часть кристалла сдвигается относительно другой без разрушения кристалла.Первое место по пластичности среди металлов занимает золото Au.
Как это ни удивительно, но из образца данного металла массой 1 г можно
изготовить чрезвычайно тонкую, полупрозрачную пластинку толщиной
0,0002 мм (рис. 122) и общей площадью 28 м2
или вытянуть тончайшую проволоку диаметром 0,002 мм и длиной 3420 м. Металл с самой низкой пластичностью, т. е. самый хрупкий, — сурьма Sb. При механических воздействиях он крошится.
Слайд 11Электро- и Теплопроводность
Как вы уже знаете, металлы в компактном состоянии
хорошо
проводят электрический ток и тепло. Эти свойства, называемые электро и
теплопроводностью, обусловлены наличием в металлах свободных электронов.Самой высокой электропроводностью обладает серебро Ag, самой низкой — титан Ti. Если электропроводность серебра условно принять равной 1, то у титана она составляет всего 0,003.
Серебро как проводник электрического тока используется в производстве ряда электротехнических изделий. Из-за высокой стоимости его не применяют для изготовления проводов и кабелей. Для этих целей пригодны
менее дорогие медь, алюминий и железо.Между электропроводностью и теплопроводностью металлов
существует определенная связь: чем выше электропроводность металла, тем выше его теплопроводность. Следует отметить, что при повышении температуры способность металлов проводить электрический ток и теплоту
уменьшается.
Слайд 12Плотность
Важной характеристикой металлов является плотность. Ее величина изменяется в широком
интервале значений. Металлом с самой большой плотностью, равной 22,59 г/см3,
является осмий Os. Нетрудно подсчитать, что масса кубика осмия объемом 1дм3 (т. е. 1 л) составляет 22,59 кг!Самой низкой плотностью, равной 0,53 г/см3, обладает металл литий Li.
Он легче воды, плотность которой, как известно, составляет 1 г/см3. В промышленности металлы условно разделяют на легкие (с плотностью ниже 5 г/см3) и тяжелые (с плотностью выше 5 г/см3). К легким металлам относятся широко используемые в самолетостроении алюминий Al (2,7 г/см3), магний Mg (1,74 г/см3), титан Ti (4,5 г/см3).
Слайд 13Блеск
Для компактных металлов с гладкой поверхностью характерен металлический блеск, связанный
со способностью отражать световые лучи, что
используется при изготовлении зеркал.
Большинство металлов
в компактном состоянии серебристо-белые.Только три металла имеют отчетливо выраженную окраску: медь Cu —
коричневатo-розового, а золото Au и цезий Cs — желтого цветов
Слайд 14Цвет
В измельченном состоянии (в виде пыли или пудры) цвет большей
части металлов темно-серый, темно-бурый или черный. Лишь немногие металлы при
измельчении не изменяют свою окраску. Это, например, медь,магний и алюминий.
В металлургической промышленности все металлы условно разделяют на черные и цветные. К черным металлам относится железо и
сплавы на его основе (чугун, сталь), поскольку в необработанном виде они
покрыты черной пленкой оксида железа Fe3O4. К цветным относятся все
остальные металлы и их сплавы.
Слайд 15Растворимость в воде
Любой металл растворяется в воде, однако растворимость металлов
изменяется в очень широких пределах. Щелочные металлы бурно взаимодействуют с
водой, при этом выделяется из воды водород и образуется раствор гидроксида. Растворяются в воде и щелочно-земельные металлы: бериллий, магний, кальций, стронций, барий и радий. А гидроксид радия по коррозионной активности даже превышает гидроксид калия.Серебро практически не реагирует с водой, тем не менее процесс перехода частиц серебра в воду происходит, и получается лечебная «серебряная вода». Таким образом, одни металлы хорошо растворяются в воде, другие – крайне плохо.
Слайд 16Сплавы
Сплавы – это системы, состоящие из двух или более металлов,
а также металлов и неметаллов.
Одни из важнейших сплавов:
Латунь – медно-цинковые
сплавы разного состав, обычно ≈60% меди и ≈40% цинка; есть сплавы, содержащие 90% меди и 10% цинка.Бронза – сплав меди, цинка, олова(иногда-свинец).Обычно 90% меди и 10% олова.
Мельхиоры – сплавы меди с никелем с добавками железа и марганца. Наибольшую твёрдость имеет сплав такого состава: 50% меди и 50% никеля. Для изготовления посуды применяют сплавы, в которых 53% меди, 27% никеля и 20% цинка, и белый сплав(нейзильбер), содержащий 65% меди, 20% цинка и 15% никеля. В электротехнике используются следующие сплавы: константан (59% меди, 40% никеля и 1% марганца) и никелин (68% меди и 32% никели).
Дюралюминий(дуралюмин) – сплав алюминий с небольшими количествами меди, марганца и магния. Обладая лёгкостью, он по твердости приближается к стали. Легкие сплавы на основе магния: двух-металл(87,8% магния ,8,5% алюминия, 0,2% марганца, 2% меди, 1% кадмия, 0,5% цинка); электрон (магния более 80%, алюминия от2 до 10% и небольшие количества марганца, цинка, бериллия, титана, висмута).
Моннель-металл – сплав, содержащий 70% никеля и 30% меди.
Чугун – сплав железа с углеродом (w(C) > 2%), содержащий также 0,2-3,75% кремния, 0,2-1,75% марганца, 0,1-1,2% фосфора, 0,02- 0,08% серы.
Сталь – сплав железа с углеродом (w(C) = 0.1-2%). Легированная сталь – сталь со специальными добавками, придающими ей определенные свойства(45-95% железа, 0,5-0,8% марганца, 0,17-0,37% кремния). Нержавеющая сталь содержит 74% железа, 8% хрома, 8% никеля и др.
Припои – металлы и сплавы, применяемые для спаивания двух кусков металлов. Различают припои легкоплавкие и тугоплавкие. К легкоплавким относят сплавы олова и свинца – третник(63% олова, 37% свинца). К тугоплавким относятся, например, такие: 36-65% меди, 35-64% цинка.
Победит – сплав, содержащий смесь wC и CoС(90% wC и 10% CoС).
Нихром – сплав никеля, хрома, железа и марганца(55-78% никеля, 15-23% хрома, 0,5-3% железа).
Слайд 17Взаимодействие с простыми веществами – неметаллами
а) с галогенами металлы образуют
соли – галогениды: Mg+Cl2=MgCl2 , Zn+Br2=ZnBr2 , 2Na+Cl2→2NaCl.
б) с кислородом,
образуя оксиды: 2Mg+O2→2MgO, 4Na+O2=2Na2O.в) с серой, образуя сульфиды: Zn+S→ZnS, Fe+S=FeS.
г) с водородом самые активные металлы образуют гидриды: Ca+H2=CaH2
д) с углеродом многие металлы образуют карбиды: Ca+2C=CaC2
Слайд 18Взаимодействие со сложными веществами
а) Щелочные и щелочноземельные металлы взаимодействуют с
водой при обычных условиях, образуя растворимое в воде основание (щёлочь)
и водород: 2Na+2H2O→2NaOH+H2.!!! Некоторые металлы средней активности реагируют с водой при повышенной температуре, образуя оксид металла и водород. 3Fe+4H2O→FeO⋅Fe2O3+4H2.
б) с разбавленными кислотами, в результате чего образуются соли и выделяется водород: 2Al+3H2SO4→Al2(SO4)3+3H2, 2Al+6HCl=2AlCl3+3H2
в) с растворами солей менее активных металлов, в результате чего образуется соль более активного металла, а менее активный металл выделяется в свободном виде: Fe+CuSO4=FeSO4+Cu
Слайд 19Пирометаллургия - совокупность металлургических процессов, протекающих при высоких температурах (обжиг,
плавка, конвертирование, рафинирование, дистилляция). Если в руде металл находится в
виде сульфидных соединений, то руду вначале подвергают обжигу, при этом сульфиды переходят в оксиды:2ZnS + 3O2 = 2ZnO + 2SO2
Карбонатные руды с этой же целью также предварительно подвергают прокаливанию:
ZnCo3 =t ZnO + CO2;
FeCO3 = FeO + CO2.
Для восстановления металлов из оксидов используют такие восстановители, как кокс или оксид углерода(II)(карботермия), водород(водородотермия), алюминий(алюмотермия), магний(магнийтермия), кремний(кремнийтермия).
Углерод в виде кокса – дешевый и доступный восстановитель. При соответствующих высоких температурах углерод может восстановить практически любой металл, даже такие активные, как щелочные, щелочноземельные, магний, алюминий:
Na2CO3 + 2C =t 2Na + 3CO.
На практике углерод используется для получения из оксидов таких металлов, как железо, медь, цинк, свинец, кобальт, никель, хром, марганец, олово:
Fe3O4 + 4C =t 3Fe + 4CO;
SnO2 + 2C =t Sn + 2CO;
ZnO + C =t Zn+ CO.
Водород – более мягкий восстановитель, чем углерод.
Практически водородным восстановлением получают молибден, вольфрам, рений(реже-железо, никель):
WO3 + 3H2 =t W + 3H2O/
Алюминий – один из наиболее энергичных восстановителей, что объясняется высокой теплотой образования его оксида(Q=+1676 кДж/моль). Алюминий широко используется для получения таких металлов, как хром, железо, кобальт, никель:
Cr2O3 + 2Al =t 2Cr + Al2O3.
Реже алюмотермия используется для получения щелочноземельных металлов:
4CaO + 2Al =t Ca(AlO2)2 + 3Ca.
Ещё более энергичным восстановителем является магний:
TiCl4(г) + 2Mg(ж) =t Ti(т) + 2MgCl2(ж);
BeO + Mg =t MgO + Be.
Кальций используют для получения более летучего цезия:
Ca + 2CsCl =t CaCl2 + 2Cs.
Гидрометаллургия охватывает способы получения металлов из растворов их солей. Металл из руды сначала переводят в раствор, затем из этого раствора извлекают:
CuO + H2SO4 = CuSO4 + H2O.
Затем меди извлекают из раствора электролизом либо вытесняют из сульфата железом:
CuSO4(р-р) + Fe(т) = Cu(т) + FeSO4(р-р).
Электрометаллургия – получение металлов с помощью электролиза. Таким способом получают наиболее активные металлы:
2Al2O3 =эл.ток 4Al + 3O2.
Получение
Слайд 20Электролиз
Электролизом называется окислительно-восстановительный процесс, протекающий на электродах при прохождении электрического
тока через расплав или
раствор электролита. Сущность электролиза состоит в том,
что за счет электрической энергии осуществляется химическая реакция, которая не может протекать самопроизвольно.Электролиз расплавов и электролиз растворов отличаются друг от друга. В растворе соли кроме ионов металла и кислотного остатка присутствуют молекулы воды и ионы Н+, ОН" — продукты диссоциации Н20. Поэтому при рассмотрении реакций на электродах необходимо учитывать возможность участия молекул Н20 в электролизе.
Для определения результатов электролиза водных растворов существуют следующие правила: Процесс на катоде не зависит от материала катода,
а зависит от положения металла в электрохимическом ряду напряжений:
1. Если катион электролита находится в начале ряда напряжений (по А1 включительно), то на катоде идет процесс восстановления воды (выделяется Н2Т):
2Н20 + 2е- = Н2 + 20Н-
Катионы металла не восстанавливаются, остаются в растворе.
2. Если катион электролита находится в ряду напря жений между алюминием и водородом, то на катоде восстанавливаются одновременно и ионы металла,
и молекулы воды.
3. Если катион электролита находится в ряду напряжений после водорода, то на катоде идет только процесс восстановления ионов металла.
4. Если в растворе находится смесь катионов разных металлов, то первыми восстанавливаются катионы того металла, который имеет наибольшее алгебраическое
значение электродного потенциала.
Электролиз широко используют в промышленности для выделения и очистки металлов, получения щелочей, хлора, водорода. Алюминий, магний, натрий, кадмий получают только электролизом. Очистку меди, никеля, свинца проводят целиком электрохимическим методом.
Важной отраслью применения электролиза является защита металлов от коррозии; при этом электрохимическим методом на поверхность металлических изделий наносится тонкий слой другого металла (хрома, серебра,
меди, никеля, золота), устойчивого к коррозии.
Слайд 21Применение
Золото - используют для изготовления деталей аппаратура и приборов, которые
эксплуатируются в агрессивных средах; расходуется на нужды электронной и ювелирной
промышленности.Серебро -используют для изготовления деталей аппаратура и приборов, которые эксплуатируются в агрессивных средах и для изготовления электрических контактов, фотоматериалов, ювелирных изделий.
Платина - используют для изготовления деталей аппаратура и приборов, которые эксплуатируются в агрессивных средах.
В живом организме содержится большое число ионов различных металлов(особенно Mg2+, Ca2+, Na+, K+. В составе ферментов присутствуют металлы V, Mn, Fe, Cu, Zn, Co, Ni, Mo, Cr и др. Многие металлы являются важными для нормального развития растений и входят в состав микроудобрений.(Zn. Cu. Mo и др.)
Легирующие добавки(W, Mo, Cr, V, Ni)
Электротехника(Cu, Al, Ag)
Защита от коррозии(Zn, Sn, Ni, Cr)
Конструкционные материалы(Fe, Mg, Ti, Al)
Катализаторы(Pt, Fe, Ni, Pd)
Ядерная энергетика(U, Pu)
Слайд 22Свободное состояние(самородки)
Подавляющее число металлов в природе находятся в виде соединений,
за исключением только наименее активных металлов. Например, Cu, Ag, Au,
Pt, которые встречаются не только в виде соединений, но и в самородном состоянии.Слайд 23В виде соединений
Химически активные металлы в природных условиях находятся только
в виде соединений. Форма природного соединения металла зависит от его
активности. Наиболее активные щелочные металлы находятся в природе в виде галогенидов, нитратов, сульфатов, из – редка – карбонатов. Все эти соединения хорошо растворимы в воде, поэтому месторождение щелочных металлов главным образом сосредоточено в морях, и океанах, соленых озерах, подземных минеральных источниках. Для менее активных щелочноземельных металлов и магния галогенидные и нитратные месторождения, хотя и встречаются, не так характерны. Наиболее типичны для них малорастворимые в воде сульфаты и карбонаты.Слайд 24По нахождению в земной коре
По содержанию в земной коре металлы
очень сильно различаются. Наиболее распространенный металл – алюминий, затем железо,
кальций, натрий, калий и магний. Все лантаниды, массовая доля которых в земной коре менее 0,1%, являются редкими. Рассеянными называют элементы, не образующих собственных руд, а встречаются в качестве примеси к другим элементам (Sc, Ga, In, Ti, Hf). Соединения металлов входят в состав руд и минералов. Руда – горная порода, получение из которой чистого металла экономически выгодно. Минералы – это природные соединения, имеющие определенный химический состав и свойства.Слайд 25Коррозия металлов
Корро́зия — это самопроизвольный окислительно-восстановительный процесс разрушения металлов и
сплавов при их контакте с веществами окружающей среды.
Различают два основных
вида коррозии – химическую и электрохимическую.Химическая коррозия металлов - это самопроизвольное разрушение металлов сухими газами(газовая коррозия), обладающими окислительными свойствами(кислород, галогены, оксид серы(IV) и т. п.). Наиболее распространена химическая коррозия в атмосфере кислорода(воздуха), сопровождающаяся образованием оксидов металлов:
Me +n/4O2 = MeOn/2 , где n – степень окисления металла.
Если оксидная пленка покрывает металл сплошным слоем, то процесс диффузии тормозится , и по мере утолщения пленки коррозия замедляется. В этом случае оксидная плёнка выполняет защитную роль(Al, Ca, Ni, Mn, Ti, Cr, Zn). Оксидная плёнка на поверхности щелочных металлов и железа имеет разрывы, легко отслаивается, поэтому эти металлы не предохраняет от дальнейшей коррозии.
4Ag + 2H2S + O2 = 2Ag2S + 2H2O;(почернение серебряных изделий)
2Cu + CO2 + O2 +H2O = (CuOH)2CO (позеленение медных изделий)
Патина
4Fe + 3O2 = 2Fe2O3;(ржавление железа на воздухе)
8Fe + 6NO2 = 4Fe2O3 + 3N2.
Слайд 26Коррозия
При температуре 250-300°C появляется видимая пленка оксидов. При температуре 600°C
и выше поверхность металла покрывается слоем окалины, состоящей из различных
оксидов железа:FeO, Fe2O3, Fe3O4. Окалина не защищает металл от дальнейшего окисления.Примеси, находящиеся в нефти, бензинах, могут вызывать довольно сильную коррозию.
Особенно опасны в этом отношении соединения серы. В чистых углеводородах при отсутствии влаги коррозия стальных изделий почти не наблюдается.
Электрохимическая коррозия – взаимодействие металла с веществами в растворе электролита, в результате которой осуществляется переход электронов от одних участков металла к другим , т. е. появляется электрический ток.
Электрохимическая коррозия обусловлена наличием в металле примесей других металлов и некоторых неметаллов, в результате чего поверхность металла становится энергетически неоднородной. Примеси образуют с основным металлом множество микрогальванических пар, в которых основной металл, железо, играет роль анода и окисляется. Роль окислителя в нейтральной и щелочной средах выполняют молекулы кислорода и воды, которые восстанавливаются на катоде:
O2 + 2H2O+ 4е- = 4OH-;
2H2O + 2е- = 2OH- + H2-
А в кислой – ионы водорода:
2H- + + 2е- = H2
В итоге образуется ржавчина, имеющая примерный состав Fe2O3 * xH2O
Зависимость коррозии от положения металлов в э/x ряду используется для защиты от разрушения основного металла посредством покрытия его более активным металлом. С этой целью железо часто покрывают цинком.
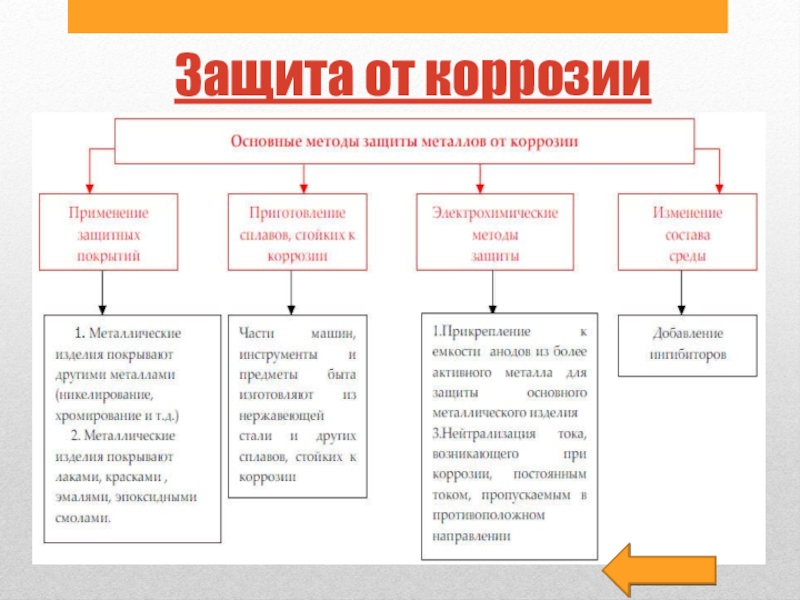
Слайд 27Защита от коррозии
Все метода защиты металлов от коррозии можно поделить
условно подразделить на группы: а) легирование металлов; б) защитные покрытия;
в) изменение свойств коррозийной среды.Легирование металлов
В состав металла вводят компоненты, повышающие пассивность металла(хром, никель, вольфрам, молибден, алюминий и др.).
Эти металлы при высоких температурах окисляются энергичнее, чем железо, и образуют при этом плотные защитные плёнки оксидов.
Металлические покрытия.
Металлические изделия хромируют, никелируют, цинкуют и т. д. Лужение – покрытие поверхности металлов оловом. Луженые листы стали называются белой жестью.
Неметаллические защитные покрытия
Наиболее распространены и незаменимы лакокрасочные покрытия – лаки и краски. Лаки состоят из смеси смолы. Краски представляют собой смесь нерастворимых частиц красителя(оксиды Zn, Cr и тд).
Целям защиты от коррозии служат ингибиторы, т. е. вещества, значительно уменьшающие скорость коррозии( формальдегид, уротропин, диэтиламин и тд).
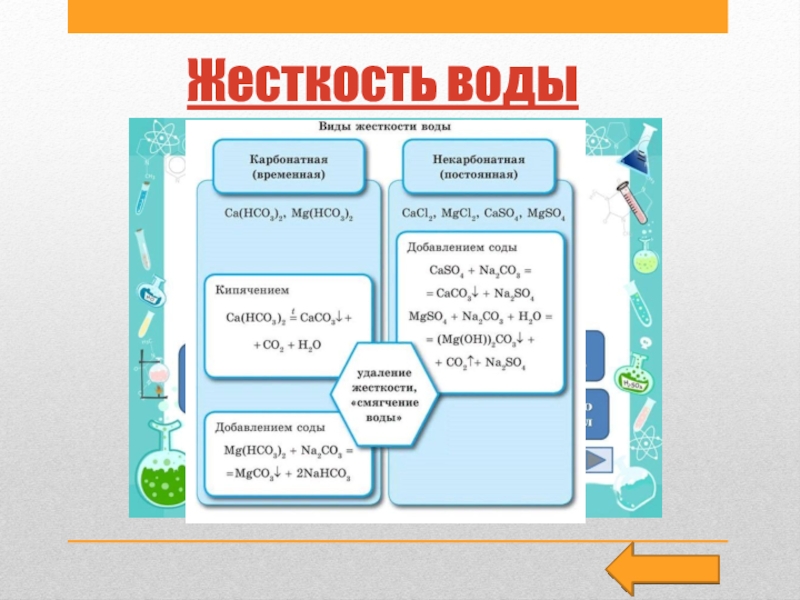
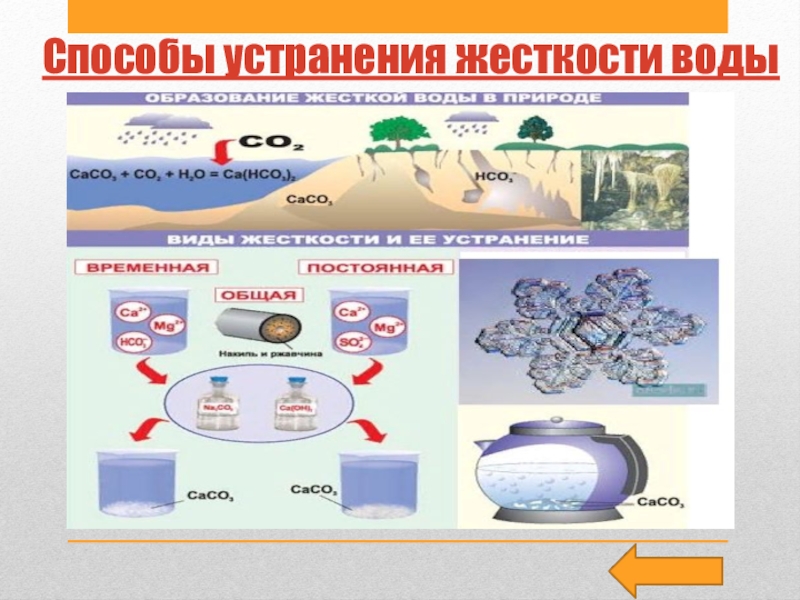
Слайд 28Жесткость воды
• Жесткость воды — это совокупность свойств, обусловленных содержанием
в воде катионов кальция Са2+ и магния М2+.Один из возможных
их источников — горные породы(известняки, доломиты), которые растворяются в результате контакта с природной водой.
Анионами растворимых солей Са2+ и М2+ могут быть гидрокарбонат-ионы НС03-, сульфат-ионы S04 2- и реже хлорид-ионы СL - . Различают временную (карбонатную) жесткость воды, обусловленную наличием в воде гидрокарбонатов кальция Са(НС03)2 и магния Мg(НС03)2, и постоянную жесткость воды, обусловленную наличием в воде сульфатов кальция и магния СаS04, МgS04, хлоридов кальция и магния СаСl2, МgСl2
и других солей.