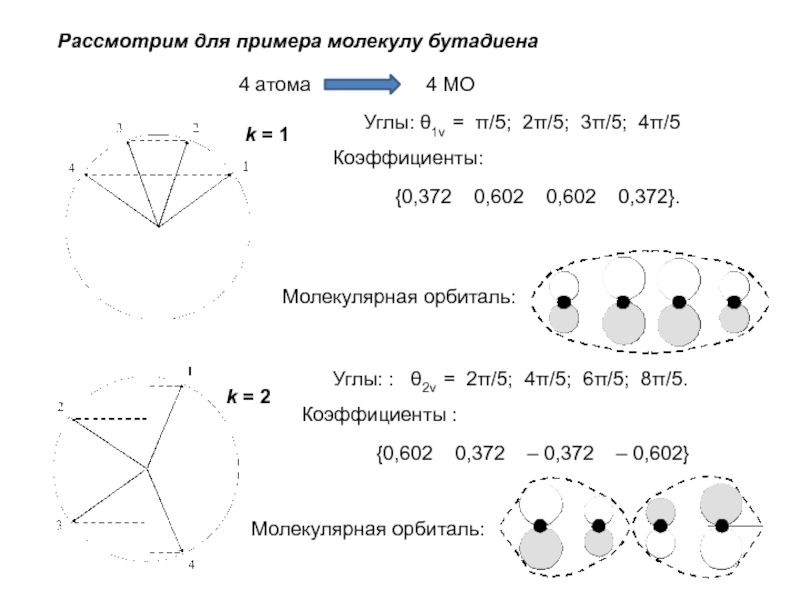
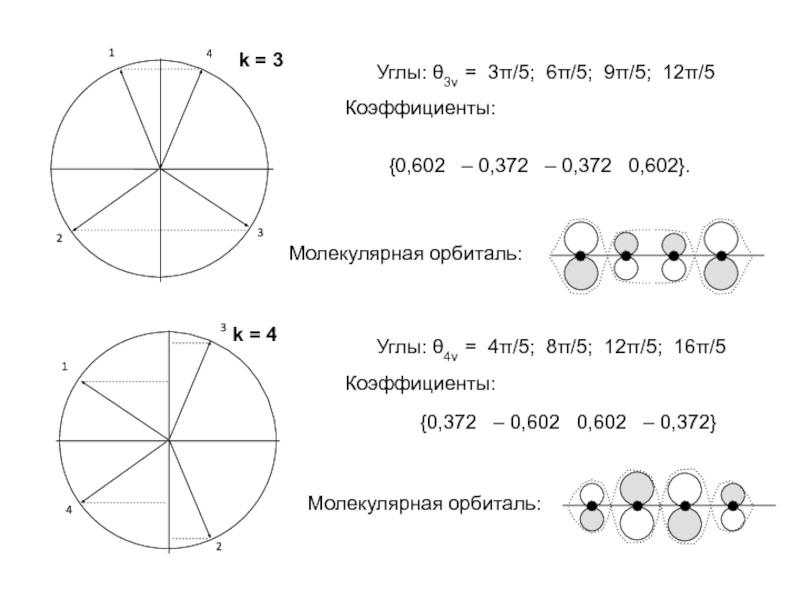
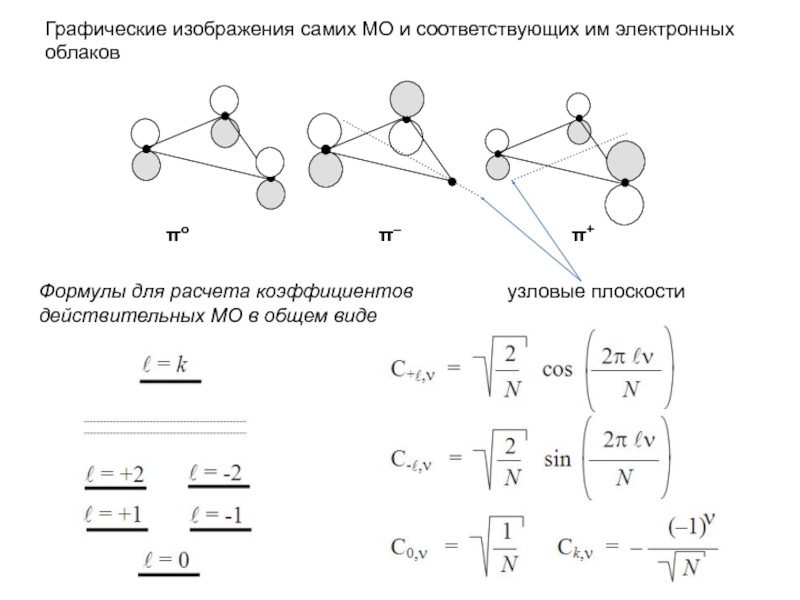
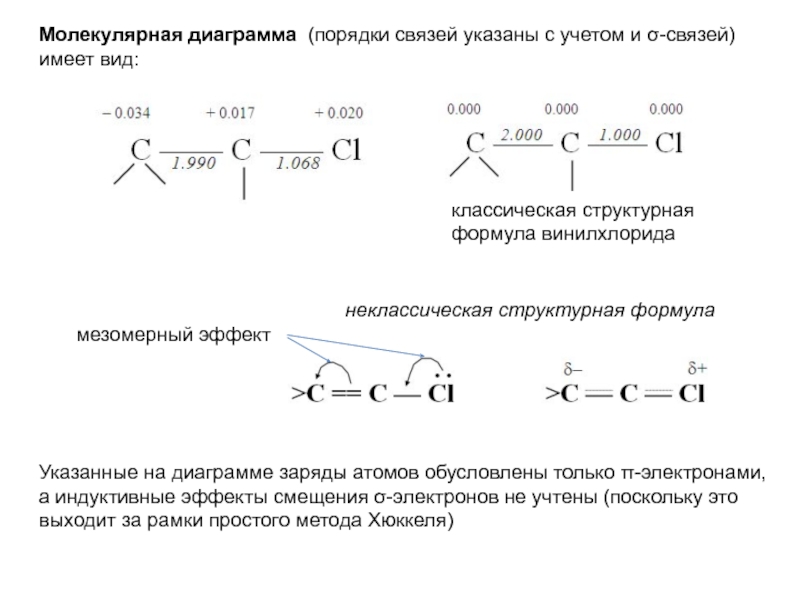
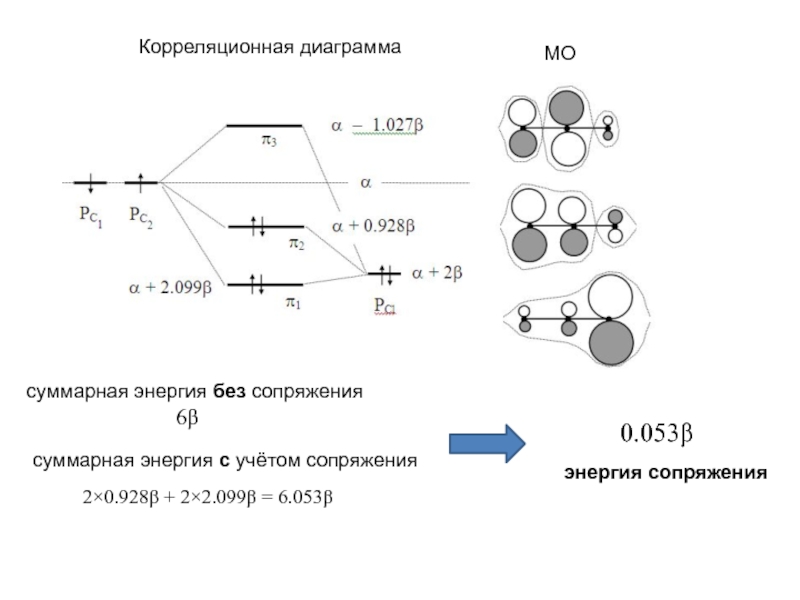
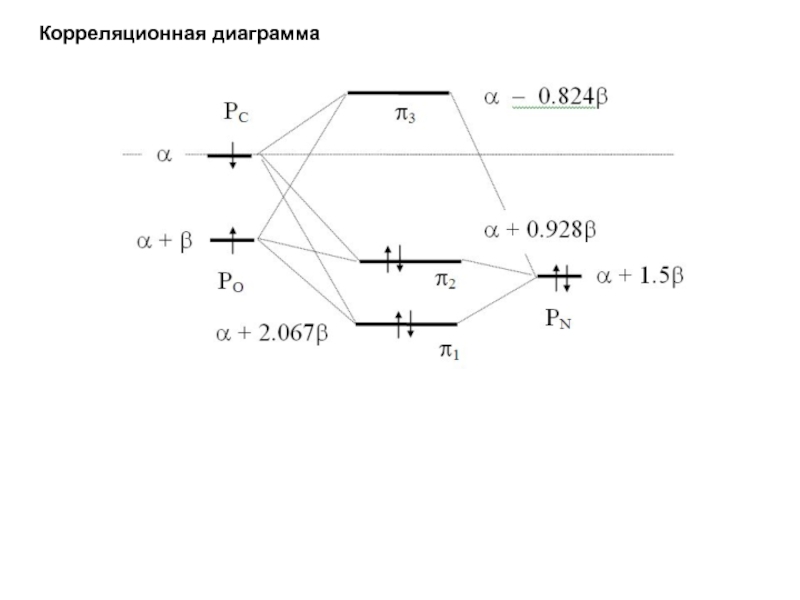
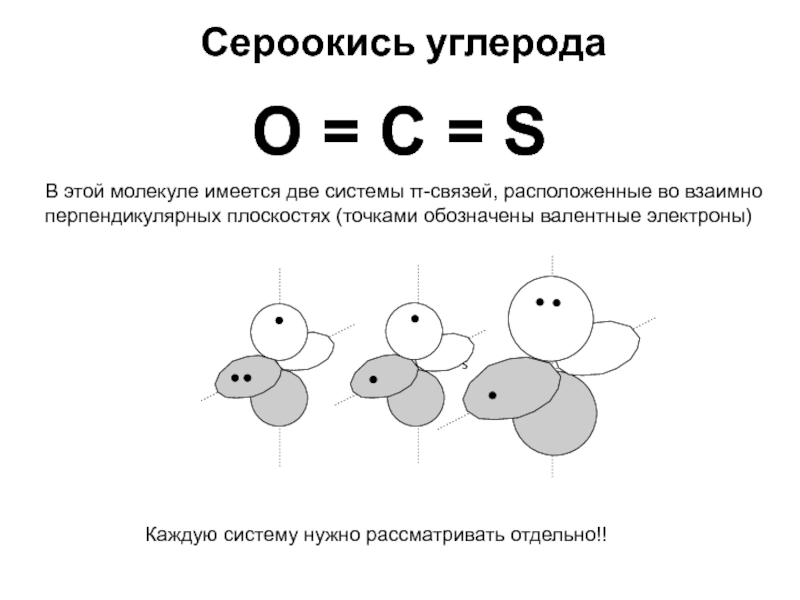
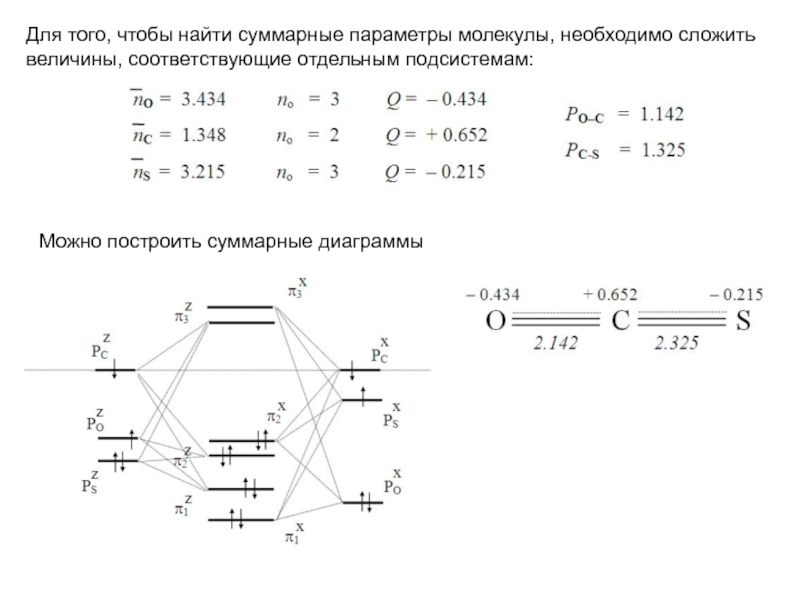
хk
энергетические уровни расположены всегда симметрично, относительно нулевого уровня
( )
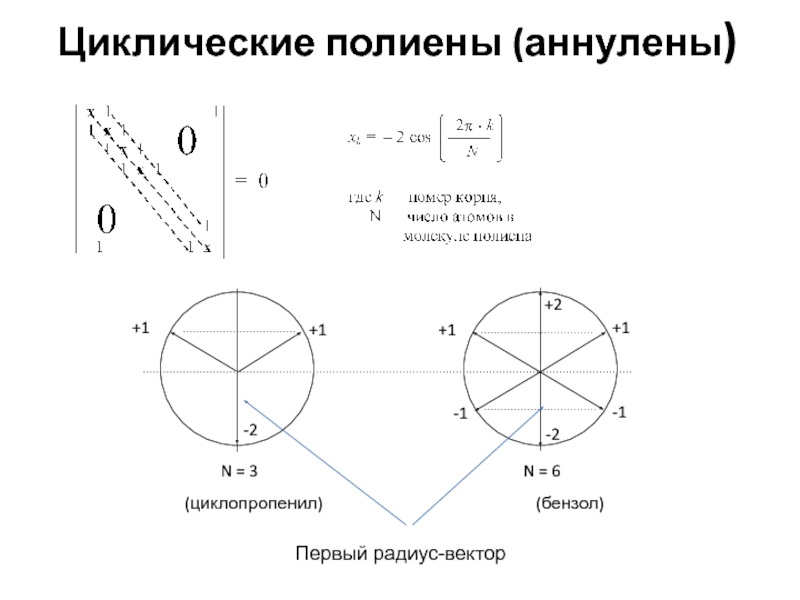
среди них могут быть и нулевые (циклические структуры), тогда в молекуле имеется две вырожденные несвязывающие МО
в нечетных АУ величины х имеют вид 0, хk
среди энергетических уровней обязательно имеется и нулевой ( ), соответствующий несвязывающей МО
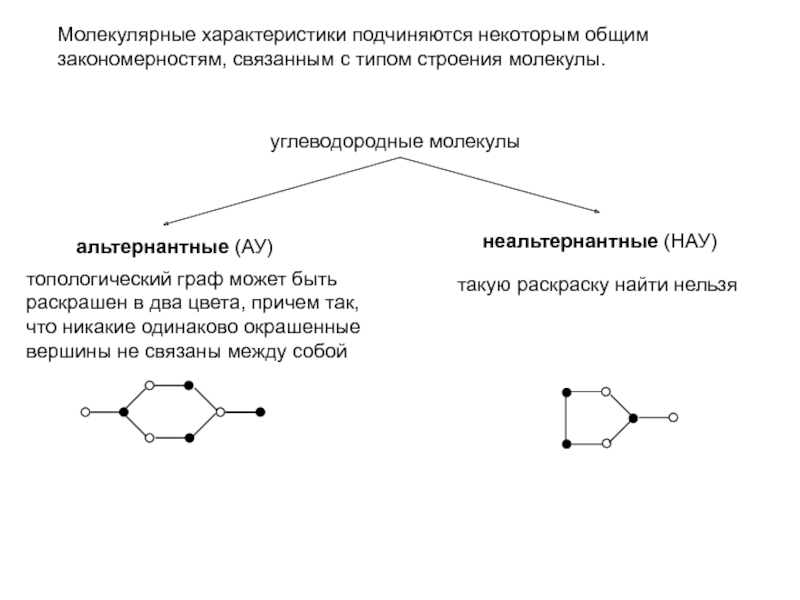
для нециклических НАУ все величины х различны между собой (за исключением случайных совпадений), и все энергетические уровни невырождены;
для циклических НАУ дважды вырожденные уровни располагаются несимметрично, относительно нулевого уровня и среди них нет уровня с (несвязывающей МО)
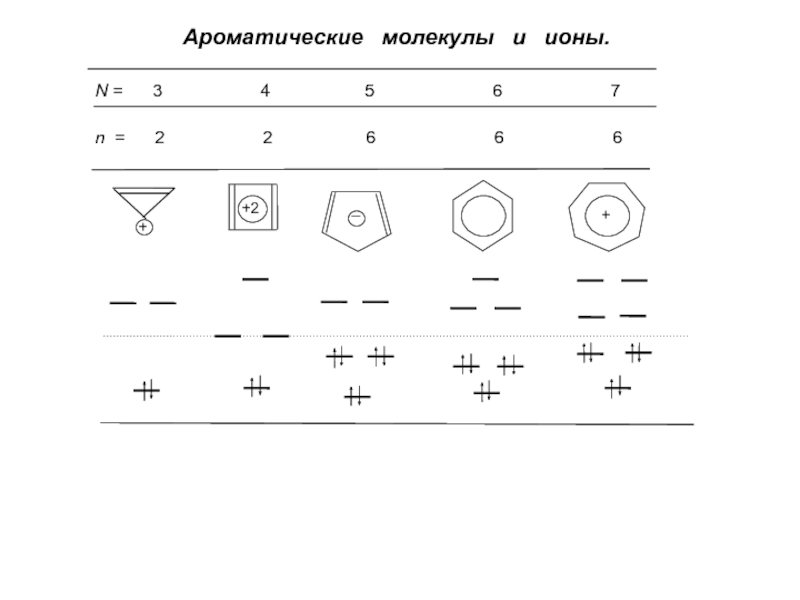
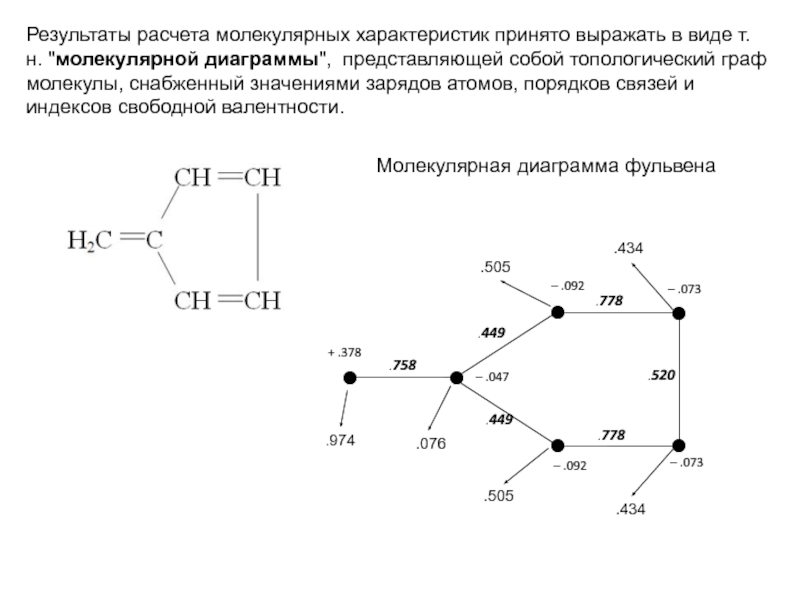
для АУ (как четных, так и нечетных) все атомные электронные плотности равны 1, а электрические заряды атомов равны нулю (за исключением молекулярных ионов)