доля вещества в растворе».
Расчёты массы (объёма, количества вещества) продуктов реакции,
если одно из веществ дано в избытке (имеет примеси).Расчеты массы (объема, количества вещества) продукта реакции, если одно из веществ дано в виде раствора с определенной массовой долей растворенного вещества.
Расчёты массовой или объёмной доли выхода продукта реакции от теоретически возможного.
Расчёты массовой доли (массы) химического соединения в смеси.

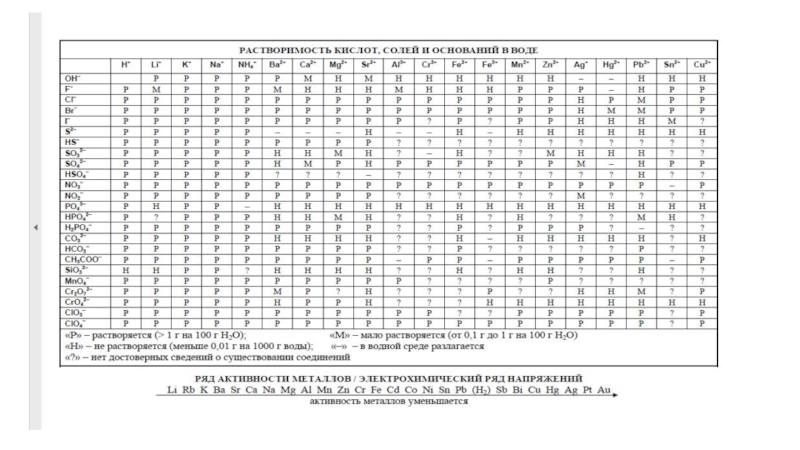
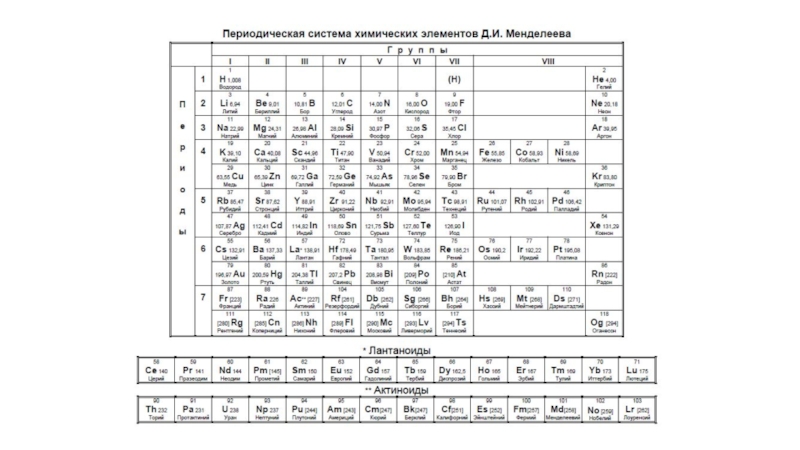








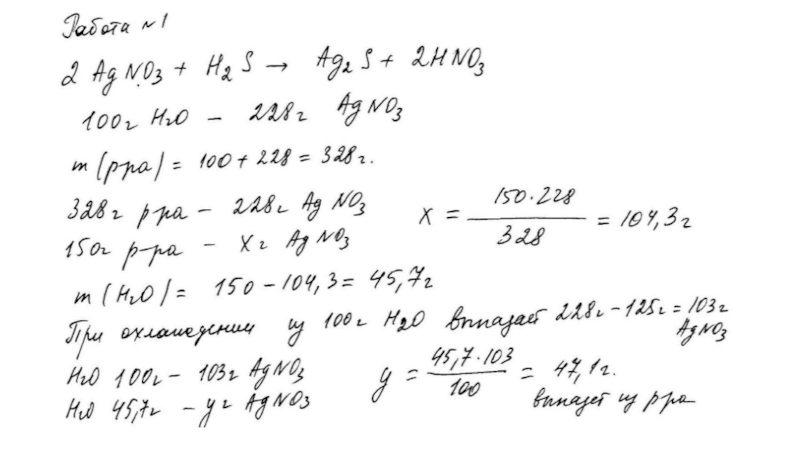

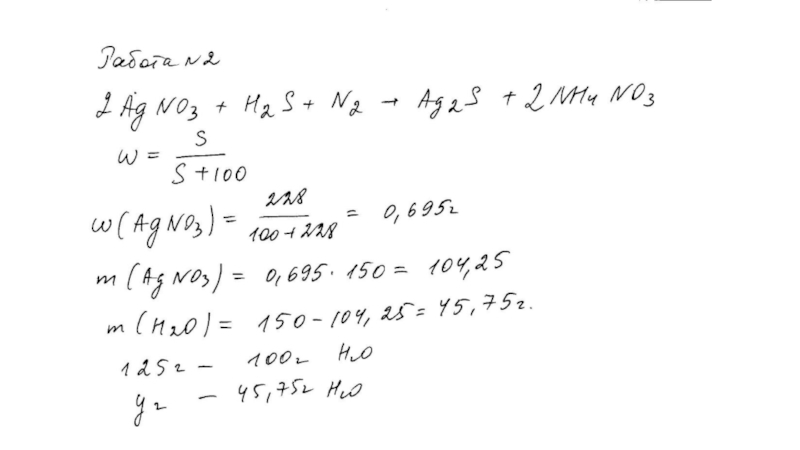
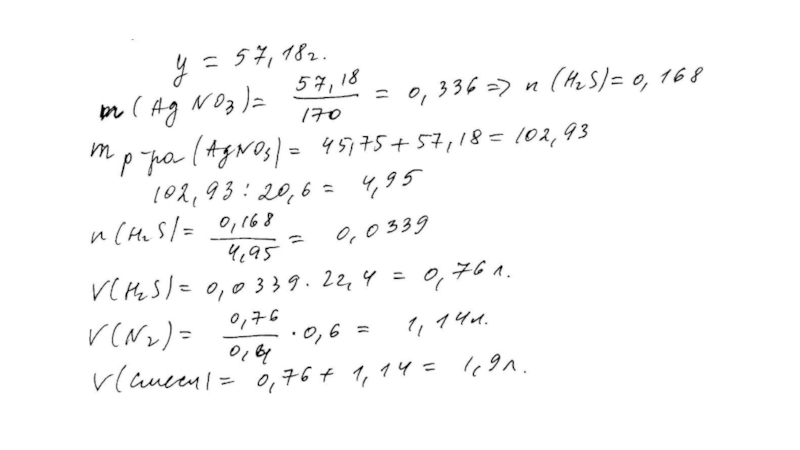






















![Методика проверки и оценки задания 34 СuSO4 + Zn = ZnSO4 + CuCuSO4 +2NaOH = Cu(OH)2 + СuSO4 + Zn = ZnSO4 + CuCuSO4 +2NaOH = Cu(OH)2 + Na2SO4ZnSO4 + 4NaOH = Na2[Zn(OH)4] +](/img/tmb/6/592018/387a43fe184d8c9869a198eb02250dbb-800x.jpg)