раствор
KMnO4хроматометрия - в качестве титранта используется раствор
K2Cr2O7
- йодометрия - в качестве титранта используется раствор J2
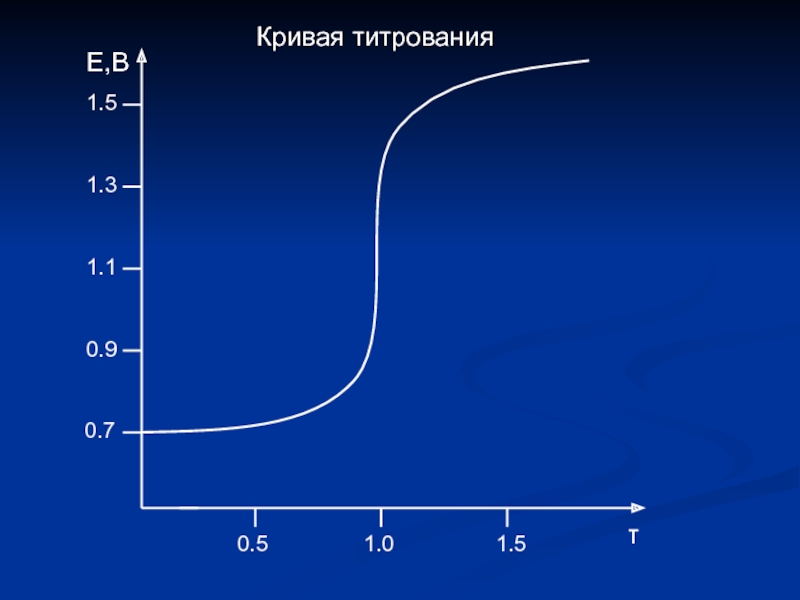
Пример 1. Определение ионов Fe2+ раствором KMnO4.
Fe2+ + MnO4- ↔ Mn2+ + Fe3+
Fe2+ - e- → Fe3+ 5 E0Fe3+/Fe2+ = 0.77 B
MnO4- + 8H+ + 5e- → Mn2+ + 4H2O 1 E0MnO4-/Mn2+ = 1.51 B
5Fe2+ + MnO4- + 8H+ ↔ Mn2+ + 5Fe3+ + 4H2O