Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Методы выявления антигенов и антител
Содержание
- 1. Методы выявления антигенов и антител
- 2. Иммунодиффузия в геле
- 3. Явление иммунопреципитации в гелях широко используется в
- 4. В толще гелей существует водная фаза, через которую
- 5. Методы диффузии в геле1) Качественный - используется
- 6. 1) Двойная диффузия в гелеПринцип метода:Растворы антигенов
- 7. Применение методаВажный первичный тест на преципитирующие свойства,
- 8. Интерпретация результатовI. Важность сбалансированных эквивалентных концентраций -
- 9. Интерпретация результатовIII. Полностью, частично идентичные либо неидентичные антигены.IV. Специфичность антител
- 10. Слайд 10
- 11. Преимущества и недостаткиПреимущества: единственный в своем роде,
- 12. 2) Радиальная иммунодиффузия (РИД)Принцип метода Молекулы в
- 13. ПрименениеI. Определение индивидуальных антигенов в растворе (РИД).
- 14. Количественная оценка результатовI. Измерение колец преципитации на
- 15. II. Калибровочные кривыеДиаметр колец находится в линейной
- 16. II. Калибровочные кривыеМожно построить график зависимости квадратов диаметра
- 17. III. Точность, разрешающая способность и чувствительность.Для уменьшения
- 18. Преимущества и недостаткиПреимущества:Требует минимального оборудования и дает
- 19. Иммуноэлектрофоретические методыМетоды, совмещающие электрофоретическую миграцию антигенов в
- 20. Иммуноэлектрофорез (ИЭФ)Принцип методаВ пластине агарозного геля вырезают
- 21. Иммуноэлектрофорез (ИЭФ)Принцип методаВ пластине агарозного геля вырезают
- 22. Слайд 22
- 23. Слайд 23
- 24. ПрименениеИммуноэлектрофорез в первую очередь представляет собой качественный
- 25. Преимущества и недостатки ИЭФПреимущества:Качественный анализ смесей антигенов,
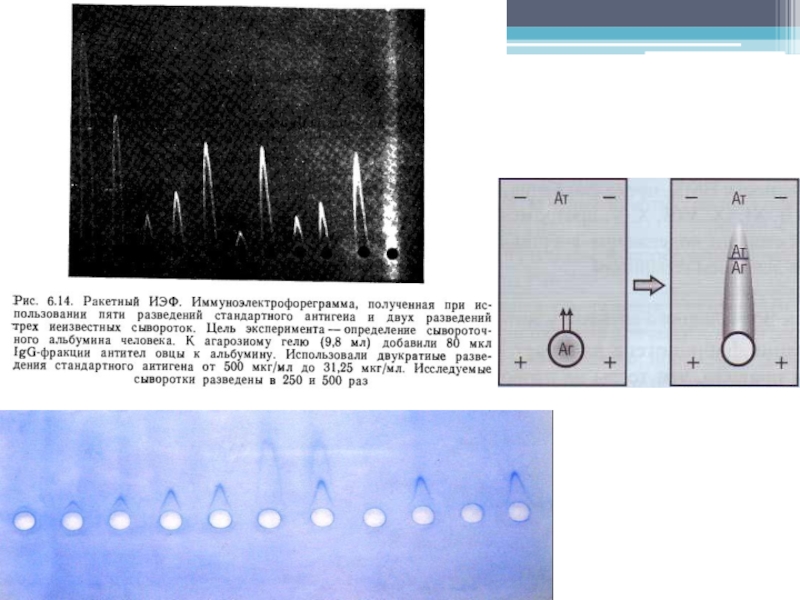
- 26. Ракетный иммуноэлектрофорез Позволяет быстро оценить концентрацию индивидуального
- 27. Воспроизведение метода 1. Подготавливают пластину агарозного геля, содержащего
- 28. Слайд 28
- 29. Интерпретация результатовВо избежание латеральной диффузии антигена электрофорез
- 30. Количественная обработка результатов1. Для быстрого получения результатов
- 31. Преимущества и недостаткиПреимущества:Быстрое получение результатов. Недостатки:Ракетный ИЭФ
- 32. Перекрестный иммуноэлектрофорезПринцип метода Данный метод совмещает
- 33. Воспроизведение метода I. Первое направление. 1. Приготовляют
- 34. II. Второе направление. 1. После застывания пластину
- 35. Двумерный ИЭФ позволяет продемонстрировать свойства сбалансированной полиспецифической антисыворотки к белкам сыворотки человека
- 36. Преимущества и недостатки Преимущества:С помощью одних и
- 37. Встречный иммуноэлектрофорез Принцип метода Антигены, значение pI
- 38. Воспроизведение метода 1. Готовят обычным способом пластины геля,
- 39. Воспроизведение метода 1. Готовят обычным способом пластины геля,
- 40. ИммуноблоттингПеренос молекул на матрицу, способную их иммобилизировать.В
- 41. Основной методДля идентификации антигена в иммуноблоттинге необходимо,
- 42. Слайд 42
- 43. Слайд 43
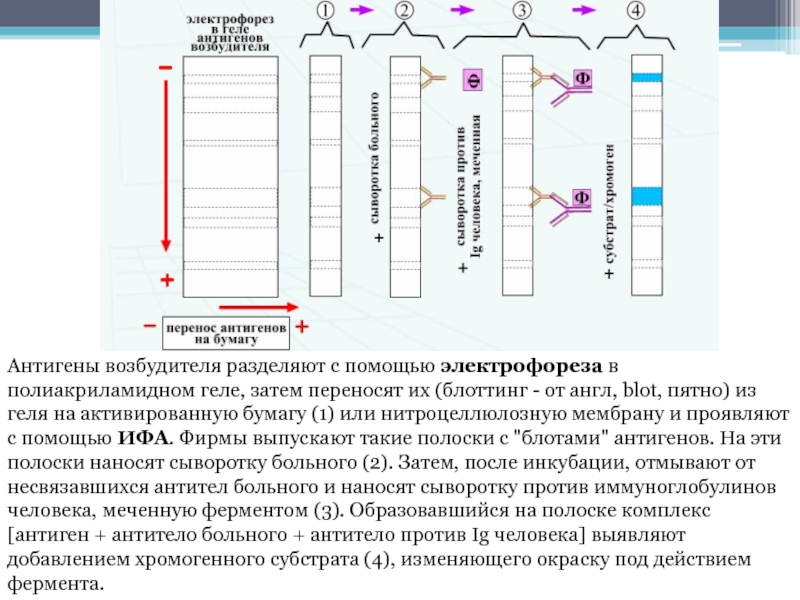
- 44. Антигены возбудителя разделяют с помощью электрофореза в полиакриламидном геле,
- 45. Слайд 45
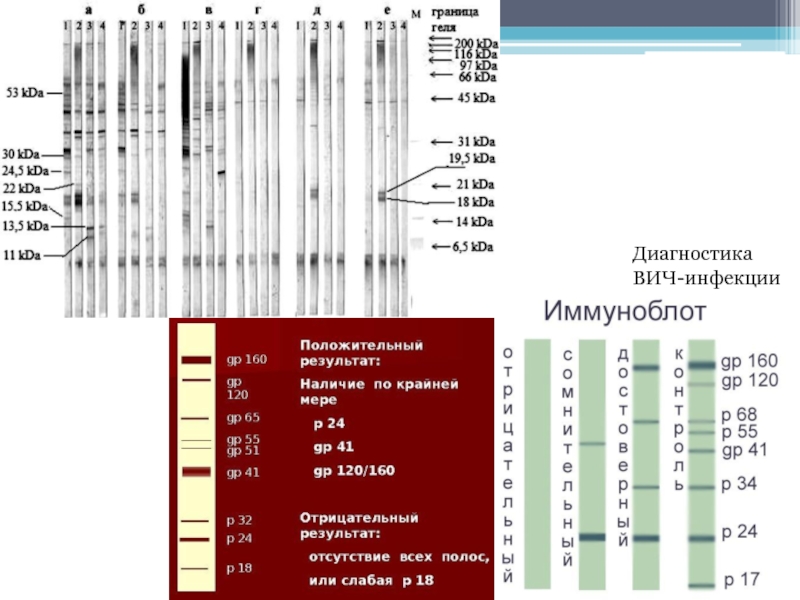
- 46. Диагностика ВИЧ-инфекции
- 47. Спасибо за внимание!
- 48. Скачать презентанцию
Иммунодиффузия в геле
Слайды и текст этой презентации
Слайд 1Методы выявления антигенов и антител
Подготовила:
Мелькова Анастасия
МБФ, 3.4.01
ФГБОУ ВО РНИМУ им.
Н.И. Пирогова Минздрава России
Медико-биологический факультет
Слайд 3Явление иммунопреципитации в гелях широко используется в целом ряде важных методик,
которые широко применяются для изучения антител, а также для обнаружения и
количественного определения растворимых антигенов.Слайд 4В толще гелей существует водная фаза, через которую легко диффундирует большинство макромолекул
. Когда полидетерминантный сложный антиген перемещается в зону, содержащую антитела, то
при оптимальном соотношении концентраций взаимодействующих компонентов образуются видимые линии преципитации. Реакцию обычно проводят в расположенных горизонтально тонких пластинах агарового геля на стеклянных подложках. Для реакций простой и двойной диффузии антигены и антитела вносят в лунки, вырезанные в геле напротив друг друга . Известны различные модификации метода иммунодиффузии:а) иммуноэлектрофорез (комбинация электрофоретического разделения белков по заряду с двойной диффузией и иммунопреципитацией в геле);
б) ракетный и двумерный электрофорез (электрофоретическое разделение антигенов в геле агарозы, содержащем антитела, что ускоряет преципитацию, облегчает идентификацию антигенов и позволяет производить их количественное определение);
в) иммунодиффузия антигена в агаровом геле, содержащем антитела (или наоборот), что приводит к образованию колец преципитации, диаметр которых пропорционален концентрации антигена (антител).
Слайд 5Методы диффузии в геле
1) Качественный - используется для определения специфичности
антигенов и антител;
2) Полуколичественный – позволяет определять как антигены, так
и антитела в моноспецифических системах.Слайд 61) Двойная диффузия в геле
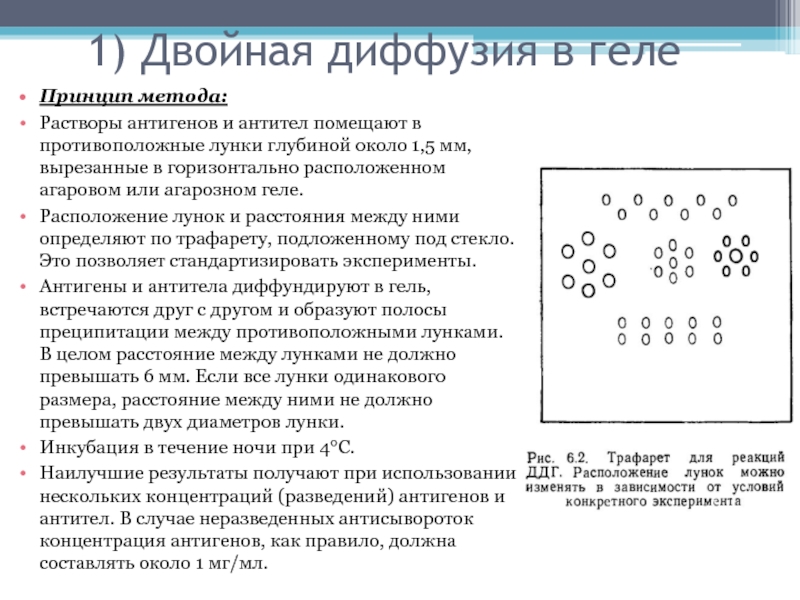
Принцип метода:
Растворы антигенов и антител помещают
в противоположные лунки глубиной около 1,5 мм, вырезанные в горизонтально расположенном
агаровом или агарозном геле.Расположение лунок и расстояния между ними определяют по трафарету, подложенному под стекло. Это позволяет стандартизировать эксперименты.
Антигены и антитела диффундируют в гель, встречаются друг с другом и образуют полосы преципитации между противоположными лунками. В целом расстояние между лунками не должно превышать 6 мм. Если все лунки одинакового размера, расстояние между ними не должно превышать двух диаметров лунки.
Инкубация в течение ночи при 4°С.
Наилучшие результаты получают при использовании нескольких концентраций (разведений) антигенов и антител. В случае неразведенных антисывороток концентрация антигенов, как правило, должна составлять около 1 мг/мл.
Слайд 7Применение метода
Важный первичный тест на преципитирующие свойства, приблизительный титр и специфичность
антисывороток к растворимым антигенам.
Стандартный способ определения специфичности антисывороток.
Тест на
идентичность антигенов, определение чистоты антигена и антигенных взаимосвязей между молекулами. Приблизительное определение концентрации антигена.
Слайд 8Интерпретация результатов
I. Важность сбалансированных эквивалентных концентраций - использование
разных соотношений антиген
: антитело.
II. Множественные системы антиген: антитело и определение чистоты
антигена.
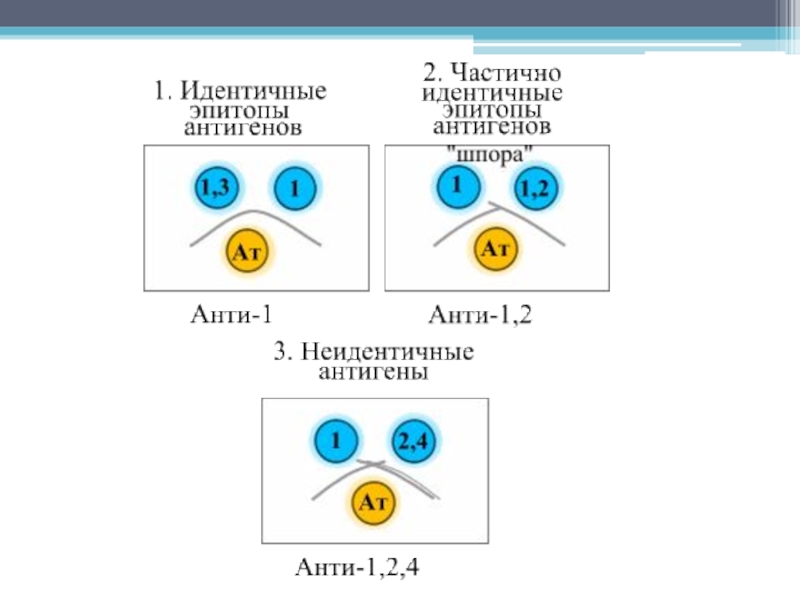
Слайд 9Интерпретация результатов
III. Полностью, частично идентичные либо неидентичные антигены.
IV. Специфичность антител
Слайд 11Преимущества и недостатки
Преимущества: единственный в своем роде, уникальный и простой метод
изучения антигенных взаимосвязей между молекулами и
специфичности антител.
Недостатки:
а) относительно низкая
чувствительность по сравнению с непрямыми методами, например реакциями агглютинации и иммуноферментными тестамиб) при исследовании смесей антигенов методом ДДГ часто наблюдаются перекрывающиеся и накладывающиеся друг на друга линии преципитации.
Слайд 122) Радиальная иммунодиффузия (РИД)
Принцип метода
Молекулы в растворе, помещенные в лунки
агарового геля, радиально диффундируют и образуют иммунные комплексы с комплементарными молекулами антител
или антигенов, содержащихся в жидкой фазе агара.В стандартной РИД агар содержит моноспецифические антитела, а радиально диффундирующий антиген, встречаясь с ними, образует кольцо преципитации.
Реакция протекает в течение нескольких дней, причем время проведения определяется молекулярными размерами антигена. На практике, если молекулы имеют размер IgG или менее, для построения количественной кривой с использованием стандартных разведений антигена достаточно 24-часовой инкубации при 4°С или 16-часовой при комнатной температуре.
Количественная оценка основана на том, что размеры кольца преципитации прямо пропорциональны количеству антигена в лунке (при равных объемах препаратов в лунках).
Аналогичный подход можно использовать для сравнения титра исследуемой антисыворотки с контрольной – обратная реакция радиальной иммунодиффузии (ОРИД), когда антисыворотка из лунок диффундирует в агар, содержащий антиген.
Слайд 13Применение
I. Определение индивидуальных антигенов в растворе (РИД).
Обычно используют для
определения сывороточных белков, в частности иммуноглобулинов при подозрении на множественную миелому
или в случае недостаточности иммуноглобулинов. Можно определять и компоненты комплемента.II. Титрование антисывороток с использованием контрольных реагентов (ОРИД).
Наиболее удобен для количественного определения IgG, полученного путем хронической иммунизации лабораторных животных. Такие антитела должны образовывать с антигеном одно кольцо преципитации. Кроме того, метод можно использовать и для повседневного тестирования сывороток пациентов с целью выявления антител к инфекционным агентам. Правда, в ряде случаев чувствительность метода недостаточна.
Слайд 14Количественная оценка результатов
I. Измерение колец преципитации на влажных и окрашенных
пластинах.
Во многих случаях можно считывать результаты с еще влажных гелей.
Измерение
проводят с помощью окулярного микрометра, прикладываемого к обратной стороне пластины. Пластину рассматривают на темном фоне при косом освещении.Высушенные пластины можно измерять с помощью окулярного микрометра или специальных линеек, которые поставляются некоторыми производителями готовых пластин для РИД.
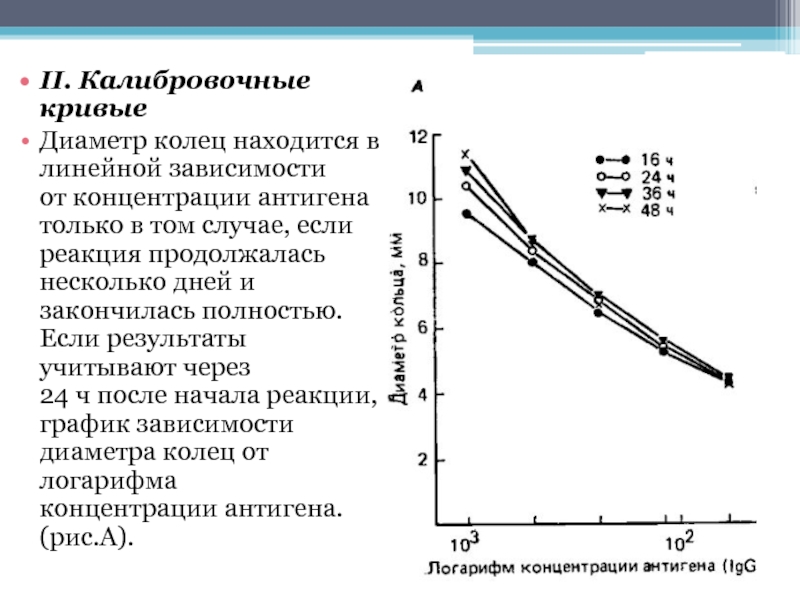
Слайд 15II. Калибровочные кривые
Диаметр колец находится в линейной зависимости
от концентрации антигена
только в том случае, если реакция продолжалась несколько дней и закончилась
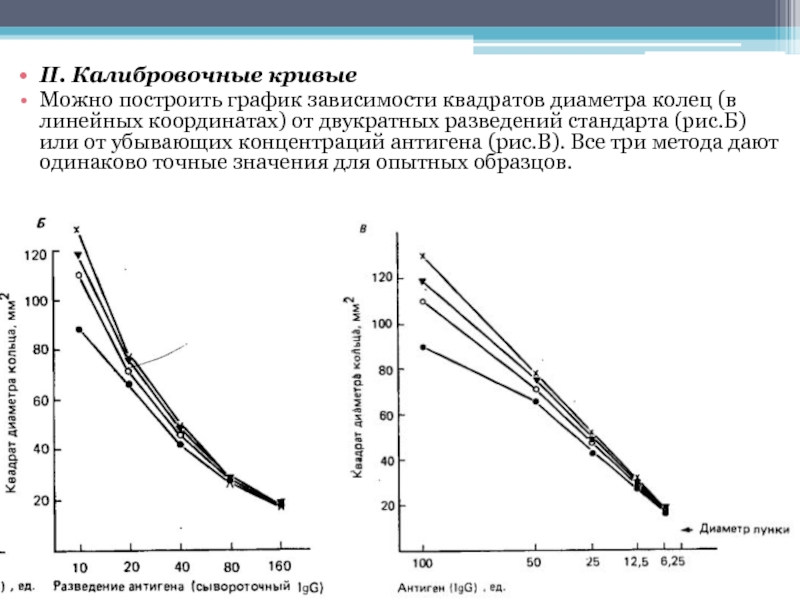
полностью. Если результаты учитывают через 24 ч после начала реакции, строят график зависимости диаметра колец от логарифма концентрации антигена. (рис.А).Слайд 16II. Калибровочные кривые
Можно построить график зависимости квадратов диаметра колец (в линейных
координатах) от двукратных разведений стандарта (рис.Б) или от убывающих концентраций антигена (рис.В).
Все три метода дают одинаково точные значения для опытных образцов.Слайд 17III. Точность, разрешающая способность и чувствительность.
Для уменьшения ошибки и приближения
результатов к реальным значениям, желательно подбирать разведения таким образом, чтобы значения, полученные
для опытных образцов, попадали на середину калибровочной кривой. Из двух разведений образца для определения его концентрации следует выбирать то, которое дало результат, лежащий ближе к центру калибровочной кривой, чем и объясняется необходимость использования двух разведений.Чувствительность метода поднимается двояко. Во-первых, это возможность по данной калибровочной кривой уловить различия в концентрациях образцов. Результат зависит от того, с какой ошибкой найдены точки кривой, а также от ее наклона и линейности. Во-вторых, чувствительность определяется минимальным количеством антигена или антител, которое можно определить данным методом. В РИД этот параметр зависит от размера лунок, случайных ошибок, а также от того, насколько видимыми и четкими получились кольца преципитации при небольших концентрациях образцов.
Слайд 18Преимущества и недостатки
Преимущества:
Требует минимального оборудования и дает легко стандартизируемые результаты как
для антигенов, так и для антител.
Удобный и распространенный метод определения
многих антигенов,
концентрация которых удовлетворяет пределам чувствительности. Как для РИД, так и для ОРИД необходимо иметь моноспецифичеокие преципитирующие антисыворотки, однако стандартные и опытные образцы антигенов не обязательно должны быть очищены.
Методом РИД невозможно определить изменения свойств антигена (структуры, целостности эпитопов, гомогенности), но зато антигенные тесты не подвержены влиянию pI (по сравнению с ракетным и двумерным ИЭФ).
Пластины, на которых поставлена РИД, удобны для хранения
Недостатки:
Главный недостаток РИД - это время, необходимое для получения количественных результатов.
Чувствительность РИД невелика (около 5 мкг/мл)
Слайд 19Иммуноэлектрофоретические методы
Методы, совмещающие электрофоретическую миграцию антигенов в
агарозе с последующей иммунопреципитацией
в геле. В результате первого процесса происходит частичное разделение смеси антигенов,
поскольку скорость их миграции в геле зависит от суммарного заряда при данном pH буферного раствора. Кроме того, отрицательно заряженные молекулы быстро мигрируют в гель, содержащий антитела, что ускоряет преципитацию и сводит к минимуму латеральную диффузию. Известны четыре широко распространенных модификации иммуноэлектрофореза. Они незаменимы для качественного и (или) количественного определения антигенов (как индивидуальных, так и находящихся в смеси) и значительно облегчают определение специфичности антисывороток.Слайд 20Иммуноэлектрофорез (ИЭФ)
Принцип метода
В пластине агарозного геля вырезают лунки и расположенные
между ними канавки (рис. 6.10). В лунки вносят растворы антигенов и
накладывают на агарозу с противоположных сторон фитили, соединяющие ее с электродным буфером в двух резервуарах. После включения тока антигены начинают мигрировать из лунок вдоль геля и разделяются. По окончании электрофореза в канавки, параллельные направлению миграции антигенов, вносят антисыворотки. Антигены и антисыворотки диффундируют в геле навстречу друг другу, и в месте их взаимодействия образуются дуги преципитации (рис. 6.11). Идентичность антигенов можно определить, используя известные антигены и антитела (рис. 6.1.2,А).Принцип интерпретации результатов такой же, как и для методов диффузии в геле.
Слайд 21Иммуноэлектрофорез (ИЭФ)
Принцип метода
В пластине агарозного геля вырезают лунки и расположенные
между ними канавки (рис. 6.10). В лунки вносят растворы антигенов и
накладывают на агарозу с противоположных сторон фитили, соединяющие ее с электродным буфером в двух резервуарах. После включения тока антигены начинают мигрировать из лунок вдоль геля и разделяются. По окончании электрофореза в канавки, параллельные направлению миграции антигенов, вносят антисыворотки. Антигены и антисыворотки диффундируют в геле навстречу друг другу, и в месте их взаимодействия образуются дуги преципитации (рис. 6.11). Идентичность антигенов можно определить, используя известные антигены и антитела (рис. 6.1.2,А).Принцип интерпретации результатов такой же, как и для методов диффузии в геле.
Слайд 24Применение
Иммуноэлектрофорез в первую очередь представляет собой качественный метод исследования антигенов и
специфичности антител.
I. Антигены.
Метод применяется для:
1) определения антигенного состава смеси
- это, в частности, важно при очистке антигенов, поскольку позволяет определить природу примесей2) для анализа гетерогенности и гомогенности индивидуальных антигенов. Он является стандартным методом иммунохимического анализа широкого спектра белков. Метод широко применяется при исследовании антигенов инфекционных агентов, белков плазмы и других физиологических жидкостей человека и животных. Он эффективно используется для первичного скрининга при исследовании недостаточности иммуноглобулинов и комплемента.
II. Антитела.
Обычный тест на определение специфичности антисывороток. В качестве контроля эффективны антисыворотки против суммарного пула сывороточных белков.
Слайд 25Преимущества и недостатки ИЭФ
Преимущества:
Качественный анализ смесей антигенов, например, сывороток. С
помощью данного метода можно идентифицировать до 20 компонентов смеси.
Удается исследовать
и аномалии индивидуальных белков, поскольку на стадии разделения обнаруживаются нарушения электрофоретической подвижности (например, гомогенность pI миеломных белков), существенные отклонения от нормальной концентрации (определяемые по интенсивности дуг преципитации) и изменения субъединичного состава (например, искажение соотношения легких цепей каппа и
лямбда у миеломных белков). Такие тонкие изменения трудно обнаружить с помощью простой диффузии в геле. Осторожно подбирая агарный/агарозный носитель, состав буфера и его pH, можно исследовать молекулы с самыми различными зарядами.
Недостатки:
Ограничен определением только таких молекул, концентрация которых в растворе не менее или равна 5 мкг/мл, а размеры не препятствуют образованию преципитатов.
Слайд 26Ракетный иммуноэлектрофорез
Позволяет быстро оценить концентрацию индивидуального антигена в реакции с моноспецифической
антисывороткой.
Принцип метода
Индивидуальные антигены электрофоретически мигрируют из лунок,
расположенных у основания геля,
в агарозу, содержащую специфические
антитела. С помощью специальных условий обеспечивается миграция антигена к аноду и неподвижность антител (IgG). По мере связывания антител
мигрирующим антигеном образуются заостренные дуги преципитации (ракеты). Высота ракет пропорциональна концентрации антигена. Если на пластину нанесено несколько разведений стандартного антигена, то концентрации неизвестных (опытных) образцов легко определить, сравнивая их со стандартной кривой.
Применение теста ограничено антигенами, мигрирующими при pH 8,6 к аноду, но, с другой стороны, это очень быстрый метод (1-2 ч) количественного определения таких антигенов.
Слайд 27Воспроизведение метода
1. Подготавливают пластину агарозного геля, содержащего антитела, как для осуществления
РИД .
2. Когда гель застынет (предпочтительнее оставить на ночь
при 4°С, для того чтобы антитела равномерно распределились в геле), помещают пластину на трафарет (рис. 6.13) и вырезают перфоратором ряд из 11 лунок объемом 5 мкл. 3. Готовят несколько разведений стандартного антигена - для большей точности рекомендуется использовать серию из пяти разведений: от 1 мг/мл до 10 мкг/мл. Подготавливают три опытных образца (на одну пластину), в двух разведениях, отличающихся друг от друга в 8 раз. Выбирают случайным образом лунки для стандартных и опытных образцов и вносят в них по 5 мкл каждого образца.
4. Немедленно начинают электрофорез. Верхний край пластины должен быть присоединен к аноду. При напряжении 80-100 В (10-12 В/см) электрофорез должен закончиться через 1-2 ч. Время окончания определяют по ракете наибольшей концентрации стандартного антигена. Когда ее пик заострится, ток выключают.
Слайд 29Интерпретация результатов
Во избежание латеральной диффузии антигена электрофорез начинают немедленно после нанесения
образцов. При большой скорости разделения ширина ракет не превышает диаметра лунок,
что увеличивает точность определения. Концентрации стандартов выбирают таким образом, чтобы образовавшиеся ракеты не выходили за пределы пластины и ракета стандарта наибольшей концентрации занимала всю длину геля.Двойные или множественные ракеты указывают на то, что антисыворотка не моноспецифична
Слайд 30Количественная обработка результатов
1. Для быстрого получения результатов можно измерить высоту
ракет, положив гель на стекло с подсветкой. Ракеты измеряют от вершины
до верхнего края лунки. Если имеется достаточно времени, гель промывают 2-3 дня в 0,85%-ном растворе NaCl, затем в дистиллированной воде, высушивают и окрашивают, а затем проводят измерение.2. Для определения количества антигена в неизвестных образцах строят калибровочную,кривую, откладывая значения высоты пиков от концентраций стандартного антигена. Неизвестные концентрации определяют с помощью данной кривой.
Слайд 31Преимущества и недостатки
Преимущества:
Быстрое получение результатов.
Недостатки:
Ракетный ИЭФ применим только к
тем молекулам, которые обладают средним или сильным отрицательным зарядом при pH
8,6, что исключает возможность определения иммуноглобулинов, для которых нужно подбирать специальные электролиты и агар.Отрицательный заряд исследуемых иммуноглобулинов можно увеличить карбамилированием как опытных, так и стандартных сывороток. Это достигается следующим образом: 1. Добавляют к двум объемам 2М KCNO один объем сыворотки. 2. Инкубируют при комнатной температуре 6-18 ч.
На практике удобнее определять иммуноглобулины и комплемент с помощью РИД.
Слайд 32Перекрестный иммуноэлектрофорез
Принцип метода
Данный метод совмещает в себе электрофоретическое разделение
антигенов в одном направлении на первой стадии и принцип ракетного ИЭФ
в другом направлении (под углом 90°) на второй стадии. Разделенные антигены мигрируют в агарозу с полиспецифическими антителами и образуют узор из ракет.Области применения
Метод имеет большое аналитическое значение для исследования состава антигенов и, кроме того, обладает некоторыми чертами количественных подходов.
Он очень полезен для тестирования чистоты антигенов, мигрирующих к аноду, а также специфичности антисывороток.
Таким образом, данный метод можно использовать для очистки комплексов антиген - антитело и пики использовать для иммунизации.
Сравнивая антигенные пики на пластинах с известными стандартами, можно производить количественную оценку смесей антигенов. Это позволяет, в частности, определить изменения состава сыворотки при заболевании.
Метод можно использовать и для проверки специфичности антисывороток, внесенных в гель для осуществления второго этапа.
Слайд 33Воспроизведение метода I. Первое направление. 1. Приготовляют агарозный гель на барбиталовом буфере,
как в случае ИЭФ и ДДГ
2. С помощью трафарета разрезают
гель на полоски шириной 1 или 1,5 см и в указанных местах вырезают лунки. 3. Вносят в лунки антигены и проводят электрофорез. Когда бром-феноловый синий окажется на расстоянии 1 см от анодного края пластины, выключают ток.
4. Немедленно переносят полоску с разделенными антигенами на другую, стеклянную пластину. Пластина должна быть теплой. Полоску геля укладывают на край пластины, а на остальную поверхность наносят 8,5 мл заранее подготовленной смеси агарозы с антителами при 56 °С. Новый гель должен плотно соединиться с пластиной первого. Эту стадию следует выполнять как можно быстрее, чтобы свести к минимуму диффузию зон разделенных антигенов в переносимой полоске геля.
Слайд 34II. Второе направление. 1. После застывания пластину геля переносят на охлаждаемую
поверхность камеры для электрофореза, так чтобы пластина первого геля была соединена с
катодным фитилем (т.е. второй электрофорез проводят под углом 90° к первому). Второй этап электрофореза рекомендуется проводить при напряжении 20 В (2,5 В/см) в течение ночи (16 ч). Если разделяемые антигены предполагается использовать для иммунизации, электрофорез должен продолжаться 24-48 ч.2. Тщательно промывают гели в 0,85%-ном растворе NaCl и дистиллированной воде, высушивают под прессом и окрашивают. Для подготовки антигенов к иммунизации отмытый гель помещают на подсветку, вырезают нужный пик преципитации и вымачивают его в 0,85%-ном растворе NaCl - 1-2 нед.
Слайд 35Двумерный ИЭФ позволяет продемонстрировать свойства сбалансированной полиспецифической антисыворотки к белкам
сыворотки человека
Слайд 36Преимущества и недостатки
Преимущества:
С помощью одних и тех же антисывороток
перекрестный ИЭФ позволяет выявить большее число антигенов, чем простой ИЭФ.
Возможность
очистки антигенов. Наибольшая ценность перекрестного ИЭФ заключается в том, что он позволяет определять специфичность антител в неденатурирующих антигены условиях.
Недостатки:
В то же время электрофорез в полиакриламидном геле в присутствии ДСН с последующим Вестерн-блоттингом и иммунохимическим окрашиванием хотя и обладает очень высокой чувствительностью, однако позволяет обнаружить только те антигенные эпитопы, которые не изменяются после денатурации.
Слайд 37Встречный иммуноэлектрофорез
Принцип метода
Антигены, значение pI которых при pH 8,6
больше, чем у антител, находясь в геле, обладающем высокими электроэндосмотическими свойствами,
способны достаточно быстро мигрировать к аноду навстречу антителам, которые перемещаются из противоположной лунки к катоду.Использование этого явления позволяет быстро получить линии преципитации между лунками с антигенами и антителами при условии, что они внесены в соответствующих пропорциях.
Применение:
Встречный ИЭФ - очень чувствительный и быстрый метод определения как антигенов, так и антител.
Он широко применяется для выявления:
инфекционных антигенов в физиологических жидкостях (например, антигенов вируса гепатита В)
изменений концентрации сывороточных белков (например, а-фетопротеина)
для тестирования антител к целому ряду антигенов, мигрирующих к аноду.
Чувствительность метода достигает 400 нг/мл.
Слайд 38Воспроизведение метода
1. Готовят обычным способом пластины геля, выбрав соответствующую марку агара.
2.
Вырезают в геле лунки, используя трафарет (рис. 6.16). Обычно вырезают два
ряда лунок диаметром 2 мм, находящихся на расстоянии 6 мм друг от друга. В ряд лунок, расположенных ближе к катодному краю пластины, вносят антигены (контрольные или исследуемые). В другой ряд лунок вносят по 5 мкл антител (исследуемые сыворотки или контрольные антитела).Подключают ток, так чтобы антигены мигрировали к аноду. Чтобы создать оптимальные условия для преципитации хотя бы в одной паре лунок, следует использовать разные разведения антигенов и антител.
3. Проводят электрофорез при стабилизированном токе, равном 1,5 мА/см. Результаты должны быть видны через 30 мин.
4. Чтобы повысить чувствительность определения, можно отмыть, высушить и окрасить
Слайд 39Воспроизведение метода
1. Готовят обычным способом пластины геля, выбрав соответствующую марку агара.
2.
Вырезают в геле лунки, используя трафарет (рис. 6.16). Обычно вырезают два
ряда лунок диаметром 2 мм, находящихся на расстоянии 6 мм друг от друга. В ряд лунок, расположенных ближе к катодному краю пластины, вносят антигены (контрольные или исследуемые). В другой ряд лунок вносят по 5 мкл антител (исследуемые сыворотки или контрольные антитела).Подключают ток, так чтобы антигены мигрировали к аноду. Чтобы создать оптимальные условия для преципитации хотя бы в одной паре лунок, следует использовать разные разведения антигенов и антител.
3. Проводят электрофорез при стабилизированном токе, равном 1,5 мА/см. Результаты должны быть видны через 30 мин.
4. Чтобы повысить чувствительность определения, можно отмыть, высушить и окрасить
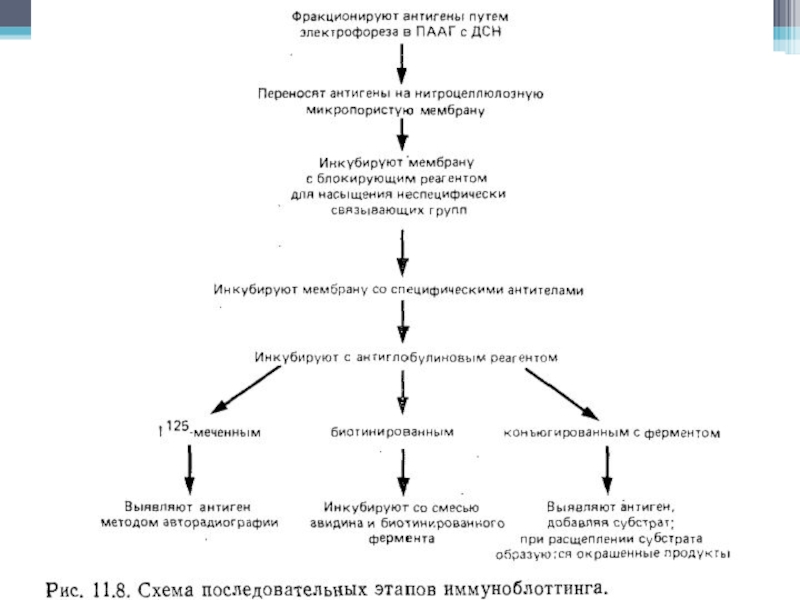
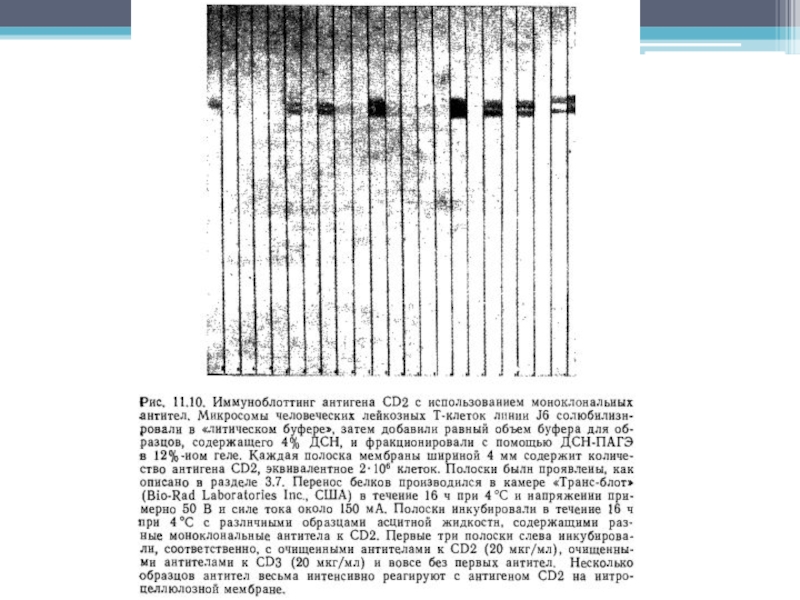
Слайд 40Иммуноблоттинг
Перенос молекул на матрицу, способную их иммобилизировать.
В основе лежит тот
же самый принцип идентификации выделенного из клеточного лизата антигена с
помощью специфических антител, на котором базируется иммунопреципитация. Когда иммуноблотинг следует за электрофорезом в полиакриламидном геле, содержащем додецилсульфат натрия (ДСН-ПАГЭ), анализируемые антиген уже денатурирован ДСН, следовательно антитела могут выявить лишь его эпитопы, которые не разрушились под действием ДСН.Метод позволяет:
выявить те эпитопы, которые не доступны антителам на нативной молекуле антигена, но нередко экспонируются после воздействия ДСН.
идентифицировать антигены, строго специфически связавшие антитела, тогда как в иммунопреципитацию как правило вовлекаются посторонние молекулы, ассоциированные с антигеном, и часто бывает трудно решить, принадлежит ли данный эпитоп самому антигену или этим копреципитированным молекулам.
Слайд 41Основной метод
Для идентификации антигена в иммуноблоттинге необходимо, чтобы произошла иммобилизация
антигена на мембране и последующее выявление его с помощью специфических
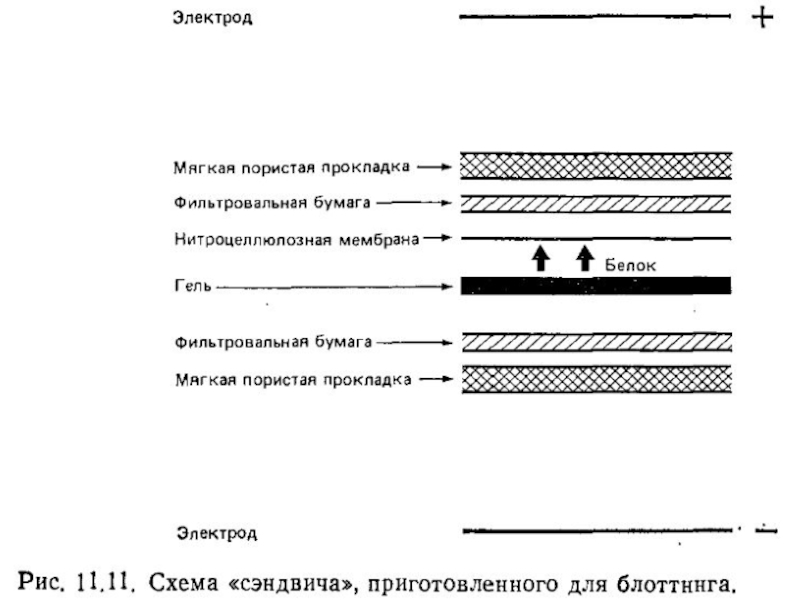
антител.Неочищенные препараты, например, нефракционированный клеточный лизат, можно разделить в ДСН-ПАГЭ, и затем перенести его отрицательно заряженные молекулы на нитрозоцеллюлозную мембрану с помощью электрического поля в направлении от катода к аноду.
После переноса мембрану обрабатывают специфическими антителами, места связывания которых затем выявляют антиглобулиновыми антителами, конъюгированными с радиоактивной или ферментной меткой.