Слайд 2Энергетические изменения при химических реакциях
Слайд 3Скорость любой химической реакции определяется энергетическим барьером, который необходимо преодолеть
реагирующим молекулам. По Аррениусу, химическая реакция с точки зрения энергетики
процесса описывается уравнением:
где N — число активированных молекул; No — общее число реагирующих молекул, е — основание натуральных логарифмов; Eакт — дополнительное количество энергии, необходимое молекулам веществ для преодоления энергетического барьера реакции и вступления в нее; R — газовая постоянная; T — абсолютная температура.
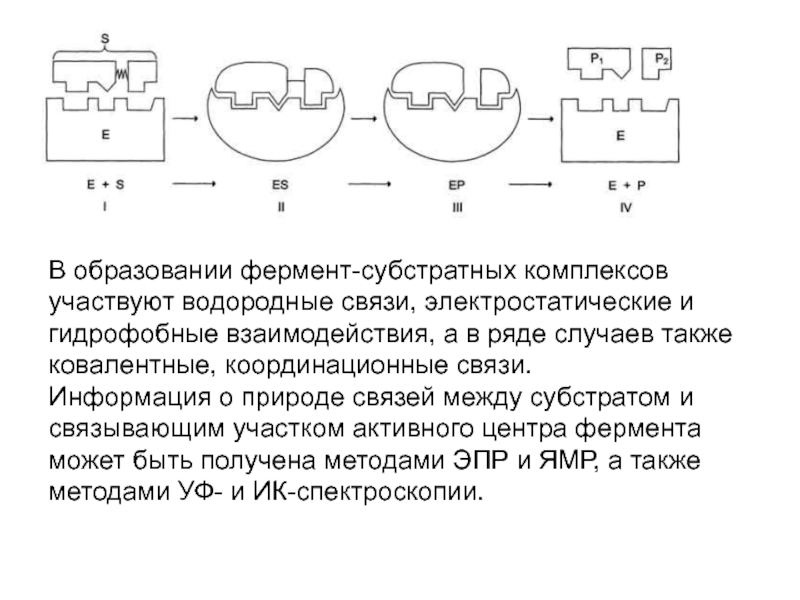
Слайд 5В образовании фермент-субстратных комплексов участвуют водородные связи, электростатические и гидрофобные
взаимодействия, а в ряде случаев также ковалентные, координационные связи.
Информация
о природе связей между субстратом и связывающим участком активного центра фермента может быть получена методами ЭПР и ЯМР, а также методами УФ- и ИК-спектроскопии.
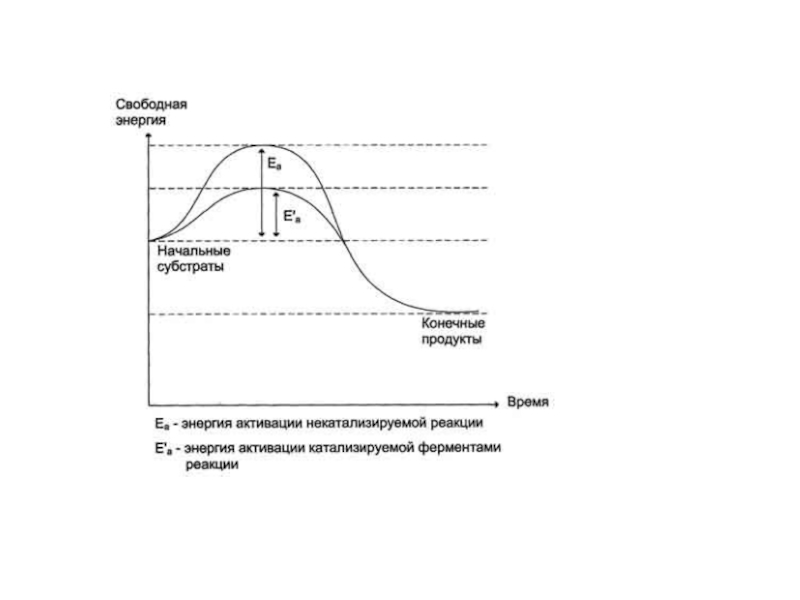
Слайд 6Как катализируемая ферментом, так и не катализируемая им реакция независимо
от ее пути имеет одинаковую величину стандартного изменения свободной энергии
(ΔG). Действуя на скорость реакции, ферменты не изменяют равновесия между прямой и обратной реакциями, как и не влияют на величину свободной энергии реакции; они лишь ускоряют наступление равновесия химической реакции.
ΔG = = –R•T•lnK,
где R – газовая постоянная; Т – абсолютная температура в Кельвинах; lnК – натуральный логарифм константы равновесия; ΔG – стандартное изменение свободной энергии, Дж/моль.
Слайд 7В 1894 г. немецкий химик Эмиль Герман Фишер «теория замка
и ключа».
Между ферментом и субстратам существует соответствие молекулярных конфигураций,
подобное сходству конфигураций замка и ключа.
Эта яркая и наглядная картинка хорошо объясняет специфичность действия ферментов: в самом деле, к замку подходит только определённый ключ. Что считать «замком», а что «ключом» — неважно. Субстрат, связанный с ферментом, называют промежуточным фермент-субстратным комплексом.
Слайд 8Схема, предложенная Фишером, живёт уже более ста лет и не
стареет. Но, к сожалению, она объясняет не всё.
Почему комплекс
субстрата с ферментом распадается, ведь тогда соответствие конфигураций неизбежно нарушается.
Чтобы истолковать это, были предложены разные уточнения модели Фишера.
Слайд 9В 1925 г. шведский биохимик Ханс Карл Август Симон фон
Эйлер выдвинул теорию деформации субстрата, названную «теорией дыбы».
Эйлер предположил,
что соответствие конфигураций между ферментом и субстратом неполное: для того чтобы присоединиться к ферменту, субстрат должен «растянуться».
Другими словами, «ключ» не железный, а скорее резиновый — он способен подстраиваться под «замок». При растягивании молекулы субстрата связь ослабевает, и облегчается её разрыв. Этой схеме отвечают реакции, происходящие с разрывом связей (например, отщепление остатка фосфорной кислоты от аденозинтрифосфата).
Однако остаётся непонятным, как работают ферменты, не рвущие, а образующие новые связи, допустим при удвоении ДНК.
Слайд 10Для того чтобы связь возникла, субстраты прежде всего должны оказаться
рядом, причём в заданном положении друг относительно друга. Здесь работает
механизм «ключа и замка», вот только для одного «замка»-фермента одновременно требуется два «ключика»-субстрата.
Дальше происходит нечто прямо противоположное «теории дыбы». Связанные с ферментом, субстраты изменяют его пространственную структуру.
Под влиянием нового распределения зарядов и геометрических факторов гибкая белковая молекула фермента деформируется, ещё больше сближая реагенты, тем временем начинается каталитическая реакция. На самом деле абсолютно жестких молекул не бывает: свою форму меняют и фермент, и субстраты. При этом создается удобная для катализа конформация промежуточного фермент-субстратного комплекса, т.е. определенное взаимное расположение частей молекул, составляющих этот комплекс – теория индуцированного соотвествия
Слайд 11Молекулярные механизмы ферментативного катализа
Слайд 12Механизмы ферментативного катализа определяются ролью функциональных групп активного центра фермента
в химической реакции превращения субстрата в продукт.
Выделяют 2 основных
механизма ферментативного катализа:
кислотно-основной катализ
ковалентный катализ.
Слайд 131. Кислотно-основной катализ
Концепция кислотно-основного катализа объясняет ферментативную активность участием в
химической реакции кислотных групп (доноры протонов) и/или основных групп (акцепторы
протонов).
Кислотно-основной катализ - часто встречающееся явление.
Аминокислотные остатки, входящие в состав активного центра, имеют функциональные группы, проявляющие свойства как кислот, так и оснований.
Слайд 14К аминокислотам, участвующим в кислотно-основном катализе, в первую очередь относят
цистеин,
тирозин,
серин,
лизин,
глутаминовая кислота,
аспарагиновая кислота,
гистидин.
Радикалы этих аминокислот
в протонированной форме - кислоты (доноры протона), в депротонированной - основания (акцепторы протона).
Благодаря этому свойству функциональных групп активного центра ферменты становятся уникальными биологическими катализаторами, в отличие от небиологических катализаторов, способных проявлять либо кислотные, либо основные свойства.
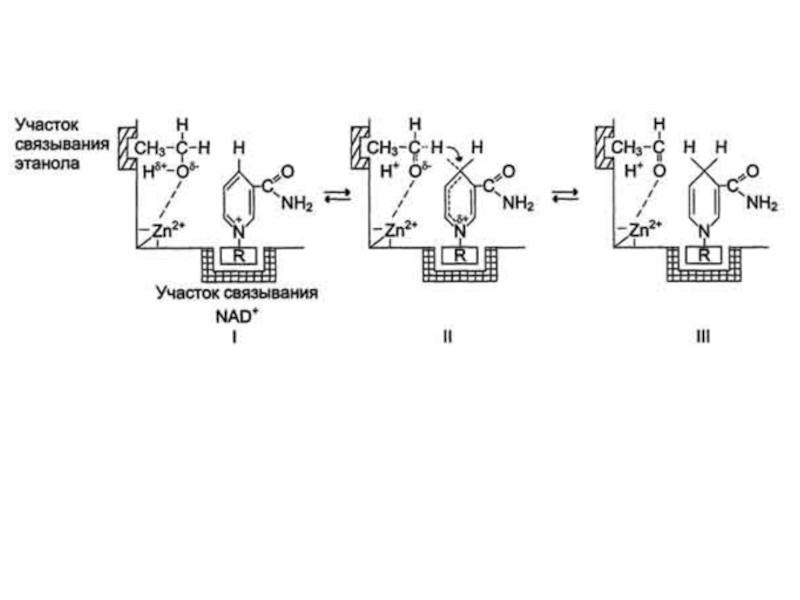
Слайд 15Примером кислотно-основного катализа, в котором кофакторами являются ионы Zn2+, а
в качестве кофермента используется молекула NAD+, можно привести фермент алкогольдегидрогеназу
печени, катализирующую реакцию окисления спирта:
С2Н5ОН + NAD+ → СН3-СОН + NADH + H+
Слайд 172. Ковалентный катализ
Ковалентный катализ основан на атаке нуклеофильных (отрицательно заряженных)
или электрофильных (положительно заряженных) групп активного центра фермента молекулами субстрата
с формированием ковалентной связи между субстратом и коферментом или функциональной группой аминокислотного остатка (как правило, одной) активного центра фермента.
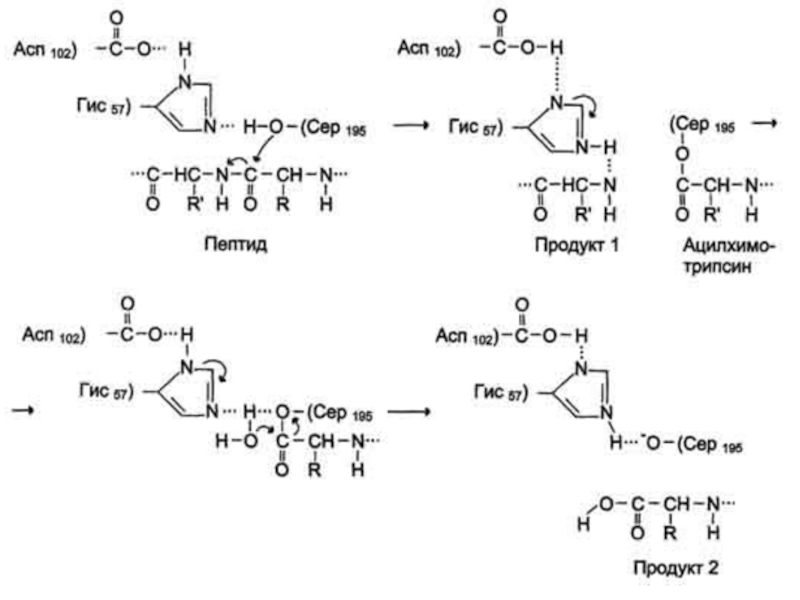
Слайд 18Действие сериновых протеаз, таких как трипсин, химотрипсин и тромбин, -
пример механизма ковалентного катализа, когда ковалентная связь образуется между субстратом
и аминокислотным остатком серина активного центра фермента.
Термин "сериновые протеазы" связан с тем, что аминокислотный остаток серина входит в состав активного центра всех этих ферментов и участвует непосредственно в катализе.
Слайд 19Рассмотрим механизм ковалентного катализа на примере химотрипсина, осуществляющего гидролиз пептидных
связей при переваривании белков в двенадцатиперстной кишке.
Субстратами химотрипсина служат
пептиды, содержащие аминокислоты с ароматическими и циклическими гидрофобными радикалами (Фенилаланин, Тирозин, Триптофан), что указывает на участие гидрофобных сил в формировании фермент-субстратного комплекса.