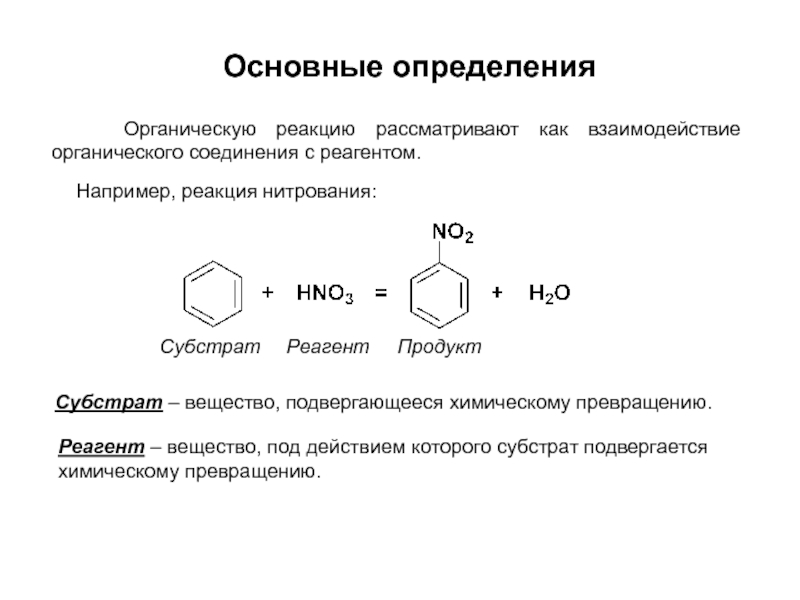
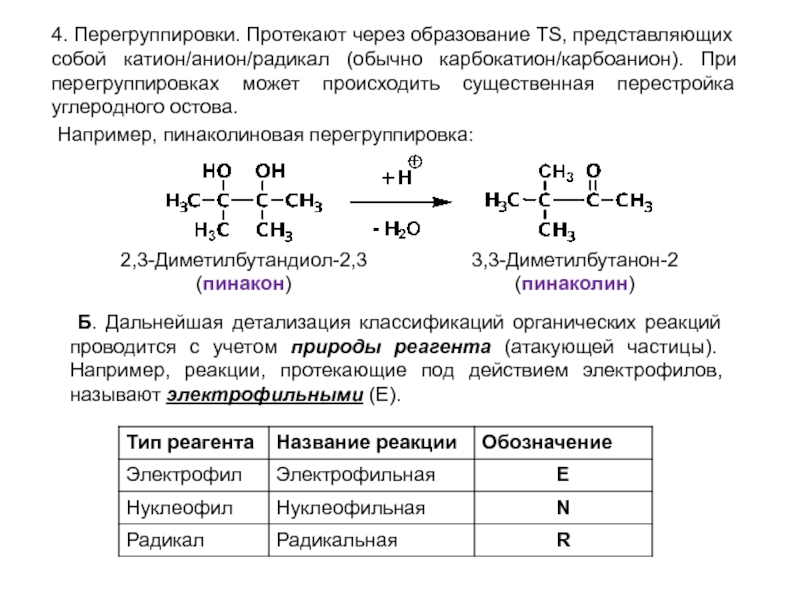
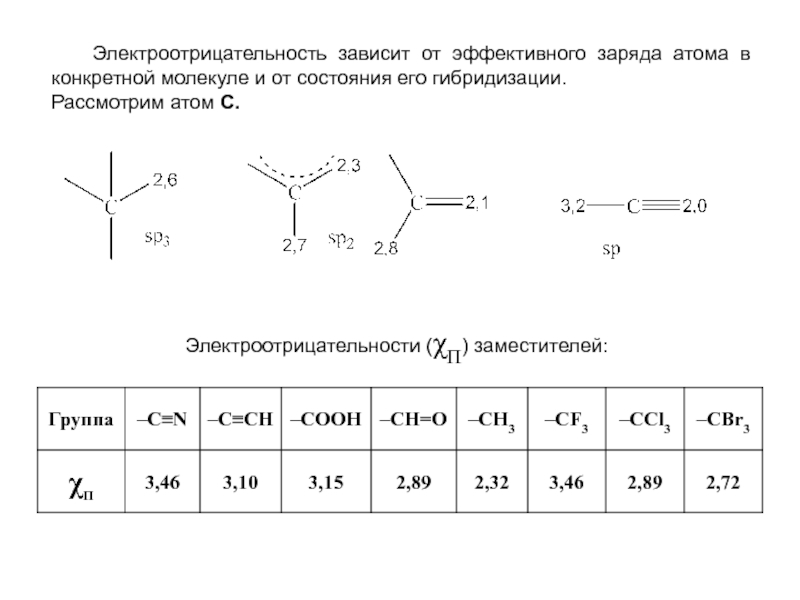
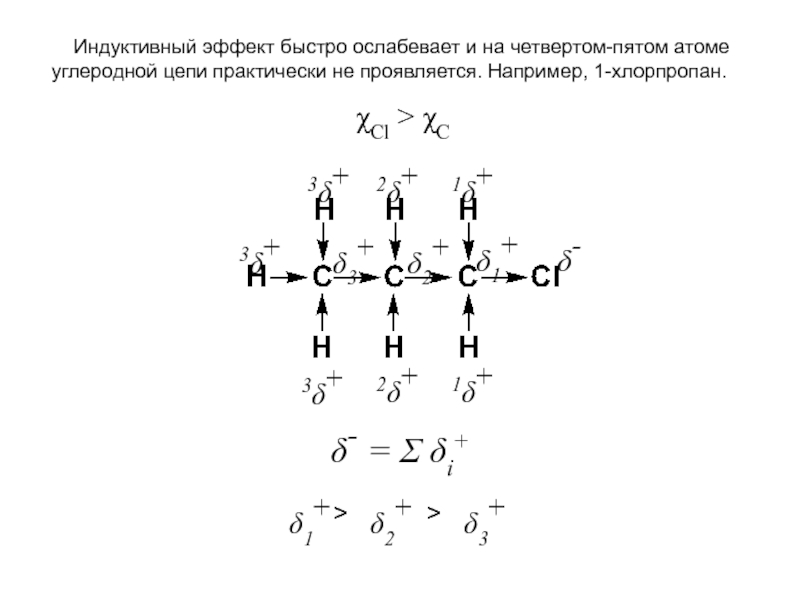
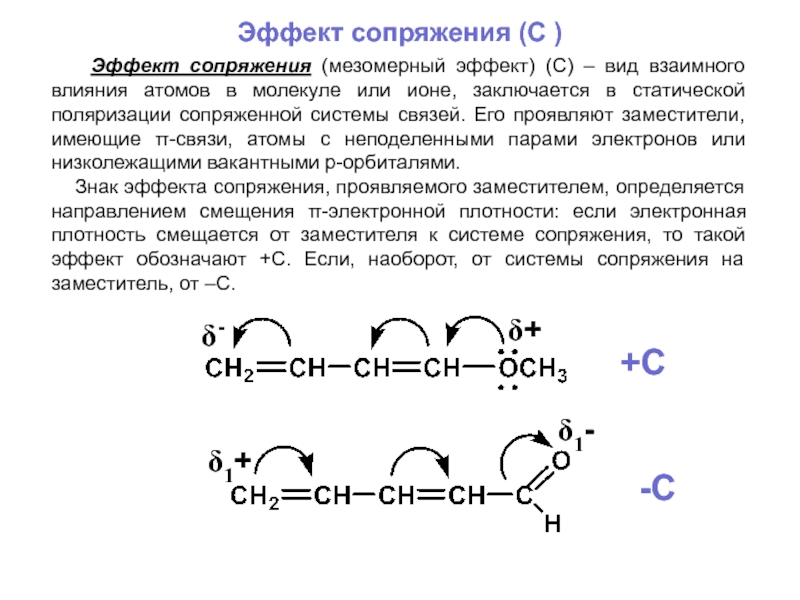
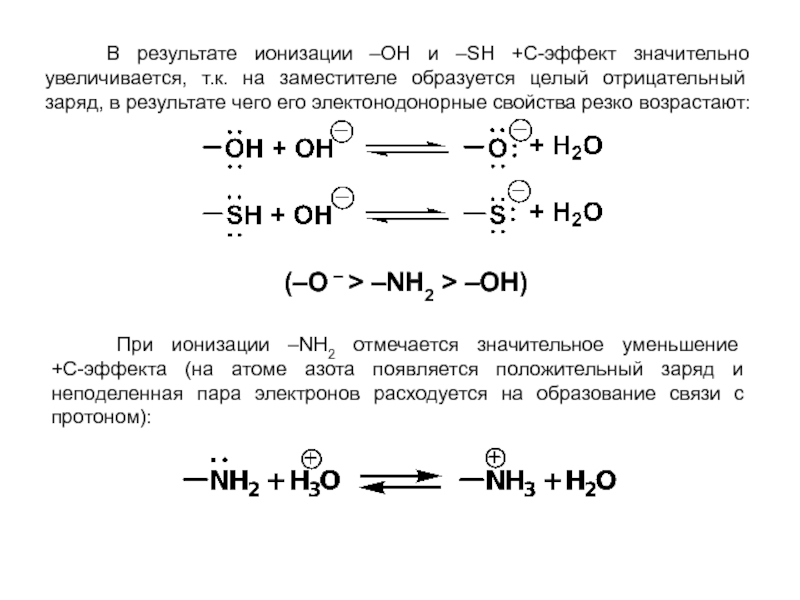
органических веществ в продукты при неизменности ядер атомов. При этом
происходит перераспределение электронов и ядер, в результате чего образуются новые химические вещества.Химические реакции могут осуществляться как в один элементарный акт (стадию) – простые реакции, так и через последовательность отдельных стадий – сложные реакции.
Если стабильные или нестабильные продукты лежат на пути превращения исходных веществ в конечные, т. е. являются промежуточными, а не побочными, то реакция может быть разбита на ряд элементарных стадий, каждая из которых характеризуется энергией активации и переходным состоянием.
Знание расположения атомов в переходном состоянии, природы взаимодействия, способов разрыва/образования связей, энергии системы в каждый данный момент времени дает представление о механизме элементарных стадий, а совокупность знаний о механизме элементарных стадий дает представление о механизме реакции в целом.