Слайд 1 Химическая связь и межмолекулярное взаимодействие
Квантовохимический анализ межмолекулярных взаимодействий
Межмолекулярные
взаимодействия определяют механизм столкновений молекул, некоторые стадии химических реакций, а
также существование молекулярных жидкостей и твердых тел и их свойства: термодинамические и кинетические характеристики, энергию сцепления, равновесную геометрию, фононные спектры и др. Они обусловлены слабыми дальнодействующими силами и лежат в пределах 1-40 кДж/моль, что по крайней мере на порядок меньше, чем энергия внутримолекулярной связи.
Уравнение Ван-дер-Ваальса, описывающее состояние реальных газов, содержит константу, учитывающую притяжение молекул. Поэтому силы притяжения между нейтральными атомами и молекулами на больших расстояния, называют ван-дер-ваальсовыми.
Источники сведений о межмолекулярных взаимодействиях - эксперименты по рассеянию атомных и молекулярных пучков, термофизические измерения свойств жидкостей и газов, измерения энергий сублимации, фононных спектров и упругих характеристик кристаллов, спектроскопические измерения колебательно-вращательных спектров, времен спиновой и спиново-решеточной релаксации и др. Все эти методы дают косвенную информацию и не позволяют установить природу взаимодействий: последнее является задачей квантовой химии.

Слайд 2Два подхода к квантово-химическому описанию межмолекулярных взаимодействий.
1) Проводится вариационный
расчет комплекса АВС… и составляющих его молекул А, В, С,
... Энергия межмолекулярного взаимодействия,
Е(АВС…) - [Е(А)+Е(В)+Е(С)+…]
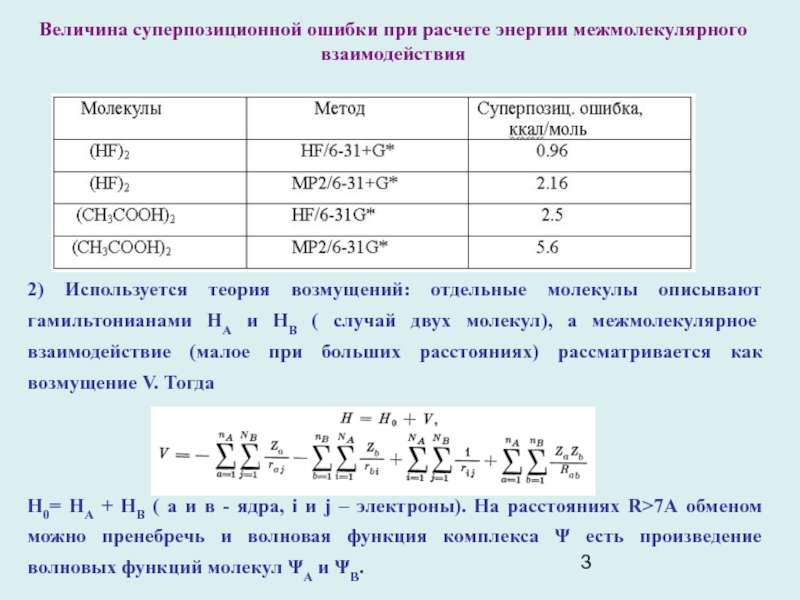
равна ~1% полной энергии и для ее расчета необходим учет электронной корреляции и широкий базисный набор, близкий к ХФ пределу.
Суперпозиционная ошибка базиса (basis set superpositional error - BSSE) является результатом использования более широкого набора базисных функций, относящихся ко всем молекулам, по сравнению с базисом, в котором рассчитывалась каждая молекула в отдельности. Она ведет к искусственно занижению энергии комплекса, т.е. к завышенной энергии взаимодействия. Чтобы исправить эту ошибку, энергию отдельной молекулы рассчитывают, включая в базис функции, центрированные на атомных центрах соседних молекул, полагая при этом, что заряды ядер последних равны нулю и беря число электронов равным таковому в рассматриваемой молекуле.
Слайд 3Величина суперпозиционной ошибки при расчете энергии межмолекулярного взаимодействия
2) Используется
теория возмущений: отдельные молекулы описывают гамильтонианами НА и НВ (
случай двух молекул), а межмолекулярное взаимодействие (малое при больших расстояниях) рассматривается как возмущение V. Тогда
Н0= НА + НВ ( а и в - ядра, i и j – электроны). На расстояниях R>7А обменом можно пренебречь и волновая функция комплекса Ψ есть произведение волновых функций молекул ΨА и ΨВ.
Слайд 4Уравнение Шредингера приобретает вид:
(НА+НВ) ΨАnΨВm
= (ЕАn+ЕВm) ΨАnΨВm
Квантовые числа n и m характеризуют состояния изолированных молекул.
Энергия прямого электростатического взаимодействия невозмущенных молекул определяется нулевым порядком теории возмущений:
Е0=<ΨАnΨВm⎮V⎮ΨАnΨВm> Это среднее значение оператора возмущения, вычисленное с невозмущенными волновыми функциями. Через электронные плотности:
электрон-ядерное взаимодействие
электрон-электронное
и ядер-ядерное взаимодействия
Вклады в энергию межмолекулярного взаимодействия, связанные со взаимной поляризацией молекул, описываются первым и вторым порядками теории возмущений.
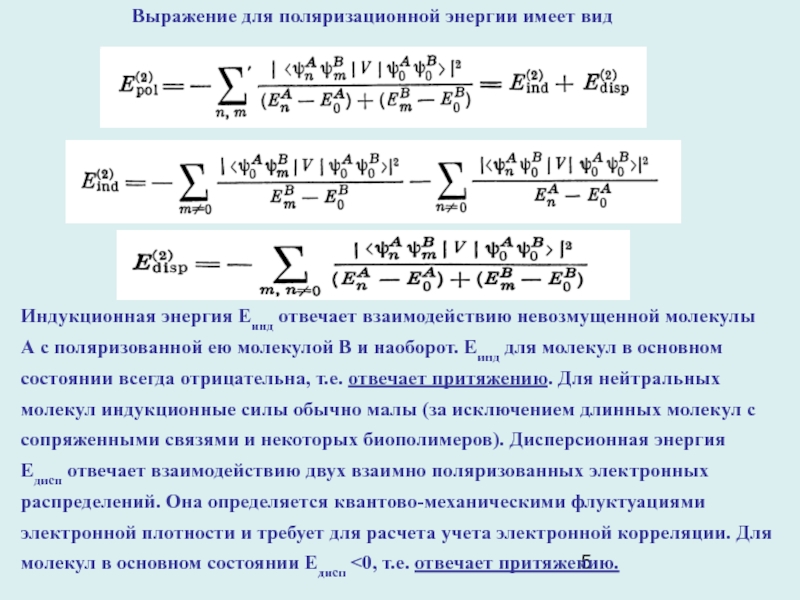
Слайд 5Выражение для поляризационной энергии имеет вид
Индукционная энергия Еинд отвечает взаимодействию
невозмущенной молекулы А с поляризованной ею молекулой В и наоборот.
Еинд для молекул в основном состоянии всегда отрицательна, т.е. отвечает притяжению. Для нейтральных молекул индукционные силы обычно малы (за исключением длинных молекул с сопряженными связями и некоторых биополимеров). Дисперсионная энергия Едисп отвечает взаимодействию двух взаимно поляризованных электронных распределений. Она определяется квантово-механическими флуктуациями электронной плотности и требует для расчета учета электронной корреляции. Для молекул в основном состоянии Едисп <0, т.е. отвечает притяжению.
Слайд 6На больших расстояниях между молекулами R их электронные плотности перекрываются
слабо, и каждый из перечисленных вкладов в энергию взаимодействия может
быть приближенно представлен суммой первых членов разложения энергии в ряд Тейлора по степеням величины 1/R. Это приводит к возникновению так называемых мультипольных моментов распределения заряда ∫rnσ(r)dV (n=0,1,2,…, σ(r)- полная плотность заряда), которые позволяют использовать для практических расчетов различные полуэмпирические методы, а также распределение электронной плотности, измеренное с помощью дифракции рентгеновских лучей.
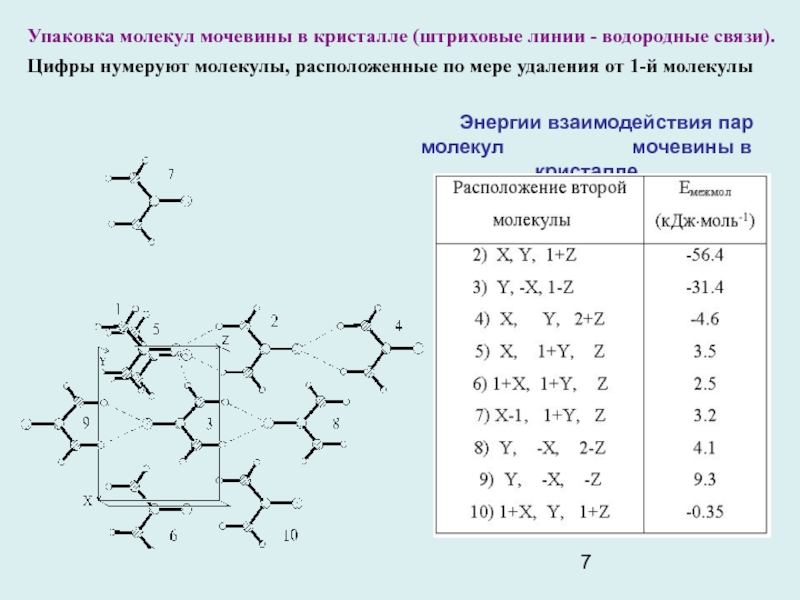
Кристаллохимический дизайн. Задача - конструирование новых веществ с заданными свойствами. Необходимое условие - адекватное понимание картины межмолекулярных взаимодействий, определяющее упаковку молекул в кристалле. Пример мочевины CO(NH2)2 , легко образующей комплексы с различными молекулами и обладающей в кристалле нелинейными оптическими свойствами. Молекулы расположены парами «голова к хвосту», образуя за счет водородных связей ленты вдоль оси с тетрагональной кристаллической ячейки. Плоскость каждой ленты перпендикулярна плоскости другой ленты, ориентированной в противоположном направлении. Расчет объясняет причину такой организации кристалла. Расчет дает ЕМЕЖМОЛ -90,5 кДж⋅моль-1, близкую к экстраполированной к 0 К энергии сублимации кристалла мочевины 98,6 кДж⋅моль-1.

Слайд 7Упаковка молекул мочевины в кристалле (штриховые линии - водородные связи).
Цифры нумеруют молекулы, расположенные по мере удаления от 1-й молекулы
Энергии взаимодействия пар молекул мочевины в кристалле
Слайд 8Приближенные схемы для больших молекул (биологические и фармакологические задачи)
1.
Молекулярный комплекс разбивается на молекулярные фрагменты, волновая функция каждого из
которых выбирается как детерминант Слейтера, составленный из дважды занятых электронами орбиталей. Центры локализации и параметры орбиталей варьируются, чтобы обеспечить минимум энергии фрагмента (орбитали после этого не являются «правильными», ибо оказываются центрированными на связях и т.д.). Полученные оптимизированные функции используются затем для ССП-расчета МО комплекса. В итоге - хорошие результаты при малом базисе.
2. Базис составляют из локализованных гибридных АО (большое число многоцентровых интегралов в методе ССП становится пренебрежимо малым по величине), к ним добавляют функции, центрированные на связях. Взаимодействие описывается с помощью теории возмущений, что автоматически учитывает электронную корреляцию. Для приемлемой оценки ЕМЕЖМОЛ достаточно ограничиться 3-им порядком теории возмущений.
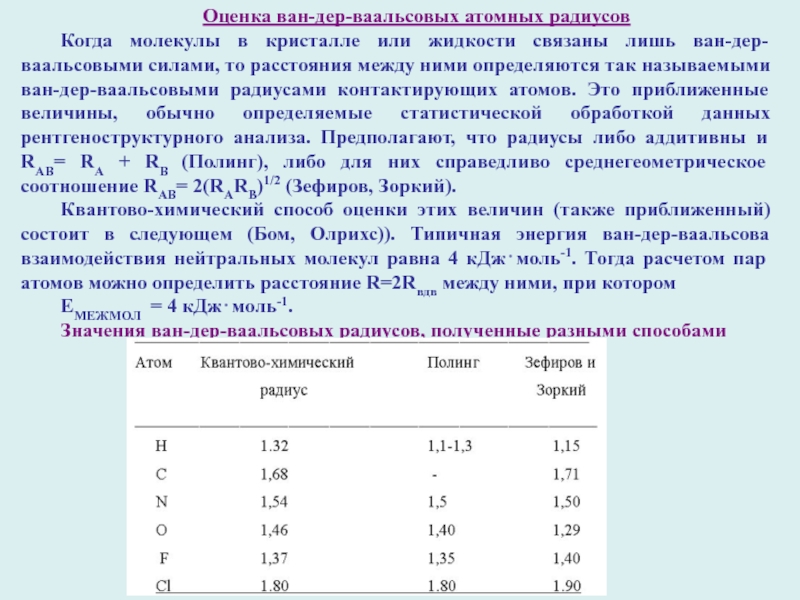
Слайд 9Оценка ван-дер-ваальсовых атомных радиусов
Когда молекулы в кристалле или жидкости связаны
лишь ван-дер-ваальсовыми силами, то расстояния между ними определяются так называемыми
ван-дер-ваальсовыми радиусами контактирующих атомов. Это приближенные величины, обычно определяемые статистической обработкой данных рентгеноструктурного анализа. Предполагают, что радиусы либо аддитивны и RАВ= RА + RВ (Полинг), либо для них справедливо среднегеометрическое соотношение RАВ= 2(RАRВ)1/2 (Зефиров, Зоркий).
Квантово-химический способ оценки этих величин (также приближенный) состоит в следующем (Бом, Олрихс)). Типичная энергия ван-дер-ваальсова взаимодействия нейтральных молекул равна 4 кДж⋅моль-1. Тогда расчетом пар атомов можно определить расстояние R=2Rвдв между ними, при котором
ЕМЕЖМОЛ = 4 кДж⋅моль-1.
Значения ван-дер-ваальсовых радиусов, полученные разными способами
Слайд 10Донорно-акцепторные молекулярные комплексы
Молекулярные комплексы - группы связанных между собой
молекул. В них одни из молекул, обладающие слабо связанными электронами,
являются донорами, а другие – акцепторами электронов. Примеры:системы бензол-I2, гидрохинон-хинон, NH3∙BH3. Молекула NH3, имеет неподеленную электронную пару на атоме N, а акцептор BН3 имеет вакантную 2р орбиталь с низкой энергией. Доноры служат восстановителями или основаниями Льюиса, акцепторы – окислителями или кислотами Льюиса. Эти свойства проявляются только для определенных пар в комплексе: одно и то же соединение может быть как донором (бензол по отношению к молекуле иода), так и акцептором (бензол по отношению к щелочному металлу).
Волновая функция основного состояния ДА комплекса есть линейная комбинация антисимметризованных произведений нейтральных и ионизированных молекул: ΨАΨД и ΨА−ΨД+. Величина примеси ионизированных состояний зависит от степени переноса заряда от одной молекулы к другой: перенос заряда стабилизирует систему.
Понятие «перенос заряда» следует понимать в том же смысле, что и понятие «валентная структура» в методе валентных связей: волновая функция включает примеси состояния, отвечающего ионизированным молекулам комплекса. Реальное смещение электронов, конечно, имеет место, хотя количественно точно определить его невозможно.

Слайд 11Энергия взаимодействия донора и акцептора
ΔЕ геом , ΔЕ эл,
ΔЕ обм, ΔЕ поляр, ΔЕ перенос заряда описывают вклады,
связанные с геометрическим искажением структуры при образовании комплекса, электростатическим взаимодействием, обменным отталкиванием, поляризацией и
переносом заряда внутри комплекса.
ΔЕ поляр и ΔЕ перенос заряда можно визуализировать.
ΔЕ поляр есть разность между энергией мономеров, описываемых антисимметризованным и простым (функция Хартри) произведением волновых функций каждого из них.
ΔЕ перенос заряда есть разность между энергией комплекса и энергией мономеров, описываемых антисимметризованным произведением волновых функций каждого из них. Поляризация смещает ЭП к молекуле BH3 и, одновременно, - ЭП внутри этой молекулы из-за отталкивания от неподеленной электронной пары атома N.
Перенос заряда в основном обусловлен смещением электронов на пустую р-АО атома В. Величина переноса заряда по Малликену NH3 →BH3 равна 0,262 э.
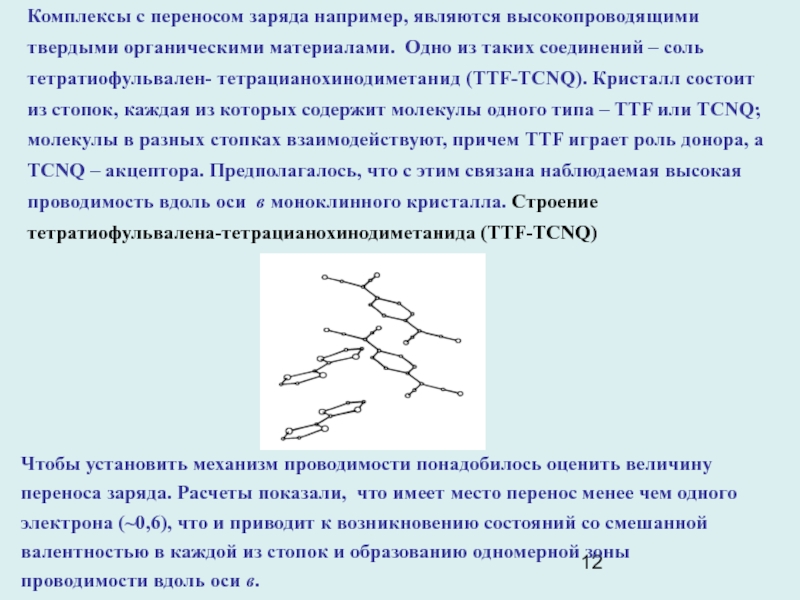
Слайд 12Комплексы с переносом заряда например, являются высокопроводящими твердыми органическими материалами.
Одно из таких соединений – соль тетратиофульвален- тетрацианохинодиметанид (TTF-TCNQ). Кристалл
состоит из стопок, каждая из которых содержит молекулы одного типа – TTF или TCNQ; молекулы в разных стопках взаимодействуют, причем TTF играет роль донора, а TCNQ – акцептора. Предполагалось, что с этим связана наблюдаемая высокая проводимость вдоль оси в моноклинного кристалла. Строение тетратиофульвалена-тетрацианохинодиметанида (TTF-TCNQ)
Чтобы установить механизм проводимости понадобилось оценить величину переноса заряда. Расчеты показали, что имеет место перенос менее чем одного электрона (~0,6), что и приводит к возникновению состояний со смешанной валентностью в каждой из стопок и образованию одномерной зоны проводимости вдоль оси в.
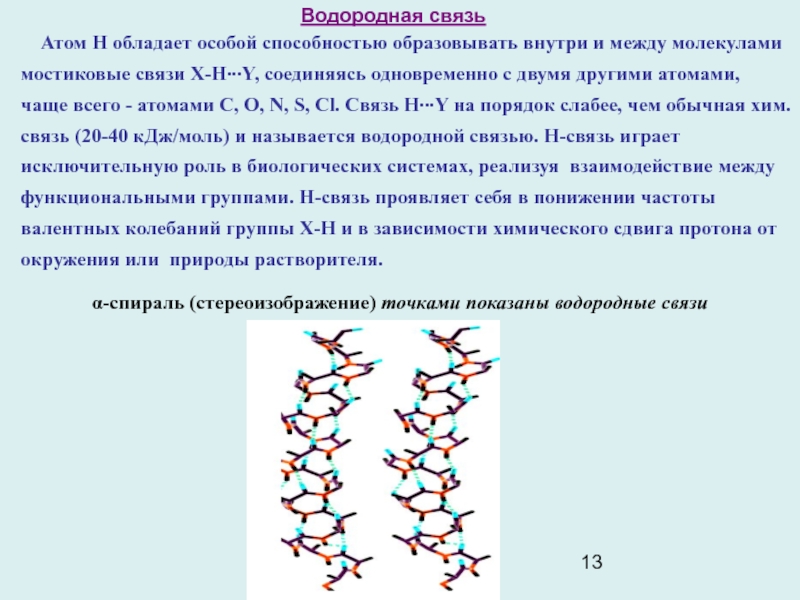
Слайд 13Водородная связь
Атом Н обладает особой способностью образовывать внутри
и между молекулами мостиковые связи X-H∙∙∙Y, соединяясь одновременно с двумя
другими атомами, чаще всего - атомами С, О, N, S, Cl. Связь H∙∙∙Y на порядок слабее, чем обычная хим. связь (20-40 кДж/моль) и называется водородной связью. Н-связь играет исключительную роль в биологических системах, реализуя взаимодействие между функциональными группами. Н-связь проявляет себя в понижении частоты валентных колебаний группы X-H и в зависимости химического сдвига протона от окружения или природы растворителя.
α-спираль (стереоизображение) точками показаны водородные связи
Слайд 14 Общий подход к описанию Н-связи не отличается от
такового в случае межмолекулярных взаимодействий. Здесь также выделяют электростатическое взаимодействие
невозмущенных молекул, поляризацию, перенос заряда, обменное и дисперсионное взаимодействия. Расстояния между атомами, соединенными атомом Н, лежат в пределах 2,4 - 3,0 Å, соответственно, говорят о сильной, промежуточной и слабой водородной связи. В первой случае трехцентровое взаимодействие X-H∙∙∙Y с делокализацией электронной плотности доминирует и без привлечения квантово-химических представлений объяснить структуру Н-связи невозможно. В последнем случае для качественных заключений достаточно электростатического подхода, который, однако, не объясняет направленный характер водородной связи. Форма потенциальной энергии атома Н определяется расстоянием X-H∙∙∙Y, т.е. силой связи. Симметричные связи наиболее прочны.
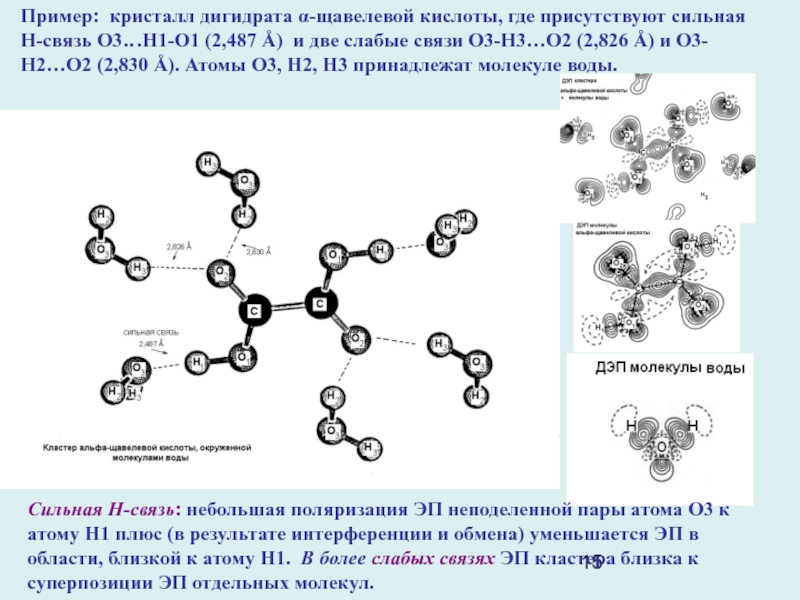
Слайд 15Сильная Н-связь: небольшая поляризация ЭП неподеленной пары атома О3 к
атому Н1 плюс (в результате интерференции и обмена) уменьшается ЭП
в области, близкой к атому Н1. В более слабых связях ЭП кластера близка к суперпозиции ЭП отдельных молекул.
Пример: кристалл дигидрата α-щавелевой кислоты, где присутствуют сильная Н-связь О3…Н1-О1 (2,487 Å) и две слабые связи О3-Н3…О2 (2,826 Å) и О3-Н2…О2 (2,830 Å). Атомы О3, Н2, Н3 принадлежат молекуле воды.
Слайд 16Специфические невалентные взаимодействия
В органических (и металлоорганических кристаллах) кратчайшие
расстояния между соседними молекулами меньше, чем сумма ван-дер-ваальсовых радиусов контактирующих
атомов. Это говорит о существовании некоторых дополнительных взаимодействий между этими атомами, которые называют специфическими невалентными взаимодействиями. Понять происхождение этих взаимодействий без квантово-химического анализа невозможно.
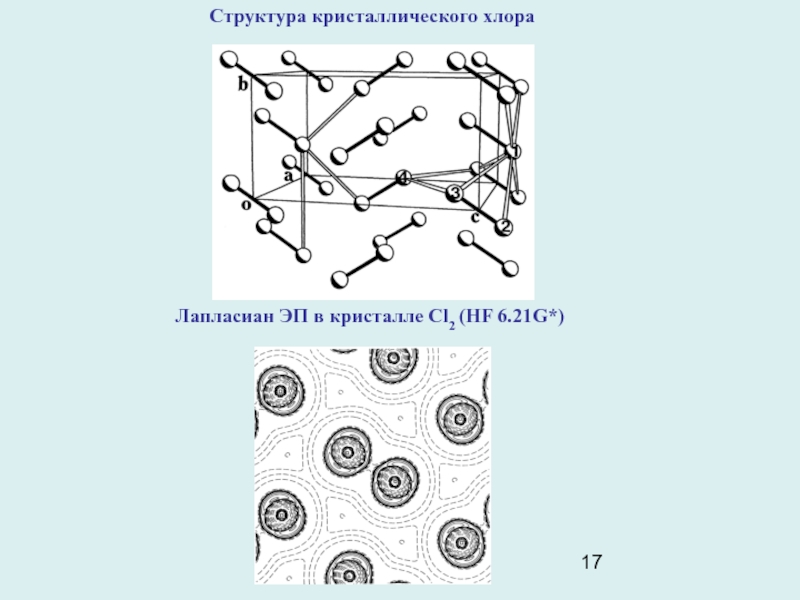
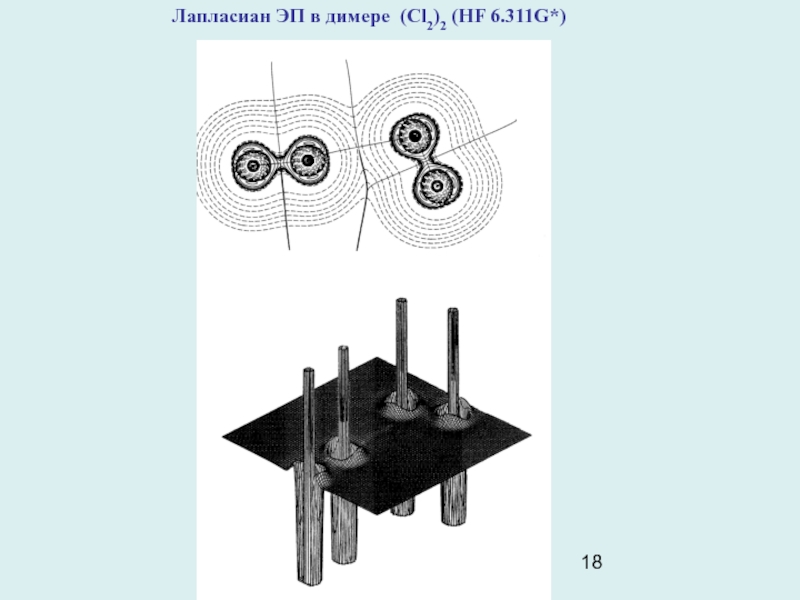
Пример: кристаллический молекулярный хлор. Молекулы Cl2 образуют в ромбической элементарной ячейке кристалла слои, параллельные плоскости вс, Кратчайшие расстояния между соседними молекулами в этой плоскости равно 3,284А. Это намного меньше, чем удвоенный ван-дер-ваальсов радиус атома Cl (3,6А). Расчеты ЕМЕЖМОЛ в кристалле Cl2, игнорировавшие наличие короткого контакта Cl- Cl, оказались безуспешными. Топологический анализ ЭП (HF 6.21G*) кристалла Cl2, показал, что между ближайшими атомами в слое имеется критическая точка (3,-1). Т.е. в кристалле Cl2 действительно имеет место некоторое связывающее взаимодействие между молекулами. Картина лапласиана ЭП прояснила его механизм:концентрации электронов в валентных оболочках Cl, ( неподеленные электронные пары), “смотрят” на области пониженной электронной плотности в соседних молекулах слоя. Из-за этого притяжение электронных пар к ядрам соседних атомов укорачивает контакт Cl-Cl. Такой же характер взаимодействия проявляется и в димере (Cl2)2 .

Слайд 17Структура кристаллического хлора
Лапласиан ЭП в кристалле Cl2 (HF 6.21G*)
Слайд 18Лапласиан ЭП в димере (Cl2)2 (HF 6.311G*)
Слайд 19Понятие о супрамолекулярной химии
В 70-е годы возникло новое мощное направление,
изучающее химическое, физическое и биологическое поведение молекулярных ансамблей, обусловленное невалентными
межмолекулярными взаимодействиями - супрамолекулярная химия. В ее задачи входит изучение следующих основных проблем.
1) Молекулярное распознавание – выбор данной молекулой молекул субстрата и их последующее связывание.
2) Супрамолекулярный катализ – преобразование связанных фрагментов в продукты в рамках данной супермолекулы.
3) Супрамолекулярные приборы – структурная организация молекулярных систем, позволяющая им выполнять последовательность элементарных операций и реагировать на сигналы определенным образом.
4) Программируемые супрамолекулярные системы – контролируемая самоорганизация супрамолекулярных фрагментов, сопровождающаяся строго определенным поведением.
Общим для всех этих проблем является то, что строительными блоками в сложных системах служат молекулы, объединяемые межмолекулярными силами.
Для их исследования могут быть применены все методы, рассмотренные ранее.