Слайд 1Министерство науки и высшего образования Российской Федерации
Российский химико-технологический университет имени
Д.И. Менделеева
Институт химии и проблем устойчивого развития
Кафедра ЮНЕСКО «Зеленая химия
для устойчивого развития»
8 ПРИНЦИП «ЗЕЛЁНОЙ» ХИМИИ:
ПРИМЕРЫ ПРАКТИЧЕСКОГО ПРИМЕНЕНИЯ
Москва, 2020
Преподаватель к.х.н., доцент
Занин А.А.
Магистрант Полтавский Е.А.
Работа на тему:
Слайд 2Зелёная химия (англ. green chemistry) — научное направление в химии,
к которому можно отнести любое усовершенствование химических процессов, которое положительно
влияет на окружающую среду. Как научное направление, возникло в 90-е годы XX века.
Слайд 3В 1998 году П. Т. Анастас и Дж. С. Уорнер
в своей книге «Зеленая химия: теория и практика» сформулировали двенадцать
принципов «Зеленой химии», которыми следует руководствоваться исследователям, работающим в данной области.
Слайд 4Последовательное использование принципов Зеленой химии приводит к снижению затрат на
производство, хотя бы потому, что не требуется вводить стадии уничтожения
и переработки вредных побочных продуктов, использованных растворителей и других отходов, — поскольку их просто не образуется.
Слайд 5Необязательные превращения (введение защитных заместителей и т.п.) всегда нежелательны.
Описание 8-ого
принципа
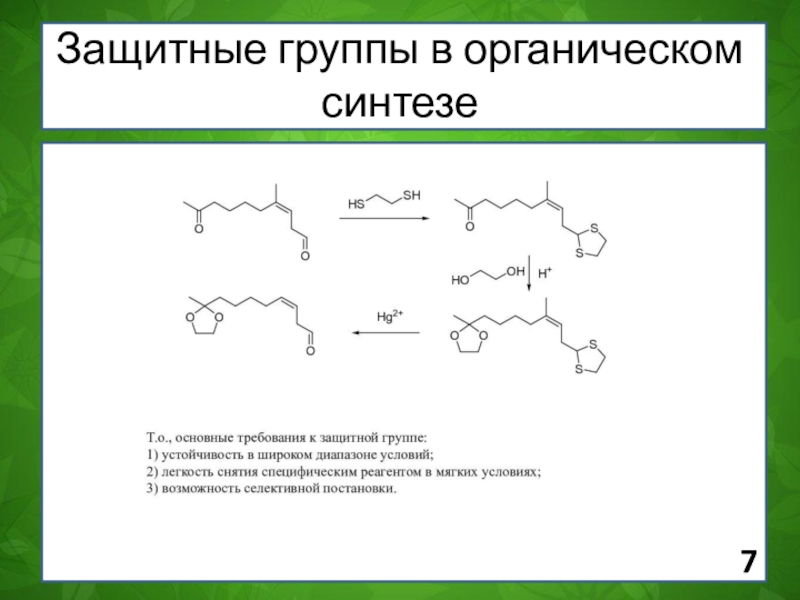
Слайд 7Защитные группы в органическом синтезе
Слайд 8Суть метода заключается во временном обратимом блокировании (защите) тех функциональных
групп, которые необходимо сохранить при проведении запланированных химических превращений по
другим частям молекулы.
Стадии блокирования групп
Слайд 9При этом реализуется следующая цепочка химических превращений: 1) введение защитной
группы (protecting group P) в исходный субстрат S; 2) реакция
между защищенным субстратом PS и используемым реагентом Y; 3) последующее удаление блокирующей группы P и образование продукта SY. P+S.
Слайд 10При любой возможности следует стараться проводить процесс получения целевого продукта
без образования и накопления промежуточных продуктов.
Слайд 11Вспомогательные стадии получения производных (защита функциональных групп, введение блокирующих заместителей,
временные модификации физических и химических процессов) должны быть по возможности
исключены.
Слайд 12Многие процессы органического синтеза, включают большое число стадий введения защитных
и блокирующих групп, которые затем удаляются и не входят в
состав конечного продукта (очень низкая атомная эффективность).
Слайд 13Разработка мягких и высокоселективных процессов
Региоселективные процессы
Стереоселективные процессы
Энантиоселективные процессы
Разработка катализаторов
Устранение необходимости
в неэффективных стадиях
Ферментативный катализ
Слайд 14Региоселективные процессы
Региоселективной (от лат. regio – направление и selectio –
выбор, отбор) называется реакция, в которой химич. изменения происходят преим.
при одном из нескольких возможных положений в молекуле (обычно эти молекулы имеют в каждом из таких положений функциональные группы сходного структурного типа). Напр., осн. продуктом взаимодействия пропена CH2CHCH3 с НВr является 2-бромпропан.
Слайд 15Стереоселективные процессы
Пример стереоселективного синтеза: эпоксидирование по Шарплессу
Стереонаправляющий фактор - некий
хиральный элемент (например, хиральный атом), который непосредственно не участвует в
реакции, но осуществляет асимметрическую индукцию, направляя формирование нового стереоцентра в сторону образования того или иного стереоизомера, причём такой элемент может находиться как в субстрате, так и в реагенте или катализаторе.
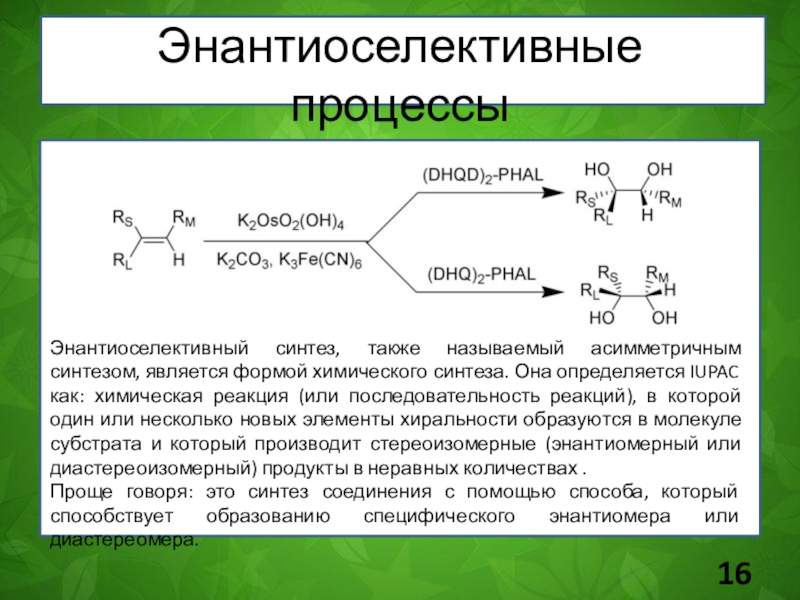
Слайд 16Энантиоселективные процессы
Энантиоселективный синтез, также называемый асимметричным синтезом, является формой химического
синтеза. Она определяется IUPAC как: химическая реакция (или последовательность реакций),
в которой один или несколько новых элементы хиральности образуются в молекуле субстрата и который производит стереоизомерные (энантиомерный или диастереоизомерный) продукты в неравных количествах .
Проще говоря: это синтез соединения с помощью способа, который способствует образованию специфического энантиомера или диастереомера.
Слайд 17Ферментативный катализ
Это каталитические реакции, протекающие с участием ферментов – биологических
катализаторов белковой природы. Ферментативный катализ имеет две характерные особенности:
1. Высокая
активность, на несколько порядков превышающая активность неорганических катализаторов, что объясняется очень значительным снижением энергии активации процесса ферментами.
2. Высокая специфичность. Например, амилаза катализирует процесс расщепления крахмала, представляющего собой цепь одинаковых глюкозных звеньев, но не катализирует гидролиз сахарозы, молекула которой составлена из глюкозного и фруктозного фрагментов.
Слайд 19Направление науки «зелёная химия» является перспективным и востребованным в современном
мире.
Применение 8 принципа «зелёной химии» приводит к снижению затрат
на производство, хотя бы потому, что не требуется вводить стадии уничтожения и переработки вредных побочных продуктов.
8 принцип «зелёной химии» напрямую связан с 12 ЦУР – «ответственное потребление и производство».
Выводы